特发性肺间质纤维化中TGF-β1诱导上皮-间充质细胞转化的研究
2013-12-16张素霞闫利娟罗本芳李惠萍易祥华
张素霞,顾 盼,闫利娟,罗本芳,李惠萍,易祥华
(1.同济大学附属同济医院病理科,上海 200065;2.洛阳市第二中医院病理科,河南洛阳 471003;3.同济大学附属肺科医院呼吸科,上海 200433)
IPF是特发性间质性肺炎(idiopathic interstitial pneuminia,IIP)的主要类型,在病理学上表现为普通型间质性肺炎(usual interstitial pneuminia,UIP)[1]。UIP/IPF的主要病理特点是Ⅱ型肺泡上皮细胞的增生,肌纤维母细胞的积聚及肺实质结构的异常重塑,其中的FF是其主要病理学特征之一,也是判断预后的重要形态特点之一[2]。对肌纤维母细胞来源的认识是理解IPF发病机制的关键。近年来研究发现TGF-β1可以诱导多种器官上皮细胞发生EMT,但这些证据主要源于细胞培养和动物模型,缺乏EMT在人体器官纤维化组织中出现的直接证据。本实验使用人体病理材料,采用组织芯片技术和免疫组化方法研究在IPF中TGF-β1诱导EMT的作用和机制,从而为探索IPF的分子靶向治疗提供人体病理学的证据。
1 材料与方法
1.1 标本来源
病例选自经病理诊断的25例UIP,正常肺组织作为对照,标本经电视胸腔镜或开胸肺活检取材。所有病例均有完整的临床、病理和随访资料,患者的最后诊断结合临床、影像和病理资料完成,即临床-影像-病理诊断(clinco-radiologic-pathologic diagnosis,CRP 诊断)[3-4]。
1.2 方法
1.2.1 试剂 TGF-β1抗体购自美国 Sata cruz公司,β-catenin、E-cadherin、α-SMA、Desmin、Vim、CK7和EnVision两步法免疫组化试剂盒购自Dako公司。
1.2.2 组织处理 肺部取材每例2~3块,分别于轻、中和重度病变处取材,组织块≥1.0 cm×0.7 cm×0.5 cm。所有组织标本常规10%中性甲醛固定,石蜡包埋,制作组织芯片[5],连续切片,切片厚4 μm,H-E染色,光镜和偏光镜观察做组织诊断。
1.2.3 免疫组化染色 采用EnVision法检测TGF-β1和 β-catenin,上皮标记物 E-cadherin和 CK7,以及间质标记物 α-SMA、Vim、Desmin在IPF患者病变肺组织中的表达。主要操作步骤如下:(1)常规组织切片经二甲苯脱蜡、梯度酒精水化后,PBS冲洗3次,每次3 min;(2)取一定量的pH=6.0的柠檬酸盐缓冲液,高温高压抗原修复法修复,PBS冲洗3次,每次3 min;(3)3%H2O2去离子水孵育10 min,以阻断内源性过氧化物酶,PBS冲洗3次;(4)适当稀释特异性一抗,37℃孵育30 min,PBS冲洗3次,每次3 min;(5)EnVision复合物(即用型)孵育30 min,PBS冲洗3次,每次3 min;(6)DAB显色,自来水冲洗,苏木精复染,脱水,二甲苯透明,树胶封片。
1.2.4 免疫组化阳性诊断标准及半定量分析 阳性细胞判断:凡细胞质或者细胞膜有棕黄色颗粒沉着为阳性染色。采用综合评分法,每例标本随机选取5个具有代表性的高倍视野,依据染色程度评定阳性细胞的分值:胞质未着色为0分,浅棕色为1分,棕色为2分,深棕色为3分;根据阳性细胞占所有细胞的百分比进行评分:≤5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分。上述2项指标的积分相乘为最后得分:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++)。
1.3 统计学处理
采用SPSS11.5软件对所有实验数据进行统计分析,计量资料用±s表示,组内差别用配对t检验,所有统计均采用双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床特点
25例UIP/IPF患者中,男17例,女8例,年龄27~75岁,中位年龄58岁,主要症状为活动后气促、咳嗽、咳痰等。25例患者双肺均可闻及吸气性爆破音(velcro啰音),16例患者可见杵状指。肺功能异常主要为限制性通气功能障碍和(或)弥散功能障碍。高分辨CT表现为双肺不对称性的片状和网状影,少量毛玻璃影,尤以中下肺和胸膜下为主,常有牵引性支气管和细支气管扩张(图1)[4]。

图1 双肺高分辨CT扫描Fig.1 High-resolution CT scan of bilateral lungs
2.2 光镜观察
低倍镜下病变轻重不一,分布不一致,可见间质炎症、纤维化和蜂窝肺与正常肺组织呈交替分布,Ⅱ型肺泡上皮细胞增生,成纤维细胞灶形成,以及纤维组织增生伴胶原沉积(图2)。
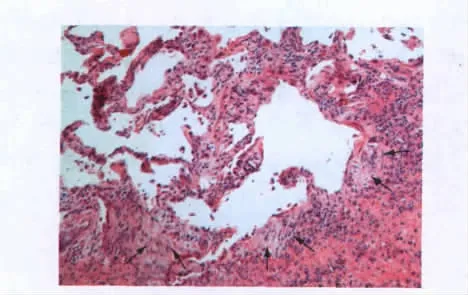
图2 肺组织H-E染色结果Fig.2 H-E staining of lung tissue(H-E,×100)
2.3 免疫组化检测
TGF-β1、β-catenin、α-SMA、Desmin、Vim、E-cadherin、CK7蛋白在正常及IPF患者肺组织的表达情况:正常肺组织中,肺泡上皮细胞无TGF-β1的表达;肺间质表达Vim,但无表达α-SMA的肌纤维母细胞;Desmin仅在细支气管壁及血管壁的平滑肌上表达;β-catenin与E-cadherin在细支气管上皮细胞中表达,且定位于细胞膜。在IPF患者病变肺组织中,肺间质内出现了同时表达α-SMA和Vim,但不表达Desmin的肌纤维母细胞,这有助于将其与真正的平滑肌细胞区别;IPF患者肺病灶组织中FF较多的区域与无FF区域相比,Ⅱ型肺泡上皮细胞、巨噬细胞和肌纤维母细胞中TGF-β1的表达明显增高(P<0.01,图3,表1);有 FF区域Ⅱ型肺泡上皮细胞β-catenin和E-cadherin的胞膜表达较无FF区域明显减弱(P<0.01),而胞浆中的表达则明显增加(P<0.01,表2);同时发现有FF区域Ⅱ型肺泡上皮细胞表达间质标记物Vim和上皮标记物CK7,但无α-SMA的表达,而无FF区域Vim和α-SMA在上皮细胞中均不表达。
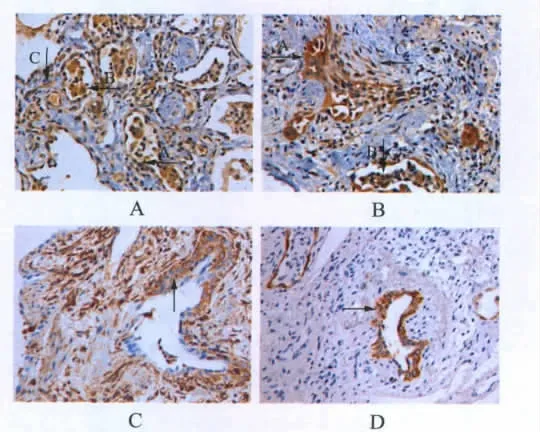
图 3 TGF-β1、Vim、CK7 在肺组织中的表达Fig.3 Expressions of TGF-β1,Vim and CK7 in lung tissues

表1 TGF-β1在IPF患者病变肺组织各类细胞中的表达及分布情况Tab.1 The expression and distribution of TGF-β1 in lung tissue of IPF patients
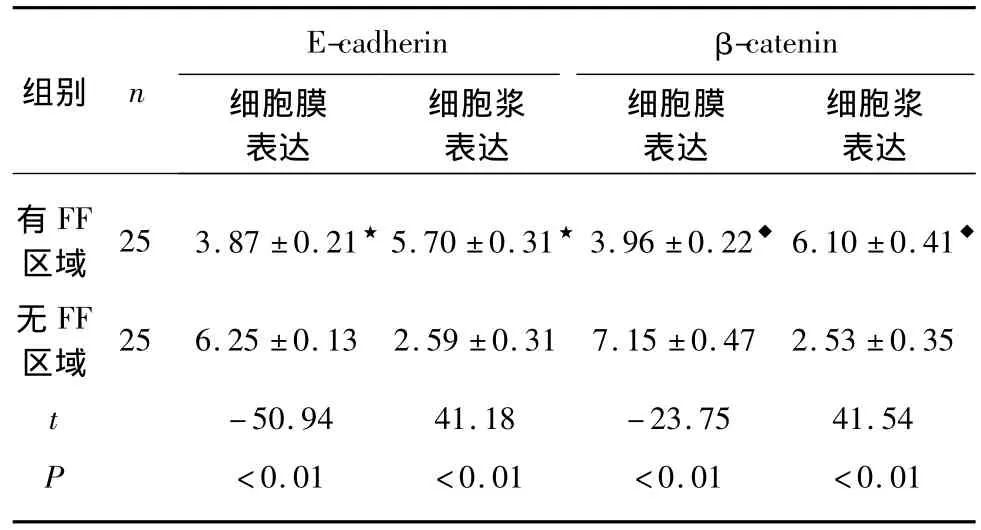
表2 E-cadherin和β-catenin在IPF患者病变肺组织的表达及定位情况Tab.2 The expression and distribution of E-cadherin and β-catenin in lung tissue of IPF patients
3 讨 论
UIP/IPF是IIP最常见的一种类型,它是一种原因不明,以弥漫性肺纤维化、肺功能损害和呼吸困难为特点的临床综合征。无特效治疗方法严重威胁着人类的健康。在IPF的进展过程中,肺组织结构的重塑是一个复杂的相互关联的过程,包括免疫炎症,血管生成,上皮细胞的增生与凋亡以及肌纤维母细胞的增殖等[6]。EMT是指上皮细胞失去极性,上皮细胞标记物E-cadherin等表达下调,间叶标记物Vim、成纤维细胞特异蛋白1(FSP1)以及α-SMA表达上调,同时细胞骨架重组使其形态改变,最终演变成间充质细胞(主要是成纤维细胞和肌纤维母细胞)的过程。其中,α-SMA是成纤维细胞亚群和活化的成纤维细胞(肌成纤维细胞)所分泌的特征性蛋白,是造成细胞外基质沉着的重要原因。本研究选择E-cadherin和CK7作为上皮细胞标记物,α-SMA、Desmin和Vim作为间叶以及EMT的标记物,可以有效评价EMT的转化。
研究发现EMT是器官纤维化局灶成纤维细胞的重要来源,在慢性纤维化的发生和发展过程中发挥着重要的作用,然而这种转化的具体机制尚未完全阐明。对肺纤维化中肌纤维母细胞起源的研究主要集中于两种细胞,即Ⅱ型肺泡上皮细胞和细支气管上皮细胞。有研究报道[7],博莱霉素诱导的肺纤维化小鼠模型中气道上皮细胞和肺泡上皮细胞均能向间充质细胞转化,从而参与肺纤维化的病理过程。Marmai等[8]研究发现,从IPF患者肺病变组织分离出来的Ⅱ型肺泡上皮细胞中Ⅰ型胶原、α-SMA及calponin的mRNA水平明显高于正常的Ⅱ型肺泡上皮细胞。因此,本实验采用组织芯片和免疫组化方法研究IPF患者肺病变组织Ⅱ型肺泡上皮细胞中EMT的转化。研究结果发现,与无FF区域相比,有FF区域增生的Ⅱ型肺泡上皮细胞E-cadherin胞膜的表达降低,而胞浆的表达增加;同时发现其表达间质标记物Vim,但无α-SMA的表达。Yamada等[9]应用双重染色方法研究也未发现在IPF中存在同时表达上皮标记物E-cadherin和间质标记物Vim或α-SMA的双重阳性细胞。Lomas等[10]研究发现,FF表面被覆的Ⅱ型肺泡上皮细胞表达E-cadherin和N-cadherin,而不表达α-SMA和Ⅰ型胶原。
TGF-β1是纤维化发展过程中细胞因子的网络枢纽,其通过促进细胞外基质的沉积、促进成纤维细胞的增殖和转化、诱导EMT的发生以及协同其他细胞因子如血小板源生长因子、结缔组织生长因子等参与肺纤维化的形成[11]。TGF-β1诱导 EMT的信号通路分为依赖Smad信号通路和非依赖Smad信号通路。Gu等[12]用博来霉素诱导肺纤维化小鼠模型的研究发现,在肺泡上皮的损伤中,TGF-β1可以通过依赖Smad的方式诱导肺泡上皮细胞发生EMT,其中 Smad3发挥了重要的作用。Chilosi等[13]研究发现IPF患者肺病灶组织内Ⅱ型肺泡上皮细胞中β-catenin向细胞核内转移,同时发现成纤维细胞灶内也有β-catenin向细胞核内转位的现象,这表明Wnt/β-catenin信号途径也参与了肺纤维化的发病过程。经典 Wnt信号通路[14],即 Wnt/βcatenin信号通路在胚胎发育与肿瘤发生中的作用已备受关注,其可以与其他信号通路协同促进肿瘤的发生,是属于非依赖Smad信号通路的一种。本研究结果表明,在IPF患者病变肺组织中,与无FF区域相比,有FF区域增生的Ⅱ型肺泡上皮细胞TGF-β1的表达明显增加,E-cadherin和β-catenin细胞膜的表达明显降低,而胞浆的表达则明显增加,但未发现细胞核的表达,这表明Wnt/β-catenin信号通路激活后,β-catenin被磷酸化,E-cadherin/β-catenin复合体的稳定性降低,E-cadherin介导的粘附功能下降,β-catenin在胞质中堆积,从而使生长信号不断传入细胞核,促进细胞的增殖。本研究结果表明,TGF-β1和Wnt/β-catenin两条信号通路有可能通过相互交叉作用诱导肺泡上皮细胞发生EMT,但完整的组织学证据不足。这提示EMT可能不是IPF的唯一致病机制,它反映了疾病的某个特定的阶段而非疾病的全过程;另一方面,有可能此时上皮和间质标记的抗原水平较低,免疫组化的方法尚无法检测出。
本实验使用IPF患者病理材料,采用组织芯片和免疫组化技术,研究了IPF中TGF-β1诱导EMT的作用和机制。研究结果初步显示TGF-β1和βcatenin有可能通过相互交叉作用诱导Ⅱ型肺泡上皮细胞发生EMT,从而参与肺间质纤维化的发生。IPF的发生和发展是一个涉及多种细胞和生物因素的复杂过程,对EMT的认识还需要更多的实验对象及较长时间的研究,以便更好地了解肺纤维化中的EMT现象及其所涉及的信号通路,以期为探索肺纤维化疾病的发病机制及其分子靶向治疗提供一个更广阔的思路。
[1] American TS,European RS.American thoracic society/european respiratory Society international multidisciplinary Consensus Classification of the idiopatic interstitial pneumonias[J].Am J Respir Crit Care Med,2002,165:277-304.
[2] 易祥华,刘鸿瑞.特发性间质性肺炎的ATS/ERS分类及病理诊断[J].中华病理学杂志,2004,33(2):171-175.
[3] 吴西雅,易祥华,李惠萍,等.糖皮质激素治疗特发性非特异性间质性肺炎疗效的回顾性调查[J].中华结核和呼吸杂志,2010,33(8):593-596.
[4] 易祥华,李惠萍,何国钧,等.普通型间质性肺炎的临床病理特征及其与特发性非特异性间质性肺炎的鉴别诊断[J].中华病理学杂志,2004,33:100-104.
[5] 芮炜玮,李惠萍,易祥华,等.血小板源性生长因子在UIP和NSIP中差异表达的研究[J].同济大学学报:医学版,2010,32(3):37-42.
[6] Kogan EA,Tyong FV,Demura SA.The mechanism oflung tissue remodeling in the progression of idiopathic pulmonary fibrosis[J].Arkh Patol,2010,72(4):30-36.
[7] 蔡琳,吴壮,徐军.博莱霉素诱导α平滑肌肌动蛋白Cre重组酶转基因小鼠肺纤维化上皮细胞-间质转分化的研究[J].中国呼吸与危重杂志,2009,8(1):52-56.
[8] Marmai C,Sutherland RE,Kim KK,et al.Alveolar epithelial cells express mesenchymal proteins in patients with idiopathic pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2011,301(1):71-78.
[9] Yamada M,Kuwano K,Maeyama T,et al.Dualimmunohistochemistry provides little evidence for epithelial-mesenchymal transition in pulmonary fibrosis[J].Histochem Cell Biol,2008,129(4):453-462.
[10] Lomas NJ,Watts KL,Akram KM,et al.Idiopathic pulmonary fibrosis:immunohistochemical analysis provides fresh insights into lung tissue remodelling with implications for novel prognostic markers[J].Int J Clin Exp Pathol,2012,5(1):58-71.
[11] 芮炜玮,易祥华.转化生长因子β1及相关细胞因子在肺纤维化发生中的作用[J].同济大学学报:医学版,2010,31(3):133-136.
[12] Gu L,Zhu YJ,Yang X,et al.Effect of TGF-beta/Smad signaling pathway on lung myofibroblast differentiation[J].Acta Pharmacol Sin,2007,28(3):382-391.
[13] Chilosi M,Poletti V,Zamò A,et al.Aberrant Wnt/β-catenin pathway activation in idiopathic pulmonary fibrosis[J].Am J Pathol,2003,162(5):1495-1502.
[14] 方霞,易祥华.Wnt/β-catenin和EGFR信号通路在非小细胞癌发生发展中的作用[J].同济大学学报:医学版,2012,33(1):105-109.
