不同血清浓度对淋巴管内皮细胞培养的影响
2013-12-09葛敏蒋朝华戴婷婷程佳李圣利
葛敏 蒋朝华 戴婷婷 程佳 李圣利
淋巴系统对于维持人体内环境的稳定、引流组织间隙的体液、免疫功能的发挥具有重要的意义,这些功能的发挥与淋巴管内皮细胞(Lymphatic endothelial cells,LECs)的功能密切相关。淋巴管生成(lymphangiogenesis)是在既存淋巴管基础上的淋巴管新生。在炎症及肿瘤过程中,淋巴管生成参与了组织的修复及肿瘤的转移[1-2]。这是目前淋巴学研究领域的重要内容,也是研究淋巴管畸形、淋巴水肿以及肿瘤转移等疾病的基础。LECs培养不易,成活和传代较困难,是目前亟需解决的问题。
本实验采用不同血清浓度的培养基培养LECs,探讨不同血清浓度对于LECs培养的影响,探索稳定、高效的LECs培养方法,为组织工程构建淋巴管的研究提供实验基础。
1 材料与方法
1.1 实验材料
EGM-2-MV(Lonza 公司,美国);DMEM-高糖(Hyclone公司,澳大利亚);胰酶/EDTA消化液(Hyclone公司,澳大利亚);胶原酶(Serva公司,德国);中性蛋白酶 (Roche公司,美国);流式抗体Podoplanin(eBioscience 公司,美国);低密度脂蛋白Dil-Ac-LDL(Invitrogen 公司,美国);metrigel(BD 公司,美国);免疫荧光抗体podoplaningon(Angiobio公司,美国);PCR 引物(捷瑞生物公司,中国);CD31阳性磁珠(Dynal公司,美国);纤维连接蛋白(Sigma公司,美国);血清(Gibco 公司,美国)。
1.2 仪器设备
超净工作台(上海医疗器械公司);CO2培养箱(GmbH公司,德国);倒置相差显微镜(Olympus公司,日本);流式细胞仪(BD 公司,美国);M-CBAD全自动显微照相机(Olympus公司,日本);PCR仪(Biometra公司,德国)。
1.3 细胞分离和培养
经知情同意后,留取环切术幼儿包皮,彻底洗净,去除皮下疏松组织,中性蛋白酶结合胶原酶消化,CD31阳性磁珠分选获得CD31+细胞[3]。用完全内皮细胞培养基EGM-2重悬,计数,调整细胞密度至1×105cells/mL后,接种于用20 ng/mL纤维连接蛋白铺底的6孔板中培养。5~6 d换液1次。细胞生长到90%融合后,0.05%的胰蛋白酶消化,1∶3传代于6孔板中。
1.4 细胞鉴定
1.4.1 细胞免疫荧光鉴定[4-6]
4%多聚甲醛固定10min,PBS漂洗3次,滴加兔抗人 Podoplanin 抗体(1∶500),4 ℃过夜;PBS 漂洗3次,滴加PE荧光二抗,37℃孵育30min;PBS漂洗 3 次,加入 DAPI(1∶1000),PBS 漂洗 3 次,荧光显微镜观察。
1.4.2 细胞RT-PCR鉴定[7-8]
取第3代CD31+细胞,Trizol法进行RNA抽提。RT 反应体系:25 mmol/L MgCl24μL,10×逆转录缓冲液 2μL,10 mmol/L dNTP 2μL,40 U/μL RNase 抑制剂 0.5μL,5 U/μL AMV 逆转录酶 1μL,200 ng/μL Oligo dT-Adaptor Primer 1μL,RNA 2 μg, 加 无RNase水至 20μL。RT反应条件:30℃10min,42 ℃60min,99 ℃5min,5 ℃5min。 PCR 引物序列:人Prox-1上游引物为5'-CTCATAAAGTCCGAGTGCG-3',下游引物为5'-AACATCTTTGCCTGCGATA-3',产物 446 bp;人 Podoplanin上游引物为 5'-GTGTAACAGGCATTCGCATCG-3',下游引物为 5'-GGCAAGTGTTCCACGGGTC-3', 产物 321 bp;人Lyve-1上游引物为5'-GTTTCTTTCATGCTCCTTACCC-3',下游引物为 5'-GTCTCAGTGACTCCTTGGCTTT-3',产物 354 bp;人 VEGFR-3 上游引物为5'-CATCCAGCTGTTGCCCAGG',下游引物为5'-GAGCCACTCGACGCTGATGAA-3',产物 321 bp;人β-actin上游引物为5'-ATCATGTTTGAGACCTTCAA-3',下游引物为 5'-CATCTCTTGCTCGAAGTCCA-3',产物 318 bp。反应体系:ddH2O 13.2μL,25 mmol/L MgCl21.6μL,10×逆转录缓冲液2μL,10 mmol/L dNTP 0.5μL,5 U/μL Taq 酶 0.5μL,cDNA 1.0μL,20 pmol/μL 目的基因上下游引物各0.3μL。 反应条件:95 ℃变性 5min;95 ℃ 30 sec、55 ℃30 sec、72 ℃ 30 sec,共 35个循环;72 ℃延伸 10min。电泳、图像分析:PCR产物10μL经1.2%琼脂糖,70 V电压电泳1.5 h后,进行图像分析。
1.4.3 流式细胞仪鉴定
淋巴管内皮特异性标志Podoplanin鉴定:消化制备单细胞悬液,第3代细胞生长到90%融合后,0.05%胰蛋白酶消化,DMEM培养液终止消化,含4%胎牛血清(FBS)的PBS稀释打匀,单细胞滤器过滤,1500 r/min离心5min,弃上清,沉淀细胞用含4%FBS的PBS重悬,打匀,计数,配成1×106cells/mL细胞悬液备用。冰盒上操作,细胞悬液分装入流式细胞仪专用检测试管,每管约2×105个细胞,设空白组和对照组,对照组每管加Podoplanin流式抗体10μL,空白组不加抗体。4℃孵育30min,每管加含4%FBS的PBS 1 mL,1500 r/min离心5min, 洗3次,洗脱多余抗体。加 200μL含4%FBS的PBS重悬,上机检测。
1.5 细胞的不同血清培养基培养及鉴定
原代LECs传至第1代时将细胞分为5组,分别加入血清浓度为0、2.5%、5%、7.5%、10%的EGM-2培养基。传至第3代时进行鉴定。
镜下观察各组细胞形态。5组LECs按照每孔3×103个的浓度接种于96孔板,24h后加入CCK-8,4h后采用酶标仪所测OD值(450 nm),之后每24小时测1次,连续9 d,绘制细胞增殖曲线。
成管能力检测:将metrigel按照说明书铺于6孔板,置于培养箱待其凝固,将细胞悬液浓度调整至2×104cells/mL,按照每孔1 mL分别将5组细胞接种于胶上,放入培养箱12 h后,镜下观察成管情况并计数。
吞脂能力检测:5组细胞每孔加入Dil-Ac-LDL 5μL,24h后荧光显微镜下观察各组细胞吞脂情况。
资金管理是企业财务管理的核心内容,而财务管理又是企业管理的关键。由于电力企业生产的特殊性,决定其经营目标不应仅停留在自身利润的最大化,同时要承担一定的社会责任,保障国民经济和居民生活对电力能源的需求。就目前发展状况而言,相较于国民经济的发展速度和居民生活对电力需求的增长速度,我国电力企业的发展速度略显滞后,客观上就要求电力企业扩大投资建设力度,加大电力能源供给。而电力企业生产建设一般具有资金投入规模大、固定资产比例高、财务风险大等特点,因此,加强电力企业资金管理,是推进电力企业良性运作、健康发展的需要。
1.6 统计学处理
实验数据至少重复3次,数据以均数±标准差表示,采用SPSS 16.0统计软件分析,组间比较采用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 分离培养LECs的鉴定
免疫磁珠分选法获取的内皮细胞,细胞免疫荧光检测显示细胞呈现LECs特异性标志物Podoplanin阳性(图1);RT-PCR检测显示,细胞特异 性 表 达 Podoplanin、Lyve-1、VEGFR-3、PROX-1(图 2);流式分析显示 Podoplanin阳性率可达(80.25±0.53)%(图 3)。
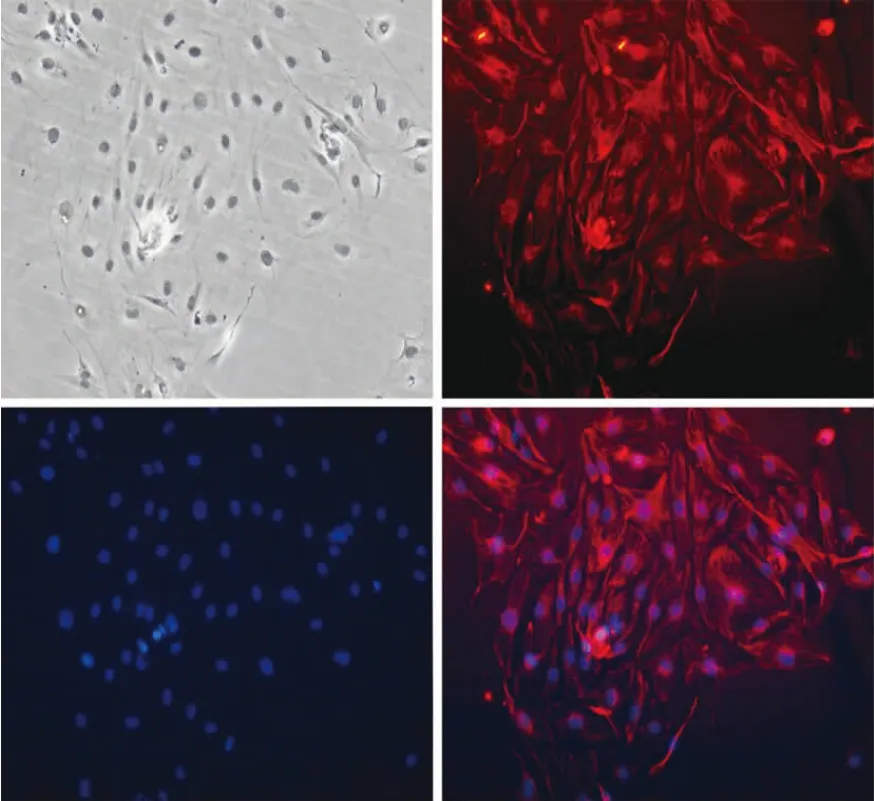
图1 细胞免疫荧光检测结果(100×)Fig.1 Results of immuno-fluoresence staining(100×)
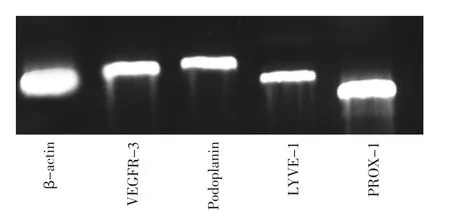
图2 RT-PCR 检测 VEGFR-3、Podoplanin、LYVE-1 和PROX-1的表达Fig.2 Detection of specific expression of VEGFR-3,Podoplanin,LYVE-1 and PROX-1 in LECs by RT-PCR
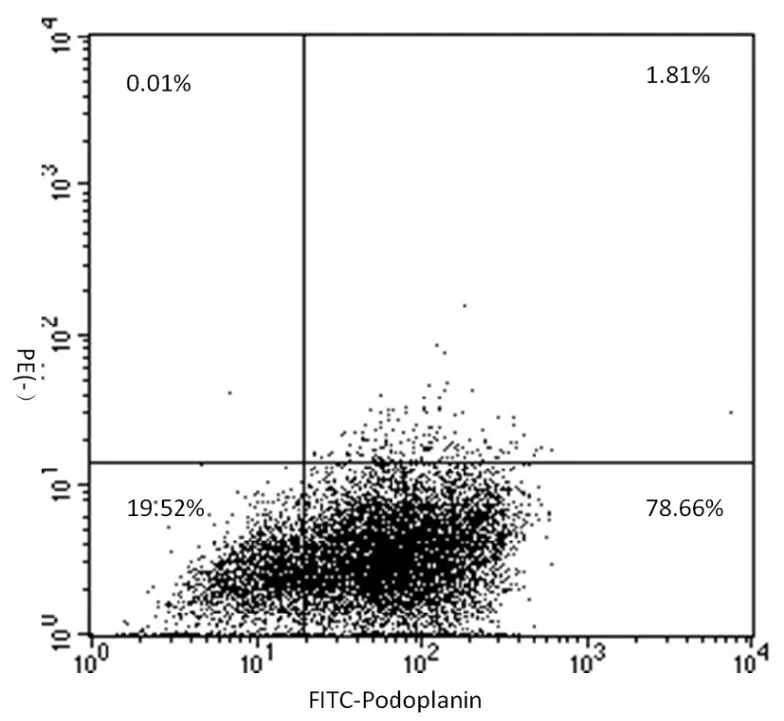
图3 细胞的流式细胞仪鉴定Fig.3 Identification of Podoplanin positive cells by flow cytometry
2.2 不同血清浓度培养基培养的内皮细胞检测
2.2.1 细胞生长形态组织学观察
细胞呈鹅卵石样形态,无血清组贴壁细胞数量较少,其他4组细胞都呈铺路石样排列(图4)。
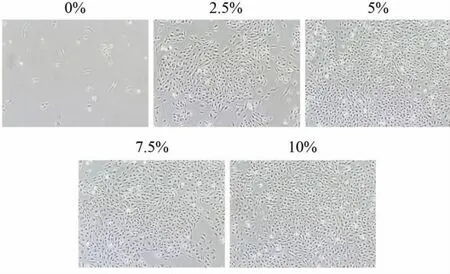
图4 不同浓度血清培养的LECs(40×)Fig.4 Morphology of LECs cultured in different serum concentration(40×)
2.2.2 细胞增殖情况
无血清组增殖最为缓慢,2.5%组次之,其余各组均在第3~6天进入对数增长期,第6~8天进入停滞期。其中7.5%血清组增殖最快数量最多(图5)。
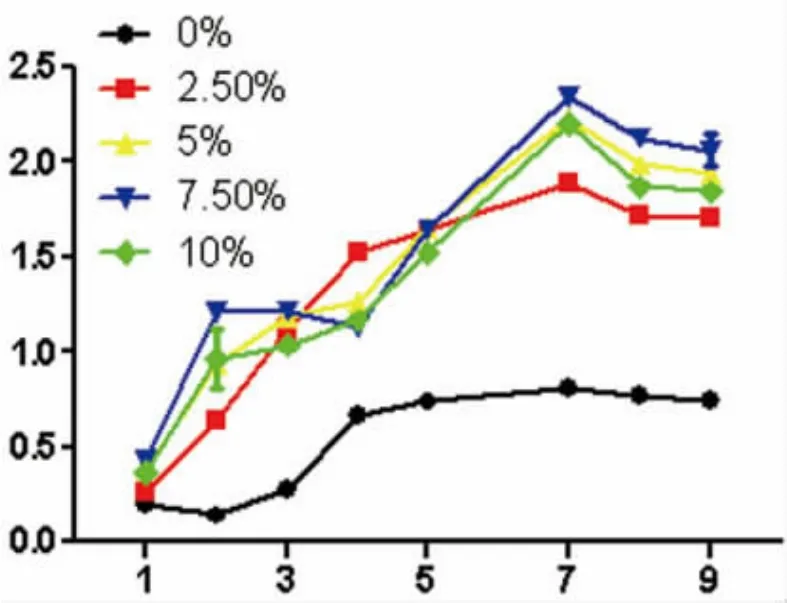
图5 各组LECs的增殖曲线Fig.5 Growth curves of LECs in different goups
成管试验可见无血清组丧失成管功能,其余各组均保存了成管能力,但是成管数量差距比较大,各组成管数分别为:0%组0个、2.5%组3.33±0.58个、5%组 16.00±1.00个、7.5%组 23.33±0.58个、10%组19.33±0.58个,其中7.5%血清浓度组成管能力最好(P<0.05)(图 6)。
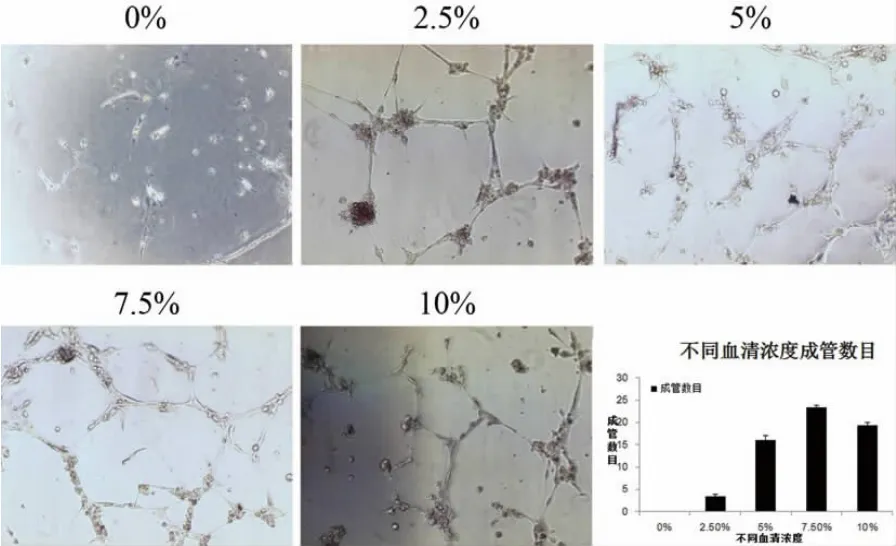
图6 各组细胞成管情况(100×)及成管数Fig.6 Transmission electron microscope analysis for the tube-like structure in matrigel assay(100×)and the bar chart of the tube-like structure number in each group
2.2.4 吞脂试验
各组细胞均保持了吞脂能力。表明不同血清浓度对吞脂能力影响不大。
3 讨论
淋巴水肿的机制主要是淋巴管再生障碍导致的淋巴回流障碍,从而造成淋巴液滞留。LECs是淋巴管系统最基本的组成单位,在研究淋巴管发育和新生的机制,以及淋巴循环障碍疾病,甚至肿瘤的淋巴道转移等病理现象时,LECs尤其是微小淋巴管内皮细胞的研究显得极为重要[9]。相关研究已有大量报道[9-12],但是LECs的培养仍然存在很多问题,如不易成活和传代困难等[10]。近年来,LECs的分离技术逐渐成熟,但培养方式仍无显著进展,难以获得足量的有良好活力的LECs。
在细胞培养过程中,培养基的选择具有重要作用,常用的培养基有 DMEM[13]、RPMI-1640[14]、EGM-2[11]等。其中,EGM-2含有 EGF、VEGF等促进内皮细胞生长的因子,为完全内皮培养基,在内皮细胞培养中最为常用。本实验采用EGM-2培养基。
原代LECs培养一般添加20%的胎牛血清,而传代培养则用10%的胎牛血清[12]。本实验显示,不同血清浓度培养的淋巴管内皮细胞主要差别在于增殖能力和成管能力,一定浓度的血清有助于LECs的贴壁、增殖和成管。含7.5%胎牛血清的EGM-2培养时,其增殖曲线最优。虽然各组均在第3~6天进入对数增长期,第6~8天进入停滞期,但是7.5%血清组的曲线幅度和峰值都明显高于其他组;7.5%血清组成管能力最强,成管数量大于其他组(P<0.05),提示一定浓度的血清对于淋巴管内皮细胞的旁分泌促发成管机制有一定的促进作用,7.5%的血清对成管机制的促进作用最明显。但其具体的调控机制有待进一步探究。可能的机制是内皮细胞旁分泌促发成管,血清浓度影响一些促发成管因子分泌的变化,不适宜的血清浓度引起促成管因子的减少或抑制成管因子的增加,从而影响成管能力。
本实验研究了不同血清浓度在淋巴管内皮细胞培养中的作用,结果提示7.5%的血清浓度可使在培养过程中保持较好的增殖能力以及特有功能,从而能够获得数量多、功能好的LECs。本实验对传统的LECs的培养进行了改进,完善了LECs培养体系。
[1]Reis-Filho JS,Schmitt FC.Lymphangiogenesis in tumors:what do we know[J]?Microsc Res Tech,2003,60(2):171-180.
[2]Tammela T,Petrova TV,Alitalo K.Molecular lymphangiogenesis:new players[J].Trends Cell Biol,2005,15(8):434-441.
[3]Hu X,Jiang Z,Liu N.A novel approach for harvesting lymphatic endothelial cells from human foreskin dermis[J].Lympha Res Biol,2006,4(4):15-22.
[4]Banerji S,Ni J,Wang SX,et al.LYVE-1,a new homologue of the CD44 glycoprotein,is a lymph-specific receptor for hyaluronan[J].J Cell Biol,1999,144(4):789-801.
[5]Partanen TA,Paavonen K.Lymphatic versus blood vascular endothelial growth factors and receptors in humans[J].Microsc Res Tech,2001,55(2):108-121.
[6]Lymboussaki A,Partanen TA,Olofsson B,et al.Expression of the vascular endothelial growth factor C receptor VEGFR-3 in lymphatic endothelium of the skin and in vascular tumors[J].Am J Pathol,1998,153(2):395-403.
[7]Wilting J,Papoutsi M,Christ B,et al.The transcription factor Prox-l is a marker for lymphatic endothelial cells in normal and diseased human tissues[J].FASEB J,2002,16(10):1271-1273.
[8]戴婷婷,蒋朝华,周广东,等.淋巴管内皮细胞与PGA的相容性研究[J],组织工程与重建外科,2010,6(2):75-77.
[9]蒋朝华,胡学庆,刘宁飞.人真皮淋巴管内皮细胞的分离及冷冻保存[J].上海交通大学学报:医学版,2007,27(9):1092-1095.
[10]蒋朝华,胡学庆,刘宁飞.人真皮来源淋巴管内皮细胞的流式细胞仪分选和生物学特点[J].组织工程与重建外科,2009,5(5):267-271.
[11]Lee JY,Park C,Cho YP,et al.Podoplanin-expressing cells derived from bone marrow play a crucial role in postnatal lymphatic neovascularization[J].Circulation,2010,122(14):1413-1425.
[12]田东,付茂勇.体外分离培养淋巴管内皮细胞的研究进展[J].解剖学研究,2010,32(2):138-141.
[13]Zeng Y,Opeskin K,Goad J,et al.Tumor-induced activation of lymphatic endothelial cells via vascular endothelial growth factor receptor-2 is critical for prostate cancer lymphatic metastasis[J].Cancer Res,2006,66(19):9566-9575.
[14]Zhuang Z,Jian P,Longjiang L,et al.Identification of oral cancer cell-induced changes in gene expression profile of lymphatic endothelial cell[J].Cancer Invest,2008,26(10):1002-1007.
