鲤鱼主要组织中金属硫蛋白提取工艺的研究
2013-12-08许晓曦吕萍萍邵欣欣关朝亮
李 华,许晓曦,* ,吕萍萍,邵欣欣,关朝亮
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.绥芬河出入境检验检疫局,黑龙江绥芬河157300)
金属硫蛋白(Metallothionein,简称MT)是一类广泛存在于生物体中的低分子量、富含半胱氨酸的、能被金属诱导产生的金属结合蛋白。广泛存在于生物界,它涉及许多生理和病理学过程,具有重要的生物学功能[1-2]。自从1957年Margashes和Vallee首次发现MT以来,MT成为基础和应用科学研究的热点之一,其研究和开发涉及农业、医药保健、生物工程、环境保护等各个领域[3]。对于金属硫蛋白(MT)的研究,国内外主要集中在实验室提取、纯化和检测以及应用上。在实际生产中,目前主要靠用金属镉或锌等金属诱导动物肝脏合成,然后经提取、分离纯化来制备Cd-MT[4-5]。由于受到诱导和提取方法的限制,分离纯化后的金属硫蛋白中还含有其它的杂蛋白,产率低,且无法实现大批量生产及工业化,大大影响了MT的开发应用。我国是渔业大国,有丰富的鱼类资源,因而开发利用鱼体内的金属硫蛋白具有广阔的前景,目前国内外对于鱼类资源批量诱导提取MT进行工业化生产有关研究相对较少。诱导和提取工艺不够理想是制备Cd-MT产率低的主要原因,目前对Cd-MT的诱导,主要采取动物注射的方法,由于注射的剂量和时间的差异,动物体内的金属硫蛋白合成不稳定,造成资源浪费。本实验综合传统动物金属硫蛋白提取方法。以金属离子溶液养殖模式诱导鲤鱼体内金属硫蛋白的合成,解决了实验室少量金属硫蛋白的提取的局限性,有助于工业化大规模提取鲤鱼体内的金属硫蛋白。
1 材料与方法
1.1 材料与仪器
鲤鱼(Cyprinus carpioi) 当地市场购买,平均体长(12.4±0.4)cm,平均体重(42.1±0.5)g,鲤鱼在经曝气3d的自来水中暂养14d,然后选取体表无伤,身体健康的个体供实验所用。研究器官肝、肾、腮、心脏和脑;自来水中未检出Cd金属离子,溶氧(DO)大于7mg/L,pH6.8~7.4,实验期间水温为 20~25℃,同时保持自然光照;HNO3(浓)、HClO4、三羟甲基氨基甲烷 (简 称 Tris)、HCl、CdCl2、CHCl3、无 水 乙 醇(95%)等试剂 均为分析纯、硝酸+高氯酸混合酸(4∶1),牛血清白蛋白,HRP-羊抗兔 IgG,兔抗鱼 MT多克隆抗体,Ellman’试剂DTNB(Sigma),镉标准溶液(1.0mg/mL),镉标准使用液(100.0ng/mL),牛血红蛋白等。
PE-800型原子吸收分光光度计 美国珀金埃尔默公司;PHS-3C型pH计 上海精密科学仪器有限公司;TGL18M台式高速冷冻离心机 盐城市凯特实验仪器有限公司;可调试恒温电热板、可调试电炉
上海特成机械设备有限公司;101C-1B型电热鼓风干燥箱 金华雷琪实验器材有限公司;电子分析天平 北京赛多利斯仪器系统有限公司;酶标板(NUNC,F16)、酶标仪 杭州生友生物技术有限公司;匀浆机 南京莱步科技实业有限公司;磁力搅拌器 郑州南北仪器设备有限公司;电热恒温水浴锅
北京东方精瑞公司。
1.2 实验方法
1.2.1 Cd-MT的诱导 根据蛋白质的提取理论和传统生物体金属硫蛋白的诱导方法[6-10]首先进行鲤鱼MT诱导的预实验,从时效性、提取量、提取条件等方面综合考虑,确定了以传统经典方法为主线的鲤鱼MT的提取工艺。预实验结果表明Cd2+(10mg/L),诱导时间为两周时,鲤鱼体内镉-金属硫蛋白能稳定达到最大。故确定诱导方法为:选取鲤鱼,放入含Cd2+(10mg/L)金属离子浓度进行批量诱导,诱导时间为2周,期间不喂食,然后取出解剖取实验器官(肝、肾、腮、心脏和脑),-20℃冷冻。
1.2.2 Cd-MT的提取与分离 在提取工艺中,MT的提取大致可分为匀浆与除杂两步,近几十年来,一直采用匀浆离心法提取动物MT,Tris-HCl缓冲溶液性质稳定,与生理体液的相容性好[8],因此Tris-HCl缓冲液常作为提取剂。有些研究中Tris-HCl缓冲液含有0.15mol/L NaCl以促进蛋白溶解,及蛋白酶抑制剂苯甲基磺酰氟(PMSF,0.1、0.2mmol/L)、还原剂二硫苏糖醇(DTT,1mmol/L)或B2巯基乙醇(10mmol/L),以保护MT的巯基(-SH)不被降解或氧化,被提取的组织与所加缓冲液的质量体积比(g/mL)一般为1/2~1/5[8,11]。但是不同研究者所使用的缓冲液的浓度、pH以及动物组织与缓冲液的质量体积比各不相同,匀浆液的离心转速、时间以及离心后上清液的加热处理条件也存在较大差异[12-15]。所以提取的MT含量和纯度等都不一样,这种状况十分不利于MT对水域重金属污染的指示作用。
1.2.2.1 匀浆过程中对MT提取的影响 匀浆过程中影响MT提取率的因素包括:Tris-HCl缓冲液浓度、pH、所用组织与缓冲液的质量体积比(m/v),而内脏组织与缓冲液的质量体积比(m/v)对MT提取率的影响最小[11],在实验中不做考虑。因此,分别称取约0.2g内脏组织加入一定体积4℃预冷的Tirs-HCl缓冲液进行匀浆,对缓冲液浓度、pH设计单因素实验优化匀浆条件。所得到的匀浆液均采用相同的除杂步骤进行处理。即:变性除杂蛋白,10000r/min于4℃离心30min,弃沉淀,取上清液,85℃水浴热变性5min,冰水冷却,用8层纱布过滤,取清液,静置约2h、8000r/min于4℃离心10min,弃沉淀,取上清液,得到所要的匀浆液,记下体积V,精确到1mL,每组设5个平行。按照1.2.5节的方法测定疏基含量。
1.2.2.2 除杂过程中对MT提取的影响 除杂过程中,水浴加热的目的是利用MT的热稳定性去除匀浆液中的热不稳定大分子蛋白,而离心仅为获得上清液的1种手段。该过程虽然不会影响MT提取率,但是水浴加热时间、离心时间等因素决定着提取液中对MT测定有干扰的杂质(大分子蛋白质、热敏蛋白以及含-SH的小分子物质)去除程度[11]。因此,依次采用单因素影响实验对这些因素进行优化,按照1.2.2.1的条件制备内脏匀浆液,在依次控制1次离心时间10~70min、水浴加热时间5~30min、2次离心时间为10~70min的情况下,对匀浆液进行处理,所得到的上清液按照1.2.5的方法测定琉基含量,每组设5个平行。
1.2.3 酶联免疫吸附法测定鲤鱼MT含量 取鲤鱼的肝脏和肾脏为例,以上述方法制备匀浆后,取上清液以酶联免疫吸附法(ELISA)[16]测定MT含量。以包被液按1∶100稀释后,加100μL于酶标板的凹孔中,加盖4℃过夜,以p H7.4 Tris-HCl(内含质量分数0.05%的Tween-20)缓冲液洗涤3次;加入封闭液(1.5%质量分数的牛血清白蛋白)200μL,37℃,1h后洗涤 3次;加入 100μL兔抗鱼 MT多克隆抗体(1∶1000 倍)37℃,2h,以缓冲液洗涤3 次,将 HRP-羊抗兔IgG抗体(1∶1000稀释)100μL加入孔内,37℃,1.5h,以缓冲液洗涤3次,蒸馏水洗涤3次,孔内加入100μL TMB应用液,室温放置 15min后,再加入50μL 2mol/L H2SO4,5min 后测 A450,并与血红蛋白/镉饱和法比较其结果。
1.2.4 镉含量测定 按文献方法[17],精密吸取鱼标准样品溶液,用去离子水定量稀释(使Cd浓度在标准曲线浓度范围内),摇匀。原子吸收分光光度计上测得吸光度,按肝脏重计算镉的提取量(mg Cd/g湿肝)。对鱼肝用湿法消化后,稀释,测定肝中镉含量。

表1 鲤鱼不同组织中MT含量(mg/g,n=5)Table 1 The content of MT in carps for different tissues(mg/g,n=5)

表2 ELISA法和镉-血红蛋白饱和法测定MT含量(mg/g,n=5)Table 2 Determination of concentration MT with ELISA and Cadmium/hemoglobin saturation method(mg/g,n=5)
1.2.5 巯基含量的测定 Ellman’试剂检测[18],MT具有疏基(-SH)含量高的特点。称取一定量鲤鱼MT样品(疏基含量0.1~0.5μmol),配成小于 50μL 溶液。加入 10μL 1.2mol/L HCl和 200μL 0.1mol/L EDTA反应10min脱去金属。加入200μL Ellman’s试剂(含 5mmol/L DTNB,1mmol/L EDTA,6mol/L 盐酸胍,0.1mol/L PBS,pH7.3),混匀3min使MT 变性后与DTNB形成黄色络合物,用0.1mol/L PBS,p H7.3稀释至4mL在412nm处测紫外吸光度A,同时以50μL提取剂代替样品提取液,按同样步骤进行空白实验得到吸光度A0。以ΔA(A-A0)表征组织中的MT水平。
1.2.6 鲤鱼MT氨基酸组成分析 将0.1mg样品溶于0.5mL蒸馏水中,加0.4mL,5.7mol/L恒沸HCl,抽真空封口,于110℃下分别水解24、48和72h,再经处理上氨基酸分析仪分析。
1.2.7 计算 收率计算:因 1mol MT(分子量9799[19])可结合 7mol Cd2+(原子量 112.4),故鲤鱼每克组织中的 MT 含量(μg·g-1)为[20]
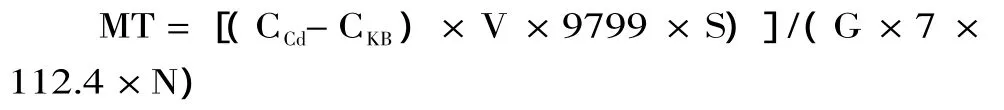
式中:CCd为上清液中 Cd2+的质量浓度,μg·mL-1;CKB为空白样品最终上清液读数;S为测定时所取上清液的体积,mL;G为取样组织的质量,g;V为组织匀浆体积,mL;N为匀浆后的取样体积,mL。
疏基浓度计算:C=DA/ε,式中 ε=1.23×104(mol/L)-1·cm-1,A 为吸光值,D 为稀释倍数[18]。
数据处理采用Excel7.0版及SPSS数据分析软件进行统计分析。实验数据用平均数±标准差表示,同时采用t-test进行差异性和显著性检验。
2 结果与讨论
2.1 鲤鱼主要组织中MT分布与含量
鲤鱼的肝脏、肾脏、腮、心脏和脑内MT含量分布如表1,其结果表明鲤鱼体内能诱导合成大量的MT,并且MT含量在各组织中差异很大,尤其在肝脏和肾脏内含量明显突出(p<0.05)。因此,与其他组织器官相比,肝脏和肾脏是吸收重金属镉最强的组织器官,这与大多研究的结果是一致的。反映了在镉诱导下,MT合成在肝脏和肾脏旺盛,是络合和积累镉的主要器官。因此,对鲤鱼体内MT的诱导合成主要以肝肾脏合成量为标准。
2.2 酶联免疫吸附法与血红蛋白/镉饱和法测定鲤鱼组织MT含量比较
表2列出ELISA法和血红蛋白/镉饱和法测定鲤鱼组织中MT含量的结果,ELISA法测定鱼体MT比血红蛋白/镉饱和法的结果偏低,原因可能是由于两种方法使用不同的标样(ELISA法以MT纯品为标样,血红蛋白/镉饱和法以标准镉为标样,用血红蛋白去除镉时有残留的镉),结果引起偏差。
2.3 Cd-MT的提取影响因素分析
2.3.1 缓冲液浓度、pH对MT提取效果的影响 匀浆过程中缓冲溶液的1个作用是作为溶剂促进被提取成分的溶出。由图1实验结果表明:在其他条件相同的情况下,缓冲液浓度≥0.03mol/L的Tirs-HCl缓冲溶液所得到的吸光度远小于两个较低浓度的提取效果。这是因为,随着Tris-HCl浓度的增高,溶液的离子强度增大,而较高的离子强度可造成蛋白沉淀[6],并在随后的离心过程中从上清液中去除,从而导致吸光度的降低。因此,为获得较高MT提取率,Tris-HCl缓冲溶液的浓度选用0.01mol/L或0.02mol/L为宜。

图1 Tirs-HCl缓冲液浓度对提取液中MT含量的影响Fig.1 Effect of Tirs-HCl buffer concentration on MT content in the extract
缓冲液的另一个作用是为离体蛋白提供相对稳定的pH环境,防止变性,蛋白质在胞内一般处于中性环境,因此采用p H6~8的缓冲溶液可有效防止离体蛋白质变性[21]。据报道,水生生物MT的等电点在p H3.5~6.0之间[2],如果缓冲液的 p H 与目标蛋白的等电点(p I)一致,则蛋白质因溶解度减少会发生聚集[6]。因此,本研究选用远离pI且能保持蛋白质活性的缓冲溶液pH范围(7.4~9.0)进行优化。从图2可知,当缓冲液p H为8.6时,鲤鱼MT的测定值最大,说明这种p H最有利于MT的稳定,既能避免等电点附近出现的蛋白沉淀,又可避免较高pH条件下的蛋白变性,由此确定Tris-HCl溶液最佳的pH为8.6。

图2 Tris-HCl溶液pH对提取液中MT含量的影响Fig.2 Effect of Tirs-HCl buffer pH on MT content in the extract
综上,鲤鱼组织的最佳匀浆条件为:Tris-HCl缓冲溶液浓度为0.01mol/L,p H8.6,内脏组织与缓冲液的质量体积比为 1/2[4]。
2.3.2 水浴、离心时间对MT提取效果的影响
2.3.2.2 一次离心的时间对MT提取效果的影响由图3可见,控制离心时间为10~20min时,吸光度测定值较高,表明能够产生干扰的含-SH杂质不能完全被去除;当离心时间为30min时,吸光度显著降低(p<0.05),说明延长离心时间有利于杂质的沉降去除;继续延长时间,吸光度趋于平缓,没有显著变化(p>0.05)。因此,离心时间以30min为宜。

图3 一次离心时间对提取液中MT含量的影响Fig.3 Effect of centrifugal time during the first centrifugation on MT content in the extract
2.3.2.3 水浴加热时间对MT提取效果的影响 MT分子的构象较为坚固,具有较强的耐热性,可以80℃水中保存30min[22]不变性,而大多数种类的蛋白质在温度高40~50℃时即开始变性[23]。利用这一特性可去除热不稳定大分子蛋白,进一步消除提取液中的干扰成分。考虑到温度低于80℃时,非MT蛋白的变性不够充分,而温度太高时,MT中的-SH容易失活[24],本研究选择85℃水浴对上述离心后的上清液进行处理。由图4可见,水浴加热5~15min时,吸光度保持在较高的稳定水平,表明鲤鱼MT在此时间内不会失活;当加热超过15min时,随着时间延长,吸光度显著降低(p<0.05),表明部分MT已发生热变性。从保证加热期间MT分子的稳定性及有效分离其他蛋白质两方面考虑,选取最适水浴加热时间为5min。

图4 水浴加热时间对提取液中MT含量的影响Fig.4 Effect of water-curing treatment time on MT content in the extract
2.3.2.4 二次离心时间对MT提取效果的影响 二次离心的目的是实现热变性絮凝杂蛋白与提取剂的分离。一般在10000r/min时离心10min就能将细胞碎片、线粒体等物质沉降[25]。为提高分离速度,在保持离心为8000r/min的情况下,对离心时间进行优化。由图5可见,二次离心的时间对吸光度的测定值影响不大,在10~60min内基本稳定。为节省提取时间,二次离心的时间以10min为宜。

图5 二次离心时间对提取液中MT含量的影响Fig.5 Effect of centrifugal time during the second centrifugation on MT content in the extract
因此,为获得较高的MT提取率,鲤鱼组织的最佳匀浆条件为:Tris-HCl缓冲溶液浓度为0.01mol/L,p H8.6,内脏组织与缓冲液的质量体积比为1/2,第一次离心10000r/min,30min,取上清液,置85℃水浴热变性5min,进行第二次离心8000r/min,10min。在此条件下鲤鱼组织MT的提取率能达到最大,这些结果有助于重金属生物监测中鲤鱼MT的经济高效提取和共存杂蛋白干扰的有效去除。
2.3 Cd-MT的提取结果
原子吸收分光光度计上测定其镉浓度,按Cd-MT的分子质量为6500u和每分子Cd-MT含7个镉原子计算,得到Cd-MT的含量约为4.53mg/g湿肝,再以测得的巯基含量,按412nm外测紫外吸收值,得到Cd-MT的含量约为4.48mg/g湿肝。
2.4 鲤鱼氨基酸组成分析
不同生物中诱导的MT性质有所不同。表3~表4为鲤鱼 MT 氨基酸组成与鲫鱼[19]、海蝶[26]和小沙鱼[27]的氨基酸组成的对比。其氨基酸成分分析结果表明:该蛋白中半胱胺酸为29.7%,约占1/3,与鲫鱼、海蝶和小沙鱼组成相似,然后依次是赖氨酸、丝氨酸等,未发现有芳香族氨基酸。用Ellman′试剂测定疏基的结果与此相同,这和李令媛等[28]研究大鲵MT含Cys约23%~24%结果相似,且都小于哺乳动物MT的Cys含量。张建业等[29]以锌诱导兔肝MT发现半胱氨酸含量有32%~33.8%,MT-I和MT-II分别结合7个和6个Zn,无Cd和Cu;人胎肝的MT含量较高(1.0~1.3),且可能随胎龄增长发生某种变化。而郭详学等[30]从蓝藻中诱导纯化的类金属硫蛋白与哺乳动物金属硫蛋白结构差异很大,这可能只是一种进化上的趋同。

表3 鲤鱼MT的氨基酸组成(%)Table 3 Amino acid composition of carp MT(%)

表4 鲤鱼与其他鱼种氨基酸组成对比(%)Table 4 Amino acid composition of carp and other fish species contrast(%)
3 结论
3.1 本文利用鲤鱼作为材料,研究体内各组织MT的含量及批量诱导提取工艺,用于MT生产企业。由实验结果看出:鲤鱼肝、脏、腮、心脏和脑中的MT含量较高,肝脏的含量也反映出肝脏是吸收和积累重金属的主要器官,也是重金属污染的最适指示器官,通过与其他鱼类MT的氨基酸对比结果看出:鲤鱼MT中也不含芳香族氨基酸,氨基酸残基组成相似,含有大量的半胱氨酸。
3.2 采用血红蛋白/镉饱和法测定鱼体MT,此方法操作简便、快速,但此方法有一定的局限性,即:特异性较差因为重金属结合MT的能力次序为Bi(Ⅲ)、Hg(Ⅱ)、Ag(Ⅰ)、Cu(Ⅱ)>Cd(Ⅱ)>Pb(Ⅱ)>Zn(Ⅱ),即不能用于 Bi、Hg、Cu-MT 样品的测定,而且还与其它一些小分子量化合物结合,而ELISA法则适用于广泛的样品测定[9]。ELISA法可以特异地检测出动物组织匀浆液中微量的MT,是当前检测MT最灵敏的方法之一,由于这两种方法具有不同的特点及实验上的局限性,工作中应根据具体情况而选择不同的方法,也可以两种方法并用,综合作出评价。
3.3 采用单因素设计优化鲤鱼主要组织中MT的提取过程。在匀浆阶段,最佳工艺条件为:Tris-HCl缓冲液的浓度0.01mol/L,pH8.6,内脏组织与缓冲液的质量体积比为1/2,在此条件下MT在缓冲液中的溶出量达到最大。除杂阶段的最佳工艺条件为:匀浆液在10000r/min、4℃、离心30min,弃沉淀,取上清液,置85℃水浴热变性5min,再次除杂蛋白,用冰水冷却,用8层纱布过滤,取清液,静置约2h、8000r/min于4℃离心10min,弃沉淀,取上清液,得到所要的匀浆液,记下体积V,精确到1mL。该优化结果去除了影响MT测定的杂蛋白,为鲤鱼MT应用于企业工业化生产提供了可靠、高效的提取方法。而且该提取方法操作简单,过程易于控制,将对科学研究和生产企业的生产与深加工具有重要意义。
[1]茹炳根,潘爱华,黄秉乾,等 .金属硫蛋白[J].生物化学与生物物理进展,1991,18(4):254-257.
[2]刘安玲,朱必凤,金属硫蛋白的研究进展[J].韶关学院学报:自然科学版,2001,22(3):86-91.
[3]VALLEE B L.Introduction to metallothionein[J].Methods in Enzymology,1991,20(5):3-7.
[4]潘爱华,茹炳根,李令媛,等.锌诱导家兔肝脏金属硫蛋白的纯化及鉴定[J].生物化学与生物物理学报,1992,24(6):509-5011.
[5]Comeau R D,McDonald K W,Tolman G L,et al.Gram scalc purification and preparation of rabbit liver zinc metallothionein[J].Prep Biochem,1992,22(1):151-155.
[6]李世崇,陈昭烈.不稳定蛋白质的分离纯化[J].药物生物技术,2002,9(3):175-177.
[7]徐丽霞,彭新君.金属硫蛋白(MT)的诱导、分离纯化与特性研究进展[J].湖南中医药导报,2002,8(4):152-154.
[8]孟范平,肖静.海洋动物金属硫蛋白的提取与分析技术研究进展[J].中国海洋大学学报,2010,40(6):41-46.
[9]王达,葛刚.金属硫蛋白(MT)的分离纯化与检测技术[J].江西科学.2004,20(3):22-23.
[10]王莹,张彬.金属硫蛋白提取工艺的研究进展[J].养殖与饲料,2007,7(4):63-65.
[11]孟范平,肖静.菲律宾蛤仔金属硫蛋白的提取方法优化[J].中国海洋大学学报,2010,40(7):121-125.
[12]Wu SM,Lin H C,Yang W L.The effects of maternal Cd on the metallothionein expression in tilapia (Oreochromis mossambicus)embryos and larvae[J].Aquatic Toxicology,2008,87(4):296-302.
[13]Santiago-Rivas S,Moreda-Pieiro A,Bermrjo-Barrera A,et al.Fraction metallothionein-like proteins in mussels with on line metal detection by high performance liquid chromatography inductively coupled plasma-optical emission spectrometry[J].Talanta,2007,71(4):1380-1586.
[14]Nunez-Nogueira G,Mouneyrac C,Amiard J C,et al.Subcellular distribution of zinc and cadmium in the hepatopancreas and gills of the decapod crustacean Penaeus indicus[J].Marine Biology,2006,150(2):197-211.
[15]Fernandes D,Zanuy S,Bebianno M J,et al.Chemical and biochemical tools to assess pollution exposure in cultured fish[J].Environmental Pollution,2008,152(1):138-146.
[16]Robert J.Cousins,measurement of humen metallothionein by enzyme linked immunosorbent assay[J].Methods in Enzymology,2005(PartB):131-140.
[17]黄波,金泰.金属硫型的检测方法的适用性和局限性[J].劳动医学,1999,16(2):114-115.
[18]Kagi J H,Kojima Y.Chemistry and biochemistry of metallothionein[J].Experientia Supplementum,1987,52:25-61.
[19]REN Hongwei,WANG Wenqing,RU Binggen,et al.Purification and identification of metallothionein from Carassius auratusliver induced by cadmium chloride[J].Progress in Biochemistry and Biophysics,1993,20(4):281-285.
[20]DAI Jianguo,CHEN Jingheng,YANG Sen.Cadmiumsaturation method for determination of mousehepatic metallothionein[J].Acta Universitatis Medicinalis Nanjing,1995,15(3):722-724.
[21]冯小黎,金业涛,苏志国.分离纯化中蛋白质的不稳定性及其对策[J].生物工程进展,2002,20(3):67-71.
[22]田晓丽.硒对金属硫蛋白的诱导表达及对肝纤维化的防护作用研究[D].北京:中国人民解放军军事医学科学院,2006:115-116.
[23]沈同,王镜岩,赵邦梯,等.生物化学[M].北京:高等教育出版杜,1990:216.
[24]吴萍,彭新君,何斌,等.家兔肝脏中锌金属硫蛋白提取工艺的研究[J].湖南中医学院学报,2004,24(3):45-51.
[25]谭天伟.生物分离技术[M].北京:化学工业出版社,2007:35-36.
[26]Overnell J,Coombs T L.Purification and properties of plaice metallothionein.a cadmium binding protein from liver of plaice[J].Biochem,1979,183:277.
[27]Joan H,Rosa F.Dogfish metallothionein I purification and characterization and comparison with rat metallothionein[J].Comp Biochem Physiol,1986,83(1):99-102.
[28]李令媛,马宏宝,安钰,等.镉诱导大鲵肝脏与肠金属硫蛋白的分离纯化与鉴定[J].北京大学学报:自然科学版,1996,32(4):534-541.
[29]张建业,胡国良,毕云祥,等.人胎肝金属硫蛋白的分离纯化及其性质的研究[J].山东医科大学学报,1992,30(1):11-14.
[30]郭祥学,陈正佳,但春涛,等.聚球藻类金属硫蛋白的纯化及部分性能的研究[J].生物化学杂志,1997,13(6):699-703.
