荧光定量PCR检测感染登革2型病毒C6/36细胞和埃及伊蚊复制动态研究*
2013-11-26朱小娟郭晓霞李春晓汪中明董言德苏建新张恒端吴治明赵彤言
朱小娟 郭晓霞 李春晓 汪中明 邢 丹 董言德 阎 婷 苏建新 王 刚 张恒端 吴治明 赵彤言**
(1.安徽医科大学,合肥 230032;2. 军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
登革病毒(Dengue virus,DENV)属黄病毒科黄病毒属单股正链RNA病毒,有4个不同的血清型(DEN-1,2,3,4),均可引起登革热(Dengue fever, DF)、登革出血热(Dengue hemorrhagic fever, DHF)和登革休克综合征(Dengue shock syndrome, DSS),广泛流行于热带和亚热带地区。通常登革2型病毒(DEN-2)的感染较其他血清型更为严重(Gubleretal., 1997; 秦鄂德等,2008)。近年来随着人口流动加大,现代交通旅游及国际交往增多,登革热和登革出血热的流行和暴发更为频繁,全球每年有数千万人被感染致病,登革热已成为一个世界性的传染病。目前尚未有预防登革热的疫苗和特效治疗药物。
登革病毒主要通过埃及伊蚊Aedesegypti和白纹伊蚊Ae.albopictus传播,蚊虫叮咬带病原宿主后,病毒进入蚊体内进一步增殖,并通过叮咬健康宿主完成自然界的传播循环。不同致病力的毒株在媒介宿主内的增殖与传播能力密切相关,准确了解病毒在其宿主细胞与蚊虫体内真实的增殖过程可以更好的探究病毒与媒介宿主的相互作用机制。实时荧光定量PCR 技术可以动态监测病原体在机体内的分布,以及增殖过程中病原体含量的变化,是研究病原在机体内的动态分布和增殖规律与疾病发展关系非常有效的方法(Ginzingeretal., 2002,Rosinskietal., 2002)。
本研究为了解登革病毒在媒介宿主细胞及蚊虫体内复制的动态状况,精确地检测宿主细胞、蚊虫体内的病毒载量,进而对病毒载量进行动态监测。研究旨在使用实时荧光定量PCR技术,对病毒感染媒介宿主细胞及自然途径感染埃及伊蚊体内病毒粒子复制的拷贝数进行全程定量检测。了解病毒感染动力学过程,为进一步研究登革病毒的病原特性、致病性提供实验资料;也可对流行病学调查提供指导意见;同时为蚊虫的防治及疾病控制提供理论依据。
1 材料与方法
1.1 材料
1.1.1病毒:DEN-2病毒NGC株(New Guinea C strain)由军事医学科学院微生物流行病研究所病毒室提供。病毒经1日龄乳鼠(由军事医学科学院实验动物中心提供)颅内传代,发病后取出鼠脑研磨,用DMEM(Gibco)稀释10倍,液氮冻存备用。
1.1.2细胞:白纹伊蚊C6/36细胞由本室传代培养,用含10%小牛血清的RPIM 1640 (Gibco)高糖培养液进行培养传代,液氮冻存。
1.1.3蚊虫:埃及伊蚊实验室种群采自海口,在本室养殖多年, 吸血感染前饥饿24 h。蚊虫常规养殖的条件为:温度25℃,相对湿度(70±10)%,每天光照:黑暗 14 h:10 h,成蚊喂食 8%糖水,羽化5 d后用于实验。雌蚊吸食病毒后养殖在28℃恒温室内。
1.1.4实验小鼠:1日龄昆明乳鼠,由军事医学科学院实验动物中心提供。
1.1.5主要试剂:RPIM-1640培养基、胎牛血清(FBS)及TRIzol RNA提取试剂盒购于GIBCO公司,M-MLV逆转录试剂盒、PCR master Mix、PCR产物胶回收试剂盒、质粒提取试剂盒、DL-2000 DNA Marker购于TaKaRa公司,pEASY-T1 simple载体、DH5α感受态细胞购于Trans公司。AgPath-IDTMOne-Step RT-PCR Kit试剂为美国Ambion公司产品。
1.2 方法
1.2.1引物及探针设计:根据DENV的包膜蛋白基因组相对保守序列利用Primer Primer 5.0 软件设计引物和探针, 并通过NCBI数据库进行了Blast同源性比对验证。TaqMan探针的 5′端和3′端分别标记荧光基团FAM和淬灭基团TAMER。引物和探针均由上海生物技术有限公司合成。引物序列如下:DEN-2F(sense): 5′-AAGGAG AACCCAGCCTAAATGAA-3′;DEN-2R(anti-sense): 5′-GAACATAGCACAGGTCACAATGC-3′;TaqMan probe: FAM-TTCGTCTGCAAACACTCC ATGGTGGAC-TAMER, 理论扩增长度128 bp。
1.2.2DEN-2病毒荧光定量PCR标准品的制备:按照RNA提取试剂盒说明书提取DEN-2病毒鼠脑悬液、正常乳鼠悬液(阴性对照)以及DEN-2病毒细胞液(阳性对照)的RNA,反转录为cDNA,并用上述引物扩增目的基因,片段大小为128 bp,PCR反应条为:94℃5 min;94℃30 s,58℃30 s,72℃1 min,40个循环;72℃ 5 min,4℃保存。反应结束后用1%琼脂糖凝胶电泳验证扩增产物。而后用胶回收试剂盒对PCR产物进行回收,回收产物连接pEASY-T 1 simple载体,转化DH5α感受态细胞,挑取单个菌落进行PCR和测序检测。鉴定测序结果与原核酸序列高度同源后,用质粒提取试剂盒提取质粒DNA,测定质粒浓度,作为标准质粒,按如下公式计算标准质粒拷贝数:质粒拷贝数(copies/μL)=6.02×1023(copies/mol)×质粒浓度(g/μL)/质粒相对分子质量(MWg/mol)(李慧锋等, 2010)。
1.2.3DEN-2病毒标准质粒的荧光定量PCR方法的建立: 将标准质粒稀释为8个浓度做为模板,进行荧光定量PCR,采用25 μL体系: 2× RT-PCR Buffer 12.5 μL、DEN-2F 0.5 μL(10 μmol/μL)、DEN-2R 0.5 μL(10 μmol/μL)、TaqMan probe 1 μL(10 μmol/μL)、25× RT-PCR Enzyme Mix 1 μL、Nuclease-free Water 4.5 μL、质粒DNA 5 μL。反应条件为45℃10 min,95℃10 min;95℃15 s,58℃45 s,40个循环。先进行每个浓度3个复孔的荧光定量PCR,计算批内差异。然后再进行每个浓度1个孔的荧光定量PCR,进行3次,计算批间差异。
1.2.4DEN-2病毒感染C6/36细胞:将正常细胞转至12孔细胞培养板中,置于28℃培养箱中培养备用。待C6/36细胞长至单层后(42 h左右),每个培养孔内接种400 μL稀释10-2DEN-2病毒液,孵育90 min后将接入的病毒液吸出,每孔加入2 mL 2%小牛血清的RPIM 1640细胞培养液继续培养,分别在培养1、2、3、4、5、6、7 d后取出细胞培养板,反复冻融3次,-20℃保存备用。
1.2.5DEN-2病毒模拟自然途径感染蚊虫: 先取1日龄的昆明乳鼠颅内接种DEN-2病毒,病毒接种量为0.02 mL/只,将接种病毒的乳鼠置于纱窗设备的蚊笼中饲养,逐日观察乳鼠发病情况。待乳鼠出现典型神经症状时(病毒血症高峰期),将病毒血症高峰期乳鼠置于羽化3~5 d饥饿18~24 h的埃及伊蚊小笼内使其叮咬,吸血1 h后,-20℃冻麻,挑饱血雌蚊饲养。饲养室温度(29±1)℃,相对湿度(75±5)%,喂以5%糖水,分别在叮咬发病鼠后1、3、5、7、9、11和13 d收集埃及伊蚊的标本10只/组。正常鼠脑悬液做对照。
1.2.6荧光定量PCR检测DEN-2病毒在C6/36细胞和埃及伊蚊中的动态变化:按照RNA提取剂盒说明书提取上述不同时间收集的细胞、蚊虫样本的病毒RNA,阳性质粒标准品作为阳性对照,用前述建立的荧光定量PCR方法检测病毒增殖量,用仪器自带软件分析增殖量的动态变化,PCR扩增产物用1.2%琼脂糖凝胶电泳验证。
2 结果
2.1 荧光定量RT-PCR方法的建立
目的基因PCR产物经1.2%琼脂糖凝胶电泳分离,在128 bp处可见特异性扩增条带,与预期的大小一致(图1)。目的扩增片段经胶回收,连接pEASY-T 1 simple载体,转化DH5α感受态细胞,PCR和测序检测证明扩增的目的片段与原核酸序列同源率达到99%。经紫外分光光度计测定标准质粒的质量浓度为0.215 μg/μL,根据公式换算成拷贝数为4.93×1010copies/μL。

图1 病毒PCR扩增结果Fig.1 Normal RT-PCR analysisM: DL2000;1:病毒鼠脑悬液扩增结果;2:阴性对照;3:阳性对照.M: DL2000; 1:Suspension of infected mouse brain; 2: Negative control; 3: Positive control.
通过荧光定量RT-PCR各条件优化,得出检测DEN-2病毒的标准曲线,见图2。DEN-2病毒荧光定量RT-PCR标准品的浓度从1×102~1×107具有良好的线性关系(R2=0.998504),标准曲线总体斜率为-3.35。将1×108~1×102copies/μL系列梯度浓度的DEN-2标准品DNA重组质粒先进行每个浓度3个复孔的荧光定量PCR,计算批内差异;然后再进行每个浓度1个孔的荧光定量PCR,进行3次,计算批间差异。表1显示,本研究建立的荧光定量PCR法检测DEN-2标准品的批内差异最大只有1.69%。表2显示,荧光定量PCR法检测DEN-2质粒标准品的批间最大变异系数仅为4.21%。

图2 标准质粒构建的标准曲线Fig.2 Standard curve of Real-time for DEN-2 virus

样本SamplesDEN-2浓度/DEN-2Copies (Copies/μL)平均Ct值Mean Ct标准差SD变异系数CV(%)DEN-2质粒DEN-2 plasmid1×10815.280.110.691×10717.930.090.501×10621.050.040.191×10524.570.110.451×10427.890.180.641×10330.600.511.661×10232.410.190.57

表2 DEN-2荧光定量PCR批间差异Tab.2 Results of repeated inter-batch assay of one sample
荧光定量PCR扩增产物经1.2%琼脂糖凝胶电泳鉴定,大小为128 bp,见图3。
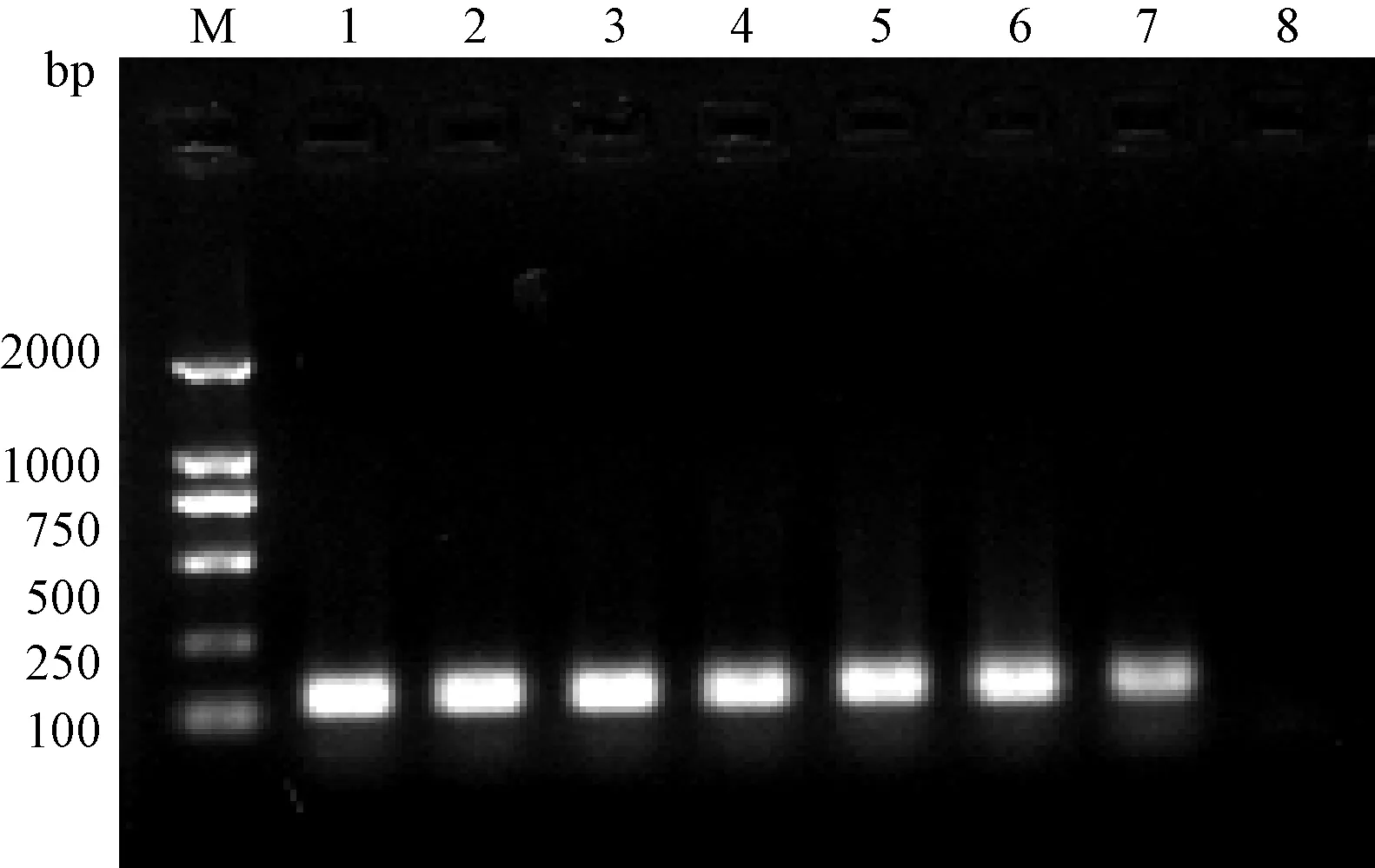
图3 荧光定量PCR扩增结果Fig.3 FQ-PCR analysisM:DL2000;1:1×108Copies/μL;2:1×107Copies/μL;3:1×106Copies/μL;4:1×105Copies/μL;5:1×104Copies/μL;6:1×103Copies/μL;7:1×102Copies/μL;8:阴性对照;Negative control.
2.2 DEN-2病毒感染蚊虫细胞
制作的蚊虫细胞状态良好,培养48 h后换液,24 h时接入DEN-2病毒,细胞在接毒第 2 d开始出现病变(CPE),第4 d病变明显(图4),第6 d细胞大量脱落。

图4 C6/36细胞接种感染DEN-2病毒第4 d的病变结果Fig.4 C6/36 cells with cytopathic effect by inoculating with DEN-2 virus on the fourth dayA:正常C6/36细胞(对照);B:C6/36细胞出现典型病变.A: Normal C6/36 cells(control); B: C6/36 cells with typical CPE.
2.3 荧光定量PCR检测DEN-2病毒在C6/36细胞中的动态变化
荧光定量结果如图5所示,登革病毒感染C6/36细胞第2~6 d的病毒载量较第1、7 d的高。其中第3 d的病毒载量最高。登革病毒感染C6/36细胞2~3 d期间病毒载量变化呈上升的趋势;3~5 d病毒载量变化并不明显,波动稳定;6~7 d病毒载量变化呈下降的趋势。

图5 DEN-2病毒感染C6/36细胞病毒载量动态变化Fig.5 Dynamic Change of DEN-2 virus loading in infected C6/36 cells

图6 DEN-2病毒模拟自然界感染埃及伊蚊体内病毒载量的动态变化Fig.6 Dynamic Change of DEN-2 virus loading in Aedes egypti simulate natural infection
2.4 荧光定量PCR检测DEN-2病毒模拟自然途径下感染埃及伊蚊的动态变化
埃及伊蚊叮咬DEN-2病毒发病鼠后的7个时间点,经 TaqMan RT-PCR检测病毒感染的第1~13 d登革病毒核酸均呈阳性,表明DEN-2病毒在埃及伊蚊体内至少能存在13 d。图6所示,感染DEN-2病毒的埃及伊蚊体内的病毒载量值随着时间增加呈现先低后高,随后再降低再升高,最后再降低。DENV模拟自然界途径感染的蚊虫体内第1、5、9、11 d的病毒载量较第3、7、13的高,其中第9 d得病毒载量最高。
3 讨论
TaqMan探针法是通过检测反应体系中的荧光强度动态变化对目的核酸进行实时定量分析。其核心是利用Taq酶的3′-5′外切核酸酶活性,切断探针,产生荧光信号。由于探针与模板是特异性结合,所以荧光信号的强弱就代表了模板的数量(Zhangetal., 2006)。国内外已有不少实验室针对登革病毒基因组的不同区域,如5′ UTR(Dos-Santosetal., 2008)、衣壳蛋白(Callahan etal., 2001; Chienetal., 2006)、包膜蛋白(Itoetal., 2004; 罗招凡等,2007)、NS5(Laueetal., 1999)和3′ UTR(Houngetal., 2001; 姚锦绣等,2009;Huhtamoetal., 2010)等,采用SYBR green I染料法、分子信标法和TaqMan探针法等方法,分别对登革病毒进行型特异或4个型通用的定性或定量检测,其中,又以TaqMan探针法应用最广。本研究针对DEN-2病毒的E基因序列保守区设计引物及探针,采用TaqMan探针法建立一种监测DEN-2病毒的荧光定量PCR方法。与病毒分离鉴定、血清学试验和普通RT-PCR等登革病毒感染的常规实验室诊断方法相比(Shuetal.,2004),其敏感性高,可以检测到初始模版中1×102copies/μL的病毒核酸,特异性好,操作简便迅速。该方法的建立对临床早期诊断及不同严重程度疾病患者的临床标本提供了一个快速、灵敏、可靠的技术工具。
本研究直接将待检目的片段克隆到pEASY-T1 simple载体中以构建重组质粒作为标准品,最大限度的保证了标准品与检测样品间的扩增效率一致性。通过10倍稀释标准品质粒建立的标准曲线具有良好的线性关系R2=0.998504,标准曲线总体斜率为-3.35。说明该实验PCR扩增效率良好,能够保证实验数据的精确性,其检测范围较宽、灵敏度高,完全可以满足实际应用。重复性实验结果变异系数(CV)0.19%~4.21%,表明该方法具有很好的重复性。用此标准品在优化的浓度和体系下绘制的标准曲线重复性好、稳定、可信。以此方法研究DEN-2病毒在细胞和蚊虫体内的复制动力学,结果可信度更高。
在本研究中,通过建立的TaqMan RT-PCR方法能够动态的监测细胞与蚊体内DENV载量的变化规律。根据监测细胞内DENV载量的变化结果显示,DENV病毒在感染细胞第2 d DENV病毒载量略微降低,第3 d即大幅上升至高峰,第4~5 d仍然与高峰时接近,而且病毒载量的处于同一数量级,但至第6~7 d时又有波动呈下降趋势。这可能是在细胞接种第3 d时,细胞基本呈岛状,细胞存活数目最多,释放入上清中的DENV也最多,随后细胞逐渐长成单层,会有部分细胞死亡,释放入上清中的DENV会有所减少,但随着细胞生长,病毒复制也在加快,因此上清中DENV含量会逐渐增加,病毒载量保持稳定在同一数量级上,而在细胞接种第7 d时,细胞破碎大量死亡导致病毒载量降低。同时,细胞状态与病毒数量呈负相关性,病毒接种2 d后细胞状态良好,第3 d细胞出现病变,第4 d时病变明显,第6、7 d时细胞大量脱落。由以上结果可知,DENV病毒在接种细胞后不同时间内病毒活性和复制能力存在一定差异,第4 d病毒状态最佳,活性和复制能力最强。根据病毒在细胞水平上复制增殖的动态规律可以确定病毒增殖的最佳时间,获得较高滴度的病毒,为后续实验提供优良的病毒。
同样,在登革病毒感染的蚊虫实验中,随着时间增加感染DEN-2病毒的埃及伊蚊体内的病毒载量值随着时间增加呈现先低后高,随后再降低再升高,最后再降低,表明病毒在蚊体内发生了增殖。DENV在蚊虫第1~7 d内增殖不明显,第9 d DENV开始大量复制,蚊虫体内的病毒载量达到高峰,但第11~13 d后有所下降至稳定。这表明DENV病毒9 d后在蚊虫体内开始快速增殖,外潜伏期约为9 d,到11~13 d后蚊虫体内病毒增殖稳定波动。因此绘制的病毒增殖曲线全程真实地反映了DEN-2病毒在其媒介蚊虫体内的增殖动态。这一研究为蚊虫体内病毒的复制能力及病毒载量的高低与致病机理提供了重要的实验数据和理论依据。
迄今为止,实时定量PCR方法大多数应用于登革病毒早期快速诊断,对登革病毒在媒介体内的动态变化监测未见报到。鉴于媒介体内病毒的动态变化监测是控制登革热疾病的一个重要方面,本研究选用DEN-2病毒在细胞和蚊虫体内复制增殖实验。从个体细胞和整体感染研究了登革病毒复制的动态变化,揭示了病毒在细胞和蚊虫体内复制增殖的动态规律。掌握登革病毒在细胞和蚊虫体内的复制情况对监测登革病毒水平传播、毒力演变有重要意义。总之,实时荧光定量PCR 技术为深入研究病毒与宿主的相互作用提供了可行的技术平台。并以此确定最优感染体系。
