1-磷酸鞘氨醇促进间充质干细胞向心肌分化
2013-11-12姜丽丽刘天庆宋克东关水李香琴葛丹
姜丽丽,刘天庆,宋克东,关水,李香琴,葛丹
1 大连理工大学化工学院 干细胞与组织工程研发中心,辽宁 大连 116024
2 大连理工大学盘锦校区 生命与医药学院,辽宁 盘锦 124221
近年来,急性心肌梗死已经成为人类死亡的主要疾病。由于心肌细胞增殖能力很弱,缺乏足够的再生能力[1],所以心肌发生梗死后,无法有效、完整地修复受损心肌组织,而造成心肌组织功能丧失。干细胞则为治疗心肌梗死提供了新思路。其中脐带和脂肪来源的间充质干细胞(Umbilical mesenchymal stem cells,UC-MSCs and adipose derived mesenchymal stem cells,AD-MSCs),由于来源广泛、不受争议,能够向心肌细胞分化,表达心肌细胞的特异性蛋白,而成为治疗心脏疾病、修复心肌组织的首选细胞[2-6]。然而,现有的 5-氮胞苷等化学诱导以及心肌细胞培养液诱导等方法,都很难使UC-MSCs或 AD-MSCs分化成具有心肌细胞功能特性 (细胞收缩和钙瞬变现象等)的细胞。
有报道指出,机械力、生物活性因子、电刺激等微环境因素能够调控间充质干细胞(Mesenchymal stem cells,MSCs) 的分化[7]。因此有必要寻找适宜的生物活性因子,使其与心肌诱导剂相结合,以促进 UC-MSCs和 AD-MSCs向心肌的分化。近年来研究发现,1-磷酸鞘氨醇(Sphingosine-1-phosphate,S1P) 是一种具有生物活性的脂类,能够调节细胞生长、细胞迁移、细胞分化等许多生物过程[8-9]。Zhao等则报道,S1P与心肌细胞培养液 (Cardiomyocyte culture medium,CMCM)共同作用可以促进 UC-MSCs向心肌细胞的功能性分化[10]。于是,S1P与心肌诱导剂 (CMCM)共同作用能否促进其他来源的MSCs (如 AD-MSCs)向心肌细胞的功能性分化,以及S1P适宜的作用时间和作用浓度等,都成为值得研究的内容。
本文研究了 S1P联合心肌细胞培养液协同诱导UC-MSCs和AD-MSCs向心肌细胞的分化。探索了 S1P的适宜作用时间和浓度,以及 S1P在CMCM分化培养液中对细胞活性的影响。同时通过电生理学检测来确定 S1P是否能够促进两种来源的MSCs向心肌细胞的功能性分化。
1 材料与方法
1.1 细胞培养
UC-MSCs的 (Cat. No. 6252,USA)和人来源的心肌细胞 (Human cardiac myocytes,HCM)(Cat. No. 6200,USA)均从 ScienCell Research Laboratories购买。AD-MSCs则由本实验室分离获得[11]。
UC-MSCs与 AD-MSCs培养:细胞(UC-MSCs and AD-MSCs) 用含 10%胎牛血清(Fetal bovine serum,FBS,Sigma)、100 U/mL青霉素 (Sigma,USA)、100 μg/mL 链霉素 (Sigma,USA)的 DMEM (Dulbecco’s Modified Eagle Medium,Sigma)完全培养基,在37 ℃、5%二氧化碳饱和湿度的培养箱中培养。当达到80%~90%融合时,用胰酶/EDTA (Sigma,USA)消化细胞,离心 (1 000 r/min,5 min)收集细胞。然后将细胞以5 000 cells/cm2的密度接种到培养瓶中培养。第4代的细胞被用于后续实验。
HCM培养:心肌细胞以5 000 cells/cm2密度接种到培养瓶中,用含 10%胎牛血清 (Fetal bovine serum,FBS,Sigma)、100 U/mL青霉素(Sigma,USA)、100 μg/mL 链霉素 (Sigma,USA)的 DMEM (Dulbecco’s Modified Eagle Medium,Sigma)完全培养基,在 37 ℃、5%二氧化碳饱和湿度的培养箱中培养。
CMCM的提取:将心肌细胞以5 000 cells/cm2密度接种到培养瓶中,在含10% FBS的DMEM完全培养基中培养,24 h后吸出培养液备用,并更换新的完全培养基。此后,每隔24 h吸取培养液1次,并更换新的培养基。
1.2 向心肌诱导分化
分别在心肌细胞培养液中添加不同含量的S1P,诱导UC-MSCs和AD-MSCs向心肌细胞分化。实验分为 5个诱导组:CMCM,CMCM+0.1 μmol/L S1P (Sigma),CMCM+0.5 μmol/L S1P,CMCM+1.0 μmol/L S1P,5-azacytidine (10 μmol/L)(Sigma,USA);2个对照组:阳性对照组 (HCM+DMEM),阴性对照组 (UC-MSCs or AD-MSCs+DMEM)。消化收集第 4代的 UC-MSCs和AD-MSCs,以5 000 cells/cm2细胞密度接种到24孔培养板中,用含10% FBS的DMEM培养3 d,然后更换上面各组的分化培养基,继续分化培养7 d、14 d和28 d。
1.3 免疫荧光染色
细胞经诱导分化后,用PBS (Phosphate buffer solution)冲洗 3次,4%多聚甲醛室温固定15 min。PBS冲洗3次后,0.1% Triton X-100透膜30 min,然后用10%山羊血清在37 ℃下封闭1 h。含有抗 α-actin (Sigma)、connexin-43 (Sigma)和MYH-6 (Sigma)的一抗4 ℃孵育过夜。PBS冲洗3次后,用偶联FITC的二抗 (Sigma),在室温下,避光孵育1 h。最后用DAPI (Sigma)染色细胞核,置于荧光显微镜和共聚焦显微镜下观察。
使用 ImageJ软件分析各组心肌特异性蛋白表达的荧光强度,统计 10个不同视野下的共聚焦显微镜照片。分化率的统计方法是:统计实验组荧光照片中表达 connexin-43的阳性细胞数占总细胞数的比值,每组至少统计5个不同视野荧光显微镜照片。
1.4 细胞活性分析
分别在分化培养的第7天和14天,用MTT检测各组细胞的活性。具体方法如下:将 MTT(Sigma) 工作液 (5 mg/mL)加入到 6孔培养板中 (300 μL/孔),然后将6孔板放在37 ℃下孵育4 h。吸出MTT工作液,向6孔板中加入DMSO(Dimethyl sulfoxide,Sigma)(3 mL/孔)溶解甲瓒晶体,37 ℃孵育10 min。然后从6孔培养板中吸出溶解了甲瓒晶体的DMSO溶液 (200 μL/孔),将其转移到96孔培养板中,用酶标仪570 nm检测吸光度值。
1.5 电生理学检测
钙瞬变是指心肌细胞收缩时发生的瞬时性钙增高 (Calcium transients)。细胞内的 Ca+可以用Fluo-3钙指示剂进行标记,并在488 nm激发波长下,发出荧光。实验中检测的荧光比值代表了细胞内的钙含量。当细胞处于静息状态时,荧光比值是一条频率高而波幅低的相对平整的曲线,反映细胞内的钙处于相对稳定状态。当细胞受到电场刺激而产生钙瞬变时,荧光比值出现快速变化,反映了细胞内钙浓度的变化。本实验设计了 3个实验组,包括 CMCM 组、CMCM+0.5 µmol/L S1P组及对照组5-azacytidine。
将经诱导分化的细胞接种到9 mm直径的玻片上,放入培养皿内并在培养箱中培养1 d后,将玻片放在显微镜下的灌注小室 (长 4 cm,宽1 cm,深 0.5 cm) 内,用预热的DMEM (37 ℃)灌注5 min。关闭进、出液口,然后向小室中加入 5 μL Fluo-3钙指示剂 (Invitrogen)。孵育10 min后,用预热的DMEM (37 ℃) 连续灌注至少40 min。用40×油镜,在488 nm (Fluo-3的激发波长)荧光下,观察细胞中钙的瞬变现象,并用 pCLAMP程序 (Axon Instrument Inc,1101 Chess Drive,Foster City,CA,USA)记录钙的瞬变。用Spike 2程序控制,对细胞进行恒定的脉冲刺激 (脉冲频率1 Hz),通过DigiData 1322A A/D转化器 (Axon Instruments Inc.)将电信号数字化 (5 kHz),同时记录到电脑中便于以后分析。
1.6 统计学分析
实验数据用 OriginPro8.0软件 (OriginLab Corporation,USA)分析,并且所有数据用±s表示 (SD,n=3)。采用t检验,分析各组间细胞向心肌分化以及细胞活性的差异,P<0.05为差异有显著性意义。
2 结果
2.1 S1P作用时间对细胞向心肌分化的影响
AD-MSCs和 UC-MSCs经过 7 d、14 d和28 d的诱导分化后,用免疫荧光染色,检测心肌细胞特异性蛋白 (α-actin,connexin-43,MYH-6)的表达,以确定它们是否向心肌细胞分化。CMCM+0.5 μmol/L S1P组的结果如图1所示。经7 d诱导后,AD-MSCs (图 1A)和 UC-MSCs(图1B)都开始表达3种心肌细胞特异性蛋白,但是表达的荧光强度较弱。14 d诱导培养后,大部分细胞表达心肌细胞特异性蛋白,并且荧光强度比7 d时明显增强。而28 d诱导分化后,心肌细胞特异性蛋白的表达强度与14 d时的相似,但是大部分细胞死亡脱落,只剩下很少数量的细胞。综合以上结果,我们可以得出S1P的适宜作用时间是 14 d。因此后续实验我们都采用 14 d作为S1P的作用时间。
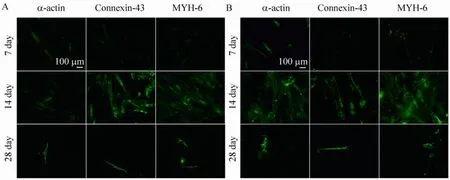
图1 经CMCM+0.5 μmol/L S1P诱导不同时间后AD-MSCs和UC-MSCs向心肌分化的情况Fig. 1 Cardiomyogenic differentiation of AD-MSCs and UC-MSCs in CMCM+0.5 μmol/L S1P after being incubated at different time. The expression of three cardiac specific proteins was used to evaluate the cardiomyogenic differentiation of AD-MSCs (A) and UC-MSCs (B) in CMCM+0.5 μmol/L S1P.
另外,本文还检测了常用诱导剂(5-azacytidine)诱导后AD-MSCs和UC-MSCs在不同时间点向心肌分化的情况。结果显示,经5-azacytidine处理24 h后,AD-MSCs (图2A)和UC-MSCs (图2B)在诱导培养第14天时开始表达心肌特异性蛋白 (α-actin, connexin-43,MYH-6),诱导培养28 d时这些心肌特异性蛋白的表达增强。但与图1中CMCM+ 0.5 μmol/L S1P组的分化时间相比,5-azacytidine组心肌分化时间明显延后。
为了消除一抗与二抗等因素对染色结果的干扰,本文设置了阳性对照组和阴性对照组。用DMEM培养的UC-MSCs和AD-MSCs作为阴性对照组,而DMEM培养的HCM作为阳性对照组。结果表明,阴性对照组的 UC-MSCs和AD-MSCs都不表达心肌细胞特异性蛋白,而阳性对照的HCM表达3种心肌特异性蛋白 (图3)。
2.2 S1P浓度对细胞向心肌分化的影响
随着 S1P在 CMCM中浓度的增加,UC-MSCs表达 α-actin和 connexin-43增加,而MYH-6的表达则随着S1P浓度增加而出现了极值 (CMCM+0.5 µmol/L S1P 组)(图 4B)。并且,与不加S1P的组相比,这些蛋白的表达均显著增强 (P<0.05)(图5B)。另外,从图中还可以观察到,5-azacytidine组表达的心肌特异性蛋白的荧光强度要明显低于CMCM组 (图4B),并且具有显著性差异 (P<0.05)(图5B)。

图2 经5-azacytidine诱导不同时间后AD-MSCs和UC-MSCs向心肌分化的情况Fig. 2 Cardiomyogenic differentiation of AD-MSCs and UC-MSCs in 5-azacytidine after being induced at different time. The expression of three cardiac specific proteins was used to evaluate the cardiomyogenic differentiation of AD-MSCs (A)and UC-MSCs (B)in 5-azacytidine.

图3 对照组中细胞的心肌特异性蛋白表达Fig. 3 Expression of cardiac specific protein of cells in control groups. UC-MSCs or AD-MSCs were cultured in normal medium (DMEM)as negative control, HCM was cultured in normal medium (DMEM)as positive control.
对于AD-MSCs,3种心肌特异性蛋白的表达都随着S1P浓度的增加而增强 (图4A),并且与不添加 S1P相比都具有显著性差异 (P<0.05)(图5A)。而5-azacytidine组表达的心肌特异性蛋白的荧光强度虽然低于CMCM组 (图4A),但是并没有显著性差异 (图 5A)。总之,常用诱导剂5氮胞苷使两种MSCs向心肌分化的效果都不如CMCM,更不如CMCM + S1P的分化效果。
另外,本文还通过分析 connexin-43阳性细胞所占的百分数,来确定各种分化条件下UC-MSCs与AD-MSCs的分化率,包括CMCM组、CMCM+0.5 μmol/L S1P组以及5-azacytidine组,结果如图6所示。可见经3种分化培养基处理后,AD-MSCs与UC-MSCs向心肌的分化率比较相近,都在30%~35%范围内,没有显著性差异。提示 S1P在 CMCM中不能显著提高AD-MSCs与UC-MSCs向心肌的分化率。
2.3 S1P浓度对细胞活性的影响

图4 经不同分化培养基诱导后UC-MSCs与AD-MSCs向心肌分化的情况Fig. 4 Cardiomyogenic differentiation of AD-MSCs and UC-MSCs incubated in different culture medium. The differentiation of AD-MSCs (A)and UC-MSCs (B)toward cardiomyocytes was examined by immunofluorescence.

图5 不同培养条件下AD-MSCs与UC-MSCs向心肌分化特异性蛋白表达强度的比较Fig. 5 Comparison the cardiomyogenic differentiation of AD-MSCs and UC-MSCs incubated in different medium.The fluorescence intensity of the images for AD-MSCs (A)and UC-MSCs (B)was analyzed using software of Image J.The data were expressed as ±s (SD, n=3). * indicates statistically significant (P<0.05)difference of fluorescence intensity compared with CMCM group.

图6 不同分化培养条件下AD-MSCs与UC-MSCs的心肌分化率对比Fig. 6 Comparison of cardiomyogenic differentiation percentage of AD-MSCs and UC-MSCs incubated in different medium. The percentage of AD-MSCs (A) and UC-MSCs (B) expressing connexin-43 was used to evaluate cardiomyogenic differentiation after CMCM, CMCM+0.5 μmol/L S1P and 5-azacytidine incubation. The data were expressed as ±s deviation (SD, n=3). Statistically significant difference (P<0.05) compared with CMCM group.
细胞活性实验结果表明,S1P对 UC-MSCs和AD-MSCs是有毒性的,并且随着S1P浓度的增加,UC-MSCs和AD-MSCs的细胞活性明显降低,与不加S1P组 (CMCM)相比具有显著性差异 (P<0.05)(图 7)。同时也可以发现,5-azacytidine组和 DMEM 组细胞活性明显高于CMCM 培养基组,并且 5-azacytidine 组和DMEM组细胞14 d时的细胞活性值 (图7B)要高于7 d时的细胞活性值 (图7A),而CMCM各组的结果则正好相反。

图7 细胞在不同分化培养基中培养7 d和14 d后的细胞活性对比Fig. 7 Comparison of cell activity of UC-MSCs and AD-MSCs cultured in different medium on the 7th day and 14th day. Cell activity of UC-MSCs or AD-MSCs on the 7th day (A)and 14th day (B)was evaluated by MTT. The data were expressed as ±s deviation (SD, n=3). * indicates statistically significant (P<0.05)difference of cell activity compared with CMCM group.
2.4 S1P对细胞钙瞬变的影响
电生理实验结果如图8所示,AD-MSCs与UC-MSCs在CMCM及5-azacytidine分化培养液中分化培养14 d以后,再经电场刺激,这些细胞内的钙离子浓度始终保持相对稳定,没有发生任何钙浓度激增,即没有发生钙瞬变。而在CMCM+0.5 µmol/L S1P中分化培养14 d、再经电刺激后,AD-MSCs与 UC-MSCs内钙离子浓度均发生了瞬时性增高,即发生了钙瞬变。这说明S1P能够促进UC-MSCs与AD-MSCs在CMCM中向心肌的功能性分化,使分化细胞具有心肌细胞的功能性 (钙瞬变)。
3 讨论
MSCs由于其来源广泛、来源没有伦理道德问题,且具有自我更新、多向分化、免疫原性低等生物学特性,而成为干细胞移植治疗心肌梗死的主要细胞来源。脐带和脂肪组织较易获得,且对供体造成的痛苦小,成为MSCs的热点来源。许多研究表明UC-MSCs和AD-MSCs在心肌诱导剂 (CMCM或是5-氮胞苷)作用下,能够分化成心肌细胞,分化时间从2周到5周[4-6,12]。本研究结果表明,在 5-氮胞苷作用下,UC-MSCs与AD-MSCs从14 d时开始向心肌细胞分化,28 d时分化加强,表现为心肌特异性蛋白表达加强。而在 S1P与心肌诱导剂 (CMCM)的共同作用下,UC-MSCs和AD-MSCs最早在第7天就开始表达心肌特异性蛋白。这些结果提示,S1P与CMCM共同作用可以适当提前 MSCs向心肌分化的时间。但是,7 d时心肌特异性蛋白表达强度很弱,明显低于经14 d或是28 d诱导的细胞。而经28 d诱导后,心肌特异性蛋白的表达虽然很强,但S1P降低了细胞活性,使细胞大量死亡脱落,仅剩下少量细胞。所以,本研究确定S1P在CMCM中的适宜作用时间为14 d。

图8 分化细胞的电生理学特性的分析Fig. 8 Electrophysiological characters analysis. Calcium transient of UC-MSCs or AD-MSCs in CMCM, CMCM+0.5 µmol/L S1P, and 5-azacytidine groups were observed. Fluorescence signals were normalized in terms of the fractional fluorescence change (F/F0). And F/F0 indicated the amplitude of the calcium transients; F0 was the baseline fluorescence, indicating the normal intracellular Ca+ fluorescence intensity without calcium transients; F was the fluorescence intensity at any given time. X axis indicated the scanning time.
很多研究指出 S1P能够调控许多心血管过程 (Cardiovascular processes),包括血管生成、心肌功能、血管发育以及心脏发育等[13-15]。另外一些研究还证实,S1P与肌分化的调控有关[16-17]。本实验结果证实S1P与心肌诱导剂 (心肌细胞培养液)共同作用,能够促进 UC-MSCs和AD-MSCs向心肌细胞的功能性分化。并且这种促进作用是浓度依赖的,这一结果与此前报道的S1P浓度依赖性的促进AD-MSCs向平滑肌细胞分化相一致[7]。但由于细胞活性随S1P浓度增加而不断下降,因此本文选择 0.5 μmol/L作为S1P在CMCM中的适宜作用浓度。另外,本文的研究结果还显示,虽然添加S1P可以很明显的促进UC-MSCs和AD-MSCs向心肌分化的程度(表现为心肌特异性蛋白表达显著增强),但是并没有显著提高两种MSCs向心肌分化的细胞数目或分化率。这一结果与此前的一篇报道相类似,Zhao等[10]研究发现,随着培养时间增加,CMCM组与CMCM+S1P组表达肌动蛋白、肌球蛋白的细胞百分含量显著提高,但是同一时间点上,两组表达肌动蛋白、肌球蛋白的细胞百分含量则相似,没有显著变化。
收缩是心肌细胞的重要功能,其触发源于细胞内的钙瞬变。钙瞬变是Ca+介导的兴奋-收缩偶联,是心肌收缩的关键环节[18],其具体过程为:当心肌细胞受到外界电场刺激时,引起其胞膜上的电压依赖性L-型钙通道开放,胞外Ca+内流,胞质内钙离子浓度升高,通过钙诱导钙释放的方式引起心肌细胞内钙库,即肌质网在短时间内向胞质释放大量的钙,造成胞质内钙离子浓度的瞬时升高。本研究结果表明,细胞经过CMCM+S1P处理后,当加入电场刺激时,向心肌分化了的细胞发生了钙瞬变,而未添加 S1P组与5-azacytidine组的细胞则没有钙瞬变。这说明常规的诱导方法 (CMCM和5-azacytidine诱导)不能够使UC-MSCs和AD-MSCs向心肌的功能性分化,而 S1P可以与 CMCM 共同作用,促进UC-MSCs和AD-MSCs向心肌的功能性分化,使它们具有类似心肌细胞的钙瞬变。
研究发现,S1P是通过作用于细胞膜上G-蛋白偶联受体家族来发挥多种生物学效应的[9,19-20]。Wamhoff等[21]的研究证明,S1P通过作用于细胞上的S1P1和S1P3受体,来调控细胞的增殖,而S1P2受体则在调控收缩蛋白表型中起到关键作用。另一篇报道[22]则指出,S1P2和 S1P3参与了S1P促进中胚层前体细胞向平滑肌细胞分化的进程。Nincheri等[23]的研究显示,AD-MSCs中存在 5种 S1P受体,他们应用受体抑制剂,证明S1P2在S1P促进AD-MSCs向平滑肌细胞分化中起到重要作用,而S1P1起到次要作用。事实上,当抑制 S1P2时,肌分化相关的标志基因表达以及L-型钙离子电流的诱导都被取消。而当选择性抑制S1P1时,由S1P引起的多种生物学效应仅仅是被削弱。另外,有研究发现,动脉损伤后平滑肌特异性蛋白 α-actin的表达需要激活S1P2,这又一次证明在平滑肌分化中 S1P2的重要作用[24]。由此可以推测,S1P可能是通过作用于UC-MSCs和AD-MSCs细胞膜上的S1P2受体,来调控细胞表达心肌特异性蛋白的,从而使细胞具有心肌细胞特异性表型以及特异性功能 (钙瞬变)。
4 结论
S1P能够与心肌细胞培养液一起协同作用,促进UC-MSCs和AD-MSCs向心肌的功能性分化。并且,随着S1P浓度的增加,促分化作用增强,但细胞活性降低。S1P在 CMCM 中促进UC-MSCs和 AD-MSCs向心肌分化存在着适宜的作用时间和浓度,分别是14 d和0.5 μmol/L。
[1]Beltrami AP, Urbanek K, Kajstura J, et al.Evidence that human cardiac myocytes divide after myocardial infarction. N Engl J Med, 2001,344(23): 1750-1757.
[2]Han ZB, Chen HX, Deng JX. Multipotential differentiation and potential applications of adipose-derived stem cells. Chin J Biotech, 2007,23(2): 195-200 (in Chinese).韩正滨, 陈红星, 邓继先. 脂肪源性干细胞的多向分化潜力及应用前景. 生物工程学报, 2007,23(2): 195-200.
[3]Choi YS, Dusting GJ, Stubbs S, et al.Differentiation of human adipose-derived stem cells into beating cardiomyocytes. J Cell Mol Med,2010, 14(4): 878-889.
[4]Kadivar M, Khatami S, Mortazavi Y, et al. In vitro cardiomyogenic potential of human umbilical vein-derived mesenchymal stem cells. Biochem Biophys Res Commun, 2006, 340(2): 639-647.
[5]Qian Q, Qian H, Zhang X, et al. 5-azacytidine induces cardiac differentiation of human umbilical cord-derived mesenchymal stem cells by activating extracellular regulated kinase. Stem Cells Dev,2012, 21(1): 67-75.
[6]Wu KH, Mo XM, Zhou B, et al. Cardiac potential of stem cells from whole human umbilical cord tissue. J Cell Biochem, 2009, 107(5): 926-932.
[7]Nincheri P, Luciani P, Squecco R, et al.Sphingosine 1-phosphate induces differentiation of adipose tissue-derived mesenchymal stem cells towards smooth muscle cells. Cell Mol Life Sci,2009, 66(10): 1741-1754.
[8]Calise S, Blescia S, Cencetti F, et al. Sphingosine 1-phosphate stimulates proliferation and migration of satellite cells role of S1P receptors. Biochimica Biophysica Acta, 2012, 1823(2): 439-450.
[9]Kim RH, Takabe K, Milstien S, et al. Export and functions of sphingosine-1-phosphate. Biochim Biophys Acta, 2009, 1791(7): 692-696.
[10]Zhao Z, Chen Z, Zhao X, et al. Sphingosine-1-phosphate promotes the differentiation of human umbilical cord mesenchymal stem cells into cardiomyocytes under the designated culturing conditions. J Biomed Sci, 2011, 18: 37.
[11]Zhu YX, Liu TQ, Song KD, et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochem Funct, 2008, 26(6): 664-675.
[12]Wang HS, Hung SC, Peng ST, et al. Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord. Stem Cells, 2004, 22(7):1330-1337.
[13]Wendler CC, Rivkees SA. Sphingosine-1-phosphate inhibits cell migration and endothelial to mesenchymal cell transformation during cardiac development. Dev Biol, 2006, 291(2): 264-277.
[14]Alewijnse AE, Peters SLM, Michel MC.Cardiovascular effects of sphingosine-1-phosphate and other sphingomyelin metabolites. Br J Pharmacol, 2004, 143(6): 666-684.
[15]Allende ML, Proia RL. Sphingosine-1-phosphate receptors and the development of the vascular system. Biochim Biophys Acta, 2002, 1582(1-3):222-227.
[16]Meacci E, Nuti F, Donati C, et al. Sphingosine kinase activity is required for myogenic differentiation of C2C12 myoblasts. J Cell Physiol,2008, 214(1): 210-220.
[17]Squecco R, Sassoli C, Nuti F, et al. Sphingosine 1-phosphate induces myoblast differentiation through Cx43 protein expression: a role for a gap junction-dependent and -independent function. Mol Biol Cell, 2006, 17(11): 4896-4910.
[18]Bers DM. Cardiac excitation-contraction coupling.Nature, 2002, 415(6868): 198-205.
[19]Olivera A, Spiegel S. Sphingosine kinase: a mediator of vital cellular functions. Prostaglandins,2001, 64(1-4): 123-134.
[20]Spiegel S, Milstien S. Sphingosine-1-phosphate: an enigmatic signalling lipid. Nat Rev Mol Cell Biol,2003, 4(5): 397-407.
[21]Wamhoff BR, Lynch KR, Macdonald TL, et al.Sphingosine-1-phosphate receptor subtypes differentially regulate smooth muscle cell phenotype. Arterioscler Thromb Vasc Biol, 2008,28(8): 1454-1461.
[22]Donati C, Marseglia G, Magi A, et al. Sphingosine 1-phosphate induces differentiation of mesoangioblasts towards smooth muscle. A role for gata6. PLos ONE, 2011, 6(5): e20389.
[23]Nincheri P, Luciani P, Squecco R, et al.Sphingosine 1-phosphate induces differentiation of adipose tissue-derived mesenchymal stem cells towards smooth muscle cells. Cell Mol Life Sci,2009, 66(10): 1741-1754.
[24]Medlin MD, Staus DP, Dubash AD, et al.Sphingosine 1-phosphate receptor 2 signals through leukemia-associated rhogef (larg), to promote smooth muscle cell differentiation. Arterioscler Thromb Vasc Biol, 2010, 30(9): 1779-1786.
