灰葡萄孢菌AUR1基因真核表达载体的构建、表达及酶活性分析
2013-11-12邱永春刘小平苟萍
邱永春,刘小平,苟萍
新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046
鞘脂是真核细胞膜的主要组成成分,是构成脂质双分子层的重要亚结构,它在调节脂质双分子层膜的流动性中起十分重要的作用。在过去二十年对鞘脂的研究中,发现鞘脂及其代谢产物在调节细胞的生长、分化、衰老和细胞的粘附和识别、膜运输和脂筏的形成等许多重要的信号转导过程有重要作用,进而使细胞产生各种不同的生物学功能[1-5]。
近年相继在酵母等真菌、原生动物和拟南芥中发现肌糖磷脂酰神经酰胺 (IPC)合成酶,该酶是鞘脂合成代谢的关键酶[6]。酵母的IPC合成酶由AUR1基因编码,从人类病原真菌白假丝酵母Candida albicans、光滑假丝酵母 Candida glabrata、克柔假丝酵母Candida krusei、近平滑假丝酵母 Candida parapsilosis、热带假丝酵母Candidatropicalis和新型隐球菌,一些曲霉属丝状真菌烟曲霉 Aspergillus fumigatus、构巢曲霉Aspergillus nidulans、黑曲霉Aspergillus niger和米曲霉 Aspergillus oryzae,以及粟酒裂殖酵母Schizosaccharomyces pombe中分离得到AUR1类似基因,这些基因的序列很保守,具有IPC1p活性所需的共同结构域,说明该基因的进化是保守的[7-9]。AUR1表达和调控对真菌生长和发育具有关键的作用,缺乏 IPC合成酶的酵母因不能合成复杂鞘脂类而死亡,而且导致神经酰胺的积累[10]。神经酰胺积累抑制细胞的生长,并通过阻止细胞周期引起细胞凋亡[11-12],这都表明IPC合成酶是真菌细胞生长和存活所必需的。短梗霉素A (Aureobasidin A,AbA)是IPC合成酶的强烈抑制剂,真菌用AbA处理或真菌IPC合成酶基因表达抑制均导致细胞多重形态学细胞组织结构生理生化特性的改变,包括微管消失,微管蛋白降解,细胞出芽方式的改变,细胞循环的阻滞,几丁质的异常积累,细胞膜完整性的破坏,导致细胞质的渗漏,最终细胞死亡[7,13-14]。本研究通过构建灰葡萄孢菌肌糖磷脂酰神经酰胺合成酶基因 (BcAUR1)的重组穿梭质粒 pYES2-BcAUR1,转化酿酒酵母脲嘧啶突变菌株Δyor1,为研究灰葡萄孢菌肌糖磷脂酰神经酰胺合成酶的表达及其功能奠定基础。
1 材料与方法
1.1 菌株与质粒
灰葡萄孢菌由浙江大学农业与生物技术学院李红叶教授实验室提供,大肠杆菌DH5α为本实验室保存,酿酒酵母Saccharomyces cerevisiae尿嘧啶突变菌株 Δyor1及pYES2穿梭载体购自Invitrogen公司。
1.2 主要试剂及培养基
氨苄青素 (Amp) 购自上海生工生物工程有限公司,RT-PCR试剂盒、限制性内切酶BamHⅠ、XhoⅠ购于 TaKaRa公司,ECL化发光试学剂盒(RPN2132)购于 Amersham Biosciences公司,AbA、Tris、CHAPS、C6-NBD-Cer (6-[N-(7-nitro-2,1,3-benzoxadiazol-4-yl)amino]-hexanoyl ceramide,带荧光标记的底物)、PI (磷脂酰肌醇)、甲酸 (CH3COOH)和胶回收试剂盒均购于北京鼎国昌盛生物技术有限责任公司,FLAG标签一抗、二抗为碧云天公司产品。
营养缺陷培养基 SC-U:无氨基酸酵母氮源(含硫酸铵)6.7 g,葡萄糖20 g,琼脂粉20 g,营养缺陷混合物2 g,加水至1 000 mL,0.1 MPa,121 ℃,湿热灭菌20 min。
诱导培养基:无氨基酸酵母氮源6.7 g,半乳糖20 g,琼脂粉20 g,营养缺陷混合物2 g,加水至1 000 mL,0.1 MPa,121 ℃,湿热灭菌20 min。
1.3 引物设计
根据灰葡萄孢菌AUR1的cDNA序列设计合成含有 FLAG标签的引物,并在 F端加入BamHⅠ酶切位点,在R端加入XhoⅠ酶切位点。引物由华大基因合成 (表1)。

表1 文中所用的引物Table 1 Primers used in this study
1.4 RT-PCR
按试剂盒提取灰葡萄孢菌总 RNA (RNA提取试剂盒,鼎国昌盛生物技术有限责任公司),经紫外分光光度法和凝胶电泳鉴定纯度及浓度后,置-80 ℃备用。取1 μL纯化mRNA为模板,按反转录试剂盒 (TaKaRa公司的 RT-PCR试剂盒)说明书的方法合成 cDNA。利用以上引物和高保真DNA聚合酶对灰葡萄孢菌AUR1的cDNA序列进行PCR扩增,反应条件为:94 ℃预变性3 min;94 ℃变性 30 s,64 ℃退火 30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。PCR产物 (AUR1基因)用胶回收试剂盒进行纯化、回收,目的条带连接到pMD18-T载体上,进行测序。
1.5 重组穿梭质粒pYES2-BcAUR1的构建
BcAUR1和pYES2载体分别在37 ℃条件下用BamHⅠ和XhoⅠ双酶切4 h,回收目的片段。BcAUR1和pYES2用T4 DNA连接酶在16 ℃连接过夜,载体构建流程见图 1。pYES2-BcAUR1转化大肠杆菌 DH5α,挑取单菌落 (单克隆)扩繁,用碱裂解法提取质粒,并通过 PCR的方法验证,将阳性克隆菌株的pYES2-BcAUR1质粒进行测序,经验证BcAUR1没有突变。
1.6 醋酸锂转化酵母及诱导表达
构建好的pYES2-BcAUR1载体用醋酸锂法[15]转化酿酒酵母 Δyor1,在营养缺陷SC-U培养基上进行筛选,通过PCR和酶切的方法验证。
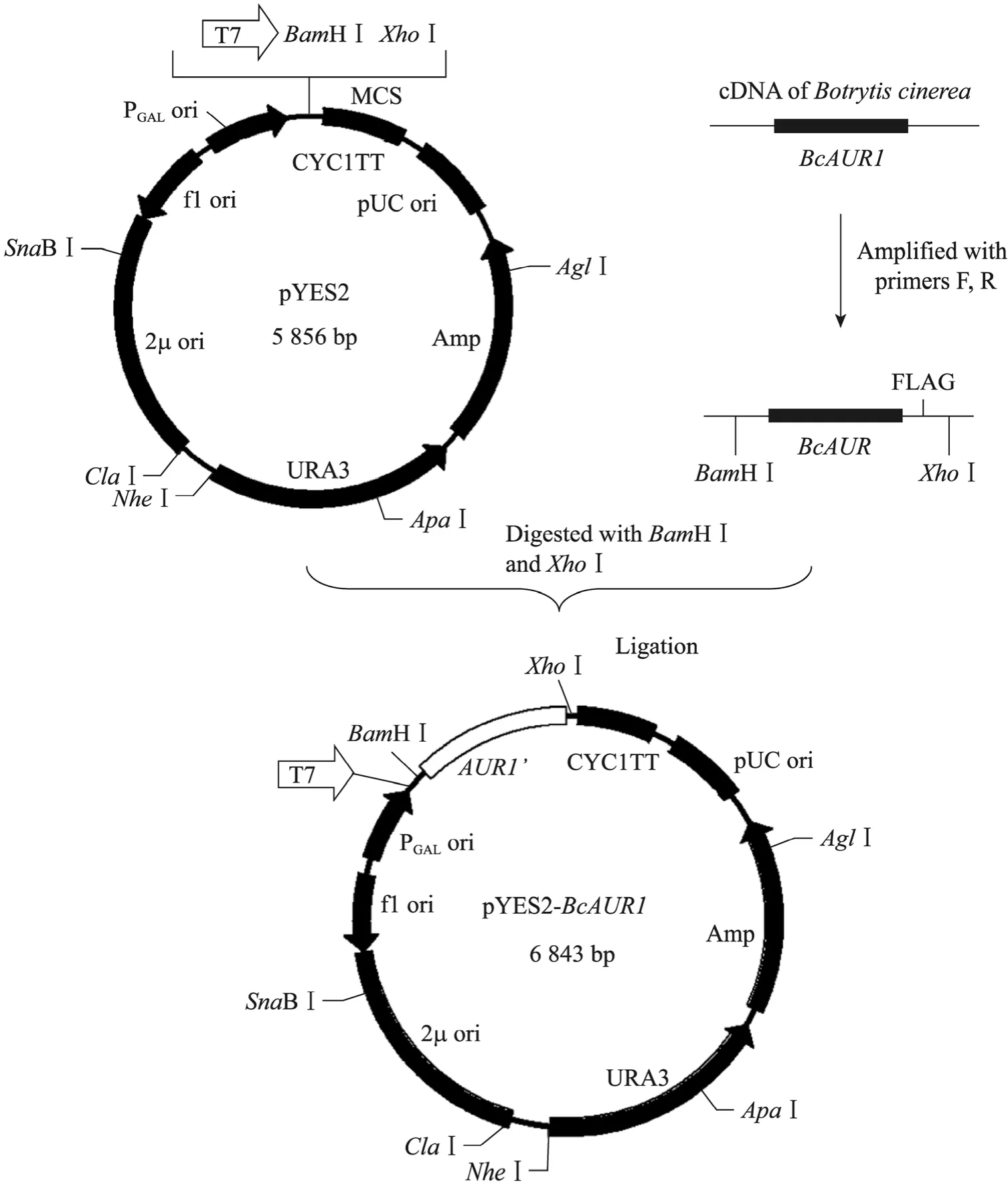
图1 pYES2-BcAUR1载体构建图谱Fig. 1 Map of construction of pYES2-BcAUR1 vector. BcAUR1’ indicates BcAUR1 with FLAG-tag.
挑单克隆至20 mL SC-U培养基中,30 ℃振荡孵育30 h,取5 mL提取mRNA,使用RT-PCR试剂盒 (TaKaRa公司)和正向引物F、反向引物R进行 PCR检测,证明转化后的酵母可以正常转录。将剩余菌液离心除去上清液,用诱导培养基将OD600调整到0.4,然后30 ℃振荡孵育12 h,离心,将酵母转化子转到诱导培养基下诱导12 h,表达目的基因。
1.7 微粒体的提取
参照Burke等方法[16]进行,取5 mL培养液在 4 ℃下 1 500×g 离心 5 min,弃上清。用 500 μL无菌水重悬细胞,离心,弃上清。用玻璃珠裂解法提取酵母的总蛋白,然后100 000×g超速离心1 h,弃上清,沉淀即为微粒体蛋白。
1.8 Western blotting分析
参照Mersich 和Jungbauer的方法[17]进行,将微粒体重新溶解在分析缓冲液中,并进行SDS-PAGE电泳,将蛋白质电转移到硝酸纤维素膜上,置于1%脱脂奶粉封闭缓冲液中,室温封闭2 h。将封闭后的膜浸入1%脱脂奶粉缓冲液稀释的一抗缓冲液中,室温下缓慢摇动1 h;洗膜4次后,将膜浸入用1%脱脂奶粉缓冲液稀释的二抗中,室温下缓慢摇动1 h;洗膜4次后,用滤纸吸干膜表面。使用ECL试剂盒进行显色。
1.9 IPC合成酶活性的测定
IPC合成酶活性的测定参照 Zhong等[18]的方法进行,以 50 mmol/L Tris-HCl (pH 7.0)、10 mmol/L EDTA、150 mmol/L NaCl、10%甘油和2 mmol/L CHAPS配制成反应缓冲液;向反应缓冲液中加入两种底物 C6-NBD-Cer和 PI,C6-NBD-Cer的终浓度为0.1 mmol/L、PI终浓度为 2 mmol/L,最后加入微粒体终浓度为0.1 mg/mL。反应混合液50 μL置于30 ℃水浴中30 min,加入10%的乙酸终止反应。1 000×g离心3 min,取10 μL进行HPLC。色谱条件:C18的反向色谱柱(25 cm×4.6 mm),荧光波长:λex=465 nm,λem=530 nm,流速 1 mL/min,洗脱梯度50% CH3CN-50% H2O (0.1%CH3COOH)到90% CH3CN-10% H2O (0.1% CH3COOH),然后用100% CH3CN洗柱10 min。以荧光底物C6-NBD-Cer的高效液相保留时间 (26 min)为对照,确定产物IPC的保留时间为17 min,根据生成IPC的产物峰面积计算IPC合成酶活力。
1.10 AbA抗性的检测
空载 pYES2酵母转化子和 pYES2-BcAUR1酵母转化子,在AbA浓度分别是0.002、0.005、0.02、0.05、0.2和 0.5 μg/mL的诱导培养基上30 ℃培养4 d,观察菌落生长情况并照相。
2 结果与分析
2.1 AUR1基因的克隆和穿梭表达载体构建
从灰葡萄孢菌中提取总RNA,反转录cDNA后,利用含有FLAG标签以及BamHⅠ、XhoⅠ酶切位点的AUR1特异引物扩增BcAUR1基因,得到1 000 bp左右的电泳条带,该条带与AUR1基因大小一致 (图2),目的条带连接到pMD18-T载体上,进行测序。测序结果表明,灰葡萄孢菌AUR1 (BcAUR1)的cDNA序列与GenBank的序列比较有3个碱基发生变化,但它们未导致氨基酸改变。灰葡萄胞菌IPC合成酶基因由1 135个核苷酸构成,其中117~231位核苷酸序列为115 bp的内含子,IPC合成酶基因编码339个氨基酸。将BcAUR1基因与穿梭质粒pYES2重组,得到pYES2-BcAUR1转化DH5α,挑取阳性克隆菌株,提取 pYES2-BcAUR1质粒进行测序。经验证BcAUR1没有突变后,利用醋酸锂转化法将重组质粒导入酿酒酵母Δyor1中,经营养缺陷培养基筛选,挑取单克隆进行菌落 PCR和酶切鉴定,得到3个pYES2-BcAUR1酵母转化子。

图2 AUR1基因的扩增结果Fig. 2 Amplification of the gene AUR1. M: DNA marker. 1−2: BcAUR1.
2.2 pYES2-BcAUR1诱导表达和 Western blotting鉴定
空载 pYES2酵母转化子和 3个 pYES2-BcAUR1酵母转化子在半乳糖培养基上进行诱导表达,RT-PCR结果表明空载pYES2酵母转化子不表达,3个 pYES2-BcAUR1酵母转化子均有BcAUR1基因表达,说明BcAUR1基因在转录水平表达。Western blotting检测结果也显示空载pYES2酵母转化子不表达 BcAUR1蛋白(AUR1p),而3个pYES2-BcAUR1酵母转化子有BcAUR1蛋白表达,并且BcAUR1蛋白均呈现两条带,推测可能分子量小的是未修饰的AUR1p,分子量大的是修饰后的AUR1p (图3)。
2.3 AbA对菌体生长的影响

图4 在不同ABA浓度下酵母转化子的生长情况Fig. 4 The growing state of the yeast transformants under different concentrations of AbA. A−F: the different concetrtion of AbA 0.002, 0.005, 0.02, 0.05, 0.2, 0.5 μg/mL respectively. 1−2: the yeast transformants without BcAUR1.3−4: the yeast transformants 1 with pYES2-BcAUR1. 5−6: the yeast transformants 2 with pYES2-BcAUR1. 7−8: the yeast transformants 3 with pYES2-BcAUR1.
空载 pYES2酵母转化子和 3个 pYES2-BcAUR1酵母转化子,在不同AbA浓度的诱导培养基上培养 (图4),当AbA浓度达到0.05 μg/mL,空载pYES2酵母转化子不能生长,而3个pYES2-BcAUR1酵母转化子均能生长。当 AbA浓度为0.2 μg/mL时,只有pYES2-BcAUR1酵母转化子3能够生长,pYES2-BcAUR1酵母转化子1和2不能生长。该结果说明AbA浓度为0.05 μg/mL可抑制酵母生长。3个pYES2-BcAUR1酵母转化子的AbA抗性高于空载pYES2酵母转化子,并且pYES2-BcAUR1酵母转化子3抗性较强,这是由于灰葡萄孢菌的 AUR1基因在酵母中表达导致了对AbA抵抗。
2.4 IPC合成酶活性测定
以C6-NBD-Cer (荧光的底物)和PI (磷脂酰肌醇)为底物,加入微粒体 (含IPC合成酶),用高效液相层析荧光光谱检测荧光产物IPC的量,根据生成 IPC的产物峰面积计算 IPC合成酶活力。通过测定空载 pYES2酵母转化子和 3个pYES2-BcAUR1酵母转化子的IPC合成酶活性,表明3个pYES2-BcAUR1酵母转化子IPC合成酶活性高于空载pYES2酵母转化子 (表2),证实了灰葡萄孢菌的 AUR1基因在酵母中表达,pYES2-BcAUR1酵母转化子3酶活性最高,它的 AbA抗性较强,这与上述 pYES2-BcAUR1酵母转化子3在较高AbA浓度下仍能生长结果一致。

表2 IPC合成酶活性测定Table 2 Determination of IPC synthase activity
3 讨论
肌糖磷脂酰神经酰胺 (IPC)合成酶催化鞘脂合成代谢的一个重要反应,即催化神经酰胺和磷脂酰肌醇生成肌糖磷脂酰神经酰胺,在此基础上肌糖磷脂酰神经酰胺进一步形成鞘脂类物质,这些物质广泛参与多种生理过程如细胞的生长、凋亡、分化、衰老等过程。酵母的IPC合成酶是由 401个氨基酸组成的疏水蛋白 (AUR1p或IPC1p),包含几个跨膜域和至少一个糖基化位点[9]。其他真菌如构巢曲霉的IPC合成酶具有与酵母相似的特点和性质[9,13],目前对灰葡萄孢菌IPC合成酶的研究较少,本研究首次在酿酒酵母中表达了灰葡萄孢菌 AUR1基因 (BcAUR1)和IPC1p。Western blotting分析结果显示灰葡萄孢菌的IPC1p有两条带,这可能是由于IPC合成酶糖基化修饰所致[13],因为细胞中翻译和修饰不同步,先合成的AUR1p经加工过程被糖基化,而刚合成出来的AUR1p还未经糖基化修饰。
AbA是一种环九肽抗生素[19],对白假丝酵母 Candida albicans、新型隐球菌 Cryptococcus neoformans、曲霉Aspergillus等病原真菌都有很强的杀菌作用[20]。AbA的杀菌作用很可能是先被细胞吸收,抑制IPC合成酶的活性,使神经酰胺到肌糖磷脂酰神经酰胺的合成受阻,导致鞘磷脂类物质的合成量不足,细胞膜产生断裂,造成细胞内的糖原泄露[21]。已有研究表明 AbA是真菌IPC合成酶的非竞争性抑制剂,AbA可通过抑制IPC合成酶抑制真菌生长[18]。我们的实验也证实了AbA能抑制真菌生长,低浓度的AbA能抑制空载 pYES2酵母转化子,但不影响 pYES2-BcAUR1酵母转化子的生长,并且酵母转化子的平均酶活力高于空载 pYES2酵母转化子,也说明IPC合成酶的高表达能够抵消抑制剂AbA的作用。这是由于抑制剂的浓度不变时,增加酶活力,减轻了抑制剂对酶抑制,因此真菌生长不受影响。pYES2-BcAUR1酵母转化子3在AbA浓度高于空载pYES2酵母转化子4倍时仍能生长,而且酶活力在3个转化子中最高,进一步证实了IPC合成酶活力增加能抵抗AbA对真菌生长的抑制。
本研究在酵母中成功表达了灰葡萄孢菌肌糖磷脂酰神经酰胺合成酶,并且对 AbA影响菌体生长和酶活性进行了初步分析,这对于进一步研究灰葡萄孢菌肌糖磷脂酰神经酰胺合成酶结构与功能具有十分重要的意义。
[1]Hannun YA, Obeid LM. Principles of bioactive lipid signalling: lessons from sphingolipids. Nat Rev Mol Cell Biol, 2008, 9(2): 139−150.
[2]Colombaioni L, Garcia-Gil M. Sphingolipid metabolites in neural signalling and function. Brain Res Rev, 2004, 46(3): 328−355.
[3]Dickson RC, Lester RL. Shpingolipid functions in Saccharomyces cerebisiae. Biochim Biophys Acta,2002, 1583(1): 13−25.
[4]Dickson RC, Sumanasekera C, Lester RL.Functions and metabolism of sphingolipids in Saccharomyces cerevisiae. Prog Lipid Res, 2006,45(6): 447−465.
[5]Obeid LM, Okamoto Y, Mao C. Yeast sphingolipids: metabolism and biology. Biochim Biophys Acta, 2002, 1585(2/3): 163−171.
[6]Mina JG, Pan SY, Wansadhipathi NK, et al. The Trypanosoma brucei sphingolipid synthase, an essential enzyme and drug target. Mol Biochem Parasitol, 2009, 168(1): 16−23.
[7]Amselem J, Cuomo CA, van Kan JA, et al.Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea. PLoS Genet, 2011, 7(8): e1002230.
[8]Heidler SA, Radding JA. Inositol phosphoryl transferases from human pathogenic fungi. Biochim Biophys Acta, 2000, 1500(1): 147−152.
[9]Kuroda M, Hashida-Okado T, Yasumoto R, et al.An aureobasidin A resistance gene isolated from Aspergillus is a homolog of yeast AUR1, a gene responsible for inositol phosphorylceramide (IPC)synthase activity. Mol Gen Genet, 1999, 261(2):290−296.
[10]Cerantola V, Guillas I, Roubaty C, et al.Aureobasidin A arrests growth of yeast cells through both ceramide intoxication and deprivation of essential inositol phosphoryl ceramides. Mol Microbiol, 2009, 71(6): 1523−1537.
[11]Venable ME, Webb-FroehIich LM, Sloan EF, et al.Shift in sphingolipid metabolism leads to an accumulation of ceramide in senescence. Mech Ageing Dev, 2006, 127(5): 473−480.
[12]Kim HJ, Oh JE, Kim SW, et al. Ceramide induces p38 MAPK-dependent apoptosis and Bax translocation via inhibition of Akt in HL-60 cells.Cancer Lett, 2008, 260(1/2): 88−95.
[13]Hashida-Okado T, Ogawa A, Endo M, et al. AUR1,a novel gene conferring aureobasidin resistance on Saccharomyces cerevisiae: a study of defective morphologies in Aur1p-depleted cells. Mol Gen Genet, 1996, 251(2): 236−244.
[14]Endo M, Takesako K, Kato I, et al. Fungicidal action of aureobasidin A, a cyclic depsipeptide antifungal antibiotic, against Saccharomyces cerevisiae. Antimicrob Agents Chemother, 1997,41(3): 672−676.
[15]Gietz RD, Woods RA. Transformation of yeast by the LiAc/SS carrier DNA/PEG method. Methods Mol Biol, 2006, 313: 107−120.
[16]Burke D, Dawson D, Stearns T. Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual. New York: Cold Spring Harbor Laboratory Press, 2000.
[17]Mersich C, Jungbauer A. Generic method for quantification of FLAG-tagged fusion proteins by a real time biosensor. J Biochem Bioph Methods,2007, 70(4): 555−563.
[18]Zhong WY, Murphy DJ, Georgopapadakou NH.Inhibition of yeast inositol phosphorylceramide synthase by aureobasidin A measured by a fluorometric assay. FEBS Lett, 1999, 463(3):241−244.
[19]Shimizu T, Kinoshita H, Nihira T. Development of transformation system in Monascus purpureus using an autonomous replication vector with aureobasidin A resistance gene. Biotechnol Lett,2006, 28(2): 115−120.
[20]Denny PW, Shams-Eldin H, Price HP, et al. The protozoan inositol phosphorylceramide synthase: a novel drug target that defines a new class of sphingolipid synthase. J Biol Chem, 2006, 281(1):28200−28209.
[21]Liu XP. Inhibition effect of postharvest pathogens fungi of fruit by aureobasidin A [D]. Xinjiang:Xinjiang University, 2010.刘小平. 短梗霉素A对水果产后病原真菌的抑制作用[D]. 新疆: 新疆大学, 2010.
