血卵涡鞭虫核糖体18S rDNA和ITS1-5.8S rDNA-ITS2序列测定与系统发育分析
2013-11-05谢建军王庚申许文军
施 慧 谢建军 王庚申 许文军
(浙江省海洋水产研究所, 浙江海洋学院海洋与渔业研究所, 浙江省海水增养殖重点实验室, 舟山 316100)
血卵涡鞭虫是一类寄生性的原生动物, 是近年来引起三疣梭子蟹(Portunus trituberculatus)、“牛奶病”及锯缘青蟹(Scylla serrata)“黄水病”的一种主要病原, 该虫对宿主感染时间长, 流行范围广、发病率、死亡率较高, 危害严重, 给梭子蟹和青蟹的养殖业造成了巨大的经济损失。近年来国内已对该寄生虫病原的生活史、形态学特征、感染途径、诊断及防治技术等方面进行了一些初步研究工作,积累了一定的基础信息[1]。
20世纪 90年代以来, 随着分子标记技术的发展,DNA分子技术日益成为区分物种的有效手段。目前应用于寄生虫分类鉴定和系统发生学研究的DNA基因主要是核糖体18S rRNA和ITS基因。由于18S rDNA基因在生物进化过程中具有高度保守性, 近年来国外学者根据18S rDNA基因序列设计引物, 运用于寄生虫分子生物学鉴定[2—4]。ITS区域受外界环境因素的影响较小, 所受选择压力小, 区域序列的进化速度较其他区域快, 具有高变异性, 在物种间表现出极为广泛的序列多态性, 可以从中获得大量的遗传信息, 目前 ITS序列作为非常有价值的遗传标记被广泛应用于寄生虫学的分类鉴定上。本研究开展了血卵涡鞭虫18S rDNA基因和ITS1-5.8S rDNA-ITS2基因序列的扩增和测定, 经与 GenBank中相关序列多态性比对分析, 构建了血卵涡鞭虫18S rDNA分子系统发育树, 同时对不同宿主来源虫体的18S rDNA 和ITS1进行了同源性分析, 从DNA水平探讨了该寄生原虫的分类地位, 为我国血卵涡鞭虫病的分子流行病学提供一定的理论依据。
1 材料与方法
1.1 血卵涡鞭虫样本
初步诊断为血卵涡鞭虫感染的病蟹来源于浙江舟山佛渡乡养殖的三疣梭子蟹和浙江三门养殖的锯缘青蟹,取血淋巴, 用 95%乙醇固定, 本实验室保存, 编号为:ZHSH2006-1和ZHSH2006-2。
1.2 主要试剂
总基因组DNA提取试剂盒为Qiagen公司产品, Taq酶、dNTPs、DNA纯化试剂盒均为宝生物工程(大连)有限公司产品。
1.3 血卵涡鞭虫的PCR扩增鉴定
将固定的病蟹血淋巴样品, 按Qiagen DNA zsol kit说明书提取总基因组 DNA, 用已建立的针对血卵涡鞭虫的PCR快速诊断方法进行PCR扩增鉴定[8]。
1.4 病原18S rDNA和ITS1-5.8S-ITS2序列扩增
根据文献[5—7]设计了两对引物, 引物由生工(上海)生物工程有限公司合成, 引物序列(表1)。

表1 血卵涡鞭虫PCR扩增用引物Tab.1 Nucleotide sequence of primers for Hematodinium sp.
18S rDNA的扩增选择真核生物18S rDNA通用扩增引物EukA和EukB, PCR 反应条件为94℃预变性5min;94℃ 45s, 55℃ 1min, 72℃ 3min, 共 30个循环, 最后 72℃延伸10min。ITS1-5.8S-ITS2区域扩增选择真核生物ITS通用扩增引物 ITS1和 ITS4, PCR反应条件为 95℃变性5min; 然后 94℃ 45s, 52℃ 45s, 72℃ 45s, 30个循环后, 于72℃延伸10min。PCR 反应体系均为25 μL, 其中超纯水19.25 μL, 10× Reaction buffer 2.5 μL, 引物(50 pmol/L) 0.5 μL,dNTP (10 mmol/L) 0.5 μL, 模板 2.5 μL, Taq 酶 0.25 μL。PCR产物经UNIQ-10 柱式胶回收试剂盒纯化后, 寄生工(上海)生物工程有限公司进行序列测定。
1.5 18S rDNA和ITS1序列分析
利用NCBI在线BLAST程序, 对本次获取的基因序列进行比对分析。将获取的18S rDNA和ITS1基因序列用DNAMAN软件进行排序、比对并辅以人工校正, 同时应用NCBI中在线软件BLAST对获得的基因序列进行同源检索。从 GenBank中取得相关血卵涡鞭虫类的序列作参考(表2), 使用MEGA 3.1分析软件, Kimura-2法计算遗传距离, 并采用bootstrap(重复次数1000)检查聚类树各分支置信度, 邻接法(Neighbor Joining, NJ)构建分子发育树。
2 结果
2.1 病蟹血淋巴液显微镜检
病蟹血淋巴中的无颗粒细胞、小颗粒细胞和颗粒细胞3种血淋巴细胞的量较正常蟹的急剧下降, 代之以大量寄生原虫。从不同病蟹的血淋巴液中可观察到不同发育阶段的虫体, 多数呈卵圆型, 单核或多核, 大小约 5—10 μm不等, 仔细观察, 有些可见2根长度不等的鞭毛(图1)。
2.2 血卵涡鞭虫的PCR鉴定结果
以提取的总基因组为模板, 用血卵涡鞭虫的特异性引物从实验样本中成功扩增出 580 bp左右的特异条带,其琼脂糖凝胶电泳结果(图2)。
2.3 血卵涡鞭虫的rDNA基因序列比较分析
两株虫体的 rDNA基因序列与血卵涡鞭虫属的序列同源性最高, 经比对ZHSH2006-1和ZHSH2006-2的18S rDNA基因序列同源性为99.55%, 两者与 GenBank中登录的 FJ834441的同源性为 99.5%。上述结果表明, 所获的序列确属拟测定的目标片段。从 GenBank中下载来源于海水和海水甲壳类的腰鞭毛虫相关序列, 用 MEGA3.1软件建立系统进化树(图 3)。从进化树可见, 所有收集的血卵涡鞭虫都起源于共同的祖先, 所有序列分为两个集群, 血卵涡鞭虫与其他Syndinida目的虫体处于同一集群中, 又与 8株来自不同十足目的血卵涡鞭虫聚为 Hema-todinium sp.分支, 同时显示与分离自 Liocarcinus depurator和蓝蟹(Callinectes sapidus)的血卵涡鞭虫亲缘关系更加密切。

表2 血卵涡鞭虫核糖体18S rDNA和ITS1基因序列来源Tab. 2 Origins of 18S rDNA and ITS1 gene sequences of Hematodinium ribosome

图1 发病蟹血淋巴中的血卵涡鞭虫 (1000×)Fig. 1 Hematodinium sp. from hemolymph of diseased crab
本次获得的 ZHSH 2006-1株和 ZHSH2006-2株 ITS1-5.8S-ITS2基因片段同源性为 100%, 大小为888 bp, 包括全部ITS1(344 bp)、5.8S rDNA(150 bp)和ITS2(394 bp)(GenBank登录号: JQ692310、JQ928405)。将获得的 18S rDNA和ITS1部分基因分别与GenBank中已有血卵涡鞭虫的相应序列用 DNAStar软件进行比较分析。从18S rDNA同源性分析来看, 不同宿主来源虫体之间差异很小, 虫株ZHSH2006-1和ZHSH2006-2的18S rDNA序列与其他血卵涡鞭虫的18S rDNA序列同源性达99.2%以上(表3); 但不同宿主来源虫体ITS1进化速度较快, 获得的ITS1序列与其他登录的序列比对有明显差异, 同源性高低不等(表 4)。而获得的 5.8S rDNA-ITS2 基因序列在 GenBank中未找到相关的序列(图4)。

图2 血卵涡鞭虫 PCR扩增产物琼脂糖电泳结果Fig. 2 Sensitivity of PCR assay for detection of Hematodinium sp.
3 讨论
血卵涡鞭虫(Hematodinium)隶属于植鞭动物门(phylum Sarcomastigophora)、腰鞭虫纲(order DinoflagelIida)、Syndiniceae科、Syndinida目、血卵涡鞭虫属。自1931年Chatton, et al.[9]首次报道法国沿岸绿蟹的血卵涡鞭虫(Hematodinium perezi)感染以来, 至今国外许多地区包括澳大利亚、阿拉斯加、苏格兰、加拿大以及美国东部沿岸等地均发现和报道了该寄生虫病的流行, 该病的流行已威胁到挪威龙虾(Nephrops norvegicus)、蓝蟹、白氏雪蟹(Chionoecetes bairdi)以及蛛雪蟹(Chionoecetes opilio)等许多重要经济甲壳类的渔业生产[10—18]。目前国外有不少来自十足目种类血卵涡鞭虫基因片段的 18S rDNA 核酸序列已经确定[19—21], 但目前这部分工作尚不完善。国内自2006年首次报道养殖梭子蟹血卵涡鞭虫感染以来, 已相继在锯缘青蟹、日本 蟳和脊尾白虾中发现该寄生虫感染, 但目前为止还没有血卵涡鞭虫18S rDNA核酸全序列的报道, ITS区域也只对部分的ITS1序列进行了比对分析[22]。
ITS是核糖体DNA(rDNA)中介于18S和28S之间的内转录间隔区, 包括 ITS1和 ITS2两段序列, 分别位于18S—5.8S和5.8S—28S之间。尽管ITS序列的非编码区(ITS1和 ITS2)生物学功能目前还不是很清楚, 但越来越多的证据表明, 这 2个高度可变的区域在核糖体进化中起着重要作用[23]。虽然ITS区碱基数少, rRNA转录复杂,但他们没有翻译成有功能的蛋白质序列, 并因此进化速度较快, 具有种内变异小而种间变异大的特性。许多研究表明, ITS序列是研究寄生虫分类鉴定及遗传变异的理想标记[24]。目前认为18S rDNA序列这类高度保守区域可以用来进行高级类群间系统进化的比较分析, 而 ITS更适合于解决较低分类群如种间或种内不同株差异的问题。周荣琼等[25]利用ITS1序列测定及分析发现ITS1片段可作为隐孢子虫属的种间鉴定种的遗传标记。
本研究对血卵涡鞭虫的18S rDNA和ITS序列的比对分析显示, 属内18S rDNA进化保守, 序列高度同源, 不同宿主来源血卵涡鞭虫的同源性高达99.2%。获得的两株血卵涡鞭虫宿主分别是三疣梭子蟹和锯缘青蟹, 其 18S rDNA基因序列之间同源性高达 99.6%, 说明 18S rDNA序列可以用于血卵涡鞭虫系统进化分析。将 GenBank中相关 ITS序列进行比对分析时发现, 所获的两个ITS1序列与 GenBank中相关 ITS1序列的同源性最高在 97.7%,最低为21.2%, 这说明感染我国梭子蟹和青蟹的血卵涡鞭虫与国外分离获得的血卵涡鞭虫属于不同基因型。同时分析结果也显示, 来源于不同宿主的血卵涡鞭虫的 ITS1高度特异。但获得的两株虫体的ITS1序列之间同源性很高,达 100%, 这可能与宿主所处的地理位置有一定关系。Small, et al.[26]对分离自不同十足目的血卵涡鞭虫ITS1序列测定及分析发现不同海域来源的血卵涡鞭虫ITS1区核酸存在一定差异。另外ITS1分析结果也显示分离自三疣梭子蟹和青蟹的血卵涡鞭虫与国外分离自蓝蟹和Liocarcinus depurator的血卵涡鞭虫的ITS1序列同源性要明显高于其他株系, 达 94%以上, 这可能与寄生的宿主有关, 蓝蟹和Liocarcinus depurator与我国三疣梭子蟹及锯缘青蟹虽然所产地理位置不同但都属于梭子蟹科。本文根据以上结果初步确定血卵涡鞭虫ITS1区核酸更适用于血卵涡鞭虫属内的分类学研究。目前国际上关于血卵涡鞭虫ITS序列信息不及18S rDNA序列丰富, 本研究未根据获得的 ITS区域构建血卵涡鞭虫系统进化树。GenBank中相关ITS2基因序列信息不全, 本文也未能对ITS2序列进行比对分析, ITS1与ITS2在血卵涡鞭虫虫株进化过程中所起的作用是否一致, 还有待进一步探讨。

图3 采用N-J法根据腰鞭毛虫类18S rDNA基因序列构建的系统发育树Fig. 3 The phylogenetic tree of dinoflagellata -like organism based on 18S rDNA gene using the Neighbor-Joining method
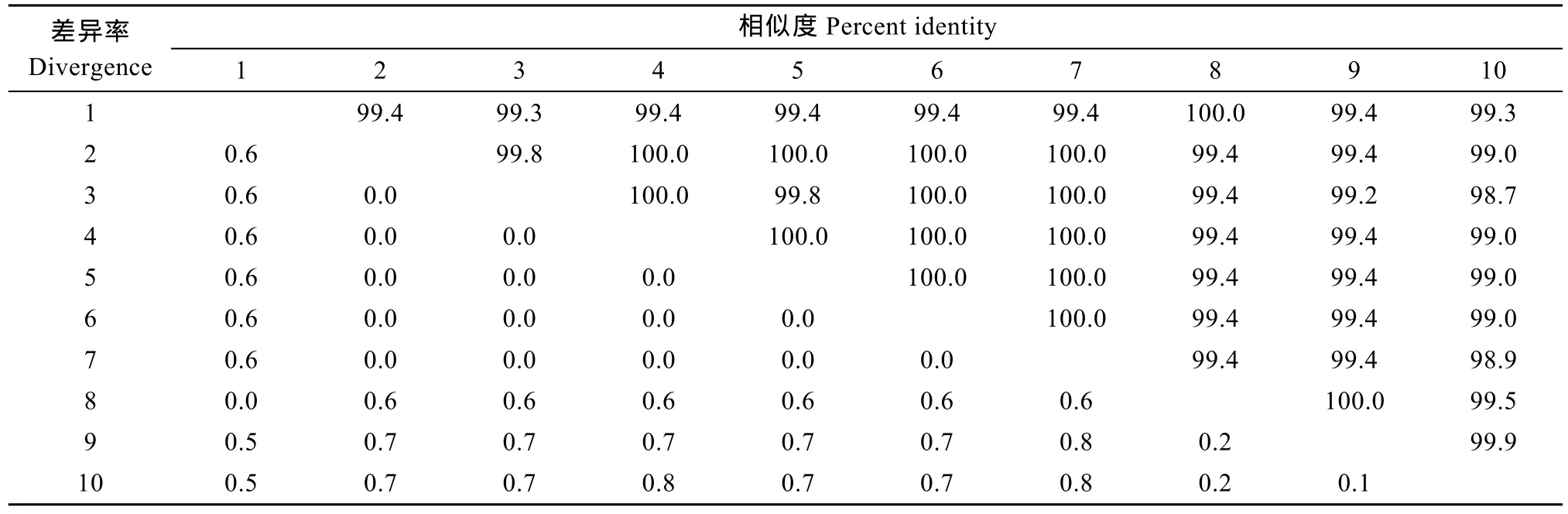
表3 血卵涡鞭虫种内虫株的18S rDNA序列同源性比较分析Tab. 3 Analysis of 18S rDNA sequence similarity between Hematodiniums

表4 血卵涡鞭虫种内虫株的ITS1全长序列之间同源性比较分析Tab. 4 Analysis of full-length ITS1 sequence similarity between Hematodiniums

图4 ZHSH2006-1株和ZHSH2006-2株5.8S rDNA -ITS2序列Fig. 4 5.8S rDNA-ITS2 gene sequence of ZHSH2006-1and ZHSH2006-2 5.8S rDNA: 150 bp; ITS2: 394 bp
