FHL1在香烟烟雾刺激的大鼠肺动脉平滑肌细胞增殖与迁移中的作用*
2013-10-24蒲桂梅李玉苹陈成水
蒲桂梅, 杨 莉, 李玉苹△, 陈成水, 蒋 磊
(温州医学院附属第一医院 1呼吸内科, 2龙湾内科实验室,浙江 温州 325000)
FHL1在香烟烟雾刺激的大鼠肺动脉平滑肌细胞增殖与迁移中的作用*
蒲桂梅1, 杨 莉1, 李玉苹1△, 陈成水1, 蒋 磊2
(温州医学院附属第一医院1呼吸内科,2龙湾内科实验室,浙江 温州 325000)
目的研究FHL1 (four-and-a-half LIM domain 1)在香烟烟雾提取物(CSE)刺激的大鼠远端肺动脉平滑肌细胞(PASMCs)增殖及迁移中的作用。方法原代培养PASMCs,分别予CSE及FHL1 siRNA转染干预,分为6组:空白组、阴性转染组、FHL1 siRNA转染组、CSE组、CSE+阴性转染组和CSE+FHL1 siRNA转染组。Real-time PCR法检测FHL1 mRNA的表达,Western blotting法检测FHL1 蛋白,CCK-8法检测细胞增殖,Transwell 法测定细胞迁移。结果CSE刺激导致PASMCs增殖、迁移及FHL1蛋白表达增加 (P<0.01) ,但FHL1 mRNA的表达无明显改变(P>0.05)。FHL1 siRNA转染PASMCs,可降低CSE所致的PASMCs增殖及迁移(P<0.01)。结论CSE可促进PASMCs增殖与迁移以及FHL1蛋白的表达, 抑制FHL1蛋白的表达可减弱CSE对PASMCs增殖和迁移的作用。这些结果表明CSE促进PASMCs增殖和迁移与FHL1蛋白有关。
FHL1蛋白; 吸烟; 肺动脉平滑肌细胞
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)相关的肺动脉高压不仅由慢性低氧导致的血管收缩所引起,肺血管重塑、心脏并发症以及肺实质的损伤也都共同参与了肺动脉高压的形成[1]。香烟烟雾暴露是COPD发生的重要危险因素。近年来,研究发现香烟烟雾暴露可以导致肺血管功能障碍和血管重塑[2-3],进而与COPD肺动脉高压的形成密切相关。香烟烟雾暴露的血管重塑主要表现为血管平滑肌细胞的增殖和迁移[2]。
FHL1(four-and-a-half LIM domain 1)存在于多种组织中,与人类特发性肺动脉高压、动脉夹层、肥厚型心肌病、骨骼肌肌病以及肿瘤的发生发展相关[4-8]。Kwapiszewska等[4]研究发现在低氧和野百合碱所致的肺动脉高压大鼠中,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)增殖和迁移增加的同时FHL1蛋白表达增加; 用FHL1 siRNA干预人原代PASMCs,可导致FHL1蛋白表达降低伴PASMCs增殖和迁移减弱;而在FHL1过表达的原代PASMCs中,其增殖和迁移明显增加。然而,FHL1在香烟烟雾提取物(cigarette smoke extract, CSE)刺激引起的PASMCs增殖和迁移中会有何作用尚缺乏研究。本文就以此为切入点进行如下研究。
材 料 和 方 法
1动物与材料
清洁级雄性SD大鼠(约200 g),购自温州医学院动物实验中心,并通过动物实验伦理审查同意。PBS、胶原酶I、胎牛血清和DMEM液均为Gibco产品。兔抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体和小鼠抗大鼠FHL1单克隆抗体购自Abcam,小鼠抗大鼠β-actin抗体购自北京中杉,山羊抗兔Ⅱ抗和山羊抗小鼠Ⅱ抗均购自EarthOx。红双喜香烟(含焦油量13 mg,烟气烟碱量1.2 mg,烟气一氧化碳量14 mg)由上海卷烟厂生产。阴性siRNA序列(UUCUCCGAACGUGUCACGUTT)和FHL1 siRNA序列(UGCCAAGCAUUGCGUGAAA和CUAAGGAGG UGGACAUAA)由上海吉玛公司合成。Lipofectamine RNAiMAX和SYBR Green试剂盒购自ABI。FHL1引物(上游5’-GTG CCC TTG TAC TCC ACG TT-3’,下游5’-GTG TCC AAG GAT GGC AAG AT-3’)和内参照GAPDH引物(上游5’-ATG AGC CCC AGC CTT CTC CAT-3’ , 下游5’-GGT CGG AGT CAA CGG ATT TG-3’)由上海生工生物工程公司合成。细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁公司。Transwell板购自Corning。
2大鼠远端PASMCs原代培养及鉴定
参照文献[9]并稍作修改,超净台内用纤维器械在PBS中取肺动脉3级以下分支,刮除外膜及内膜,胶原酶I消化法分离PASMCs。将消化的细胞装入含10%胎牛血清DMEM液的培养瓶,并置于37 ℃、5%CO2培养箱中培养。通过细胞形态学、α-SMA免疫荧光法及免疫细胞化学法(1∶1 000)鉴定。原代培养至3~6代的PASMCs用于实验,调整细胞浓度为5×107/L。分别予CSE及FHL1 siRNA转染干预,分为6组:空白组、阴性转染组、FHL1 siRNA转染组、CSE组、CSE+阴性转染组及CSE+FHL1 siRNA转染组。
3CSE制备及干预
CSE制备参照文献[10]并作适当修改。将去除过滤嘴的香烟点燃,负压吸引香烟烟雾至装有DMEM液的密闭玻璃瓶中,轻轻摇晃使其溶解,氢氧化钠溶液调节pH值至7.4,超净台内过滤除菌,即为CSE原液。使用时,根据实验所需不同浓度,用含10%胎牛血清的DMEM液稀释CSE原液,30 min内用于实验。
4FHL1siRNA转染
Lipofectamine RNAiMAX转染试剂瞬时转染FHL1 siRNA至PASMCs,抑制FHL1 mRNA表达。3~6代的原代细胞悬液,每孔0.5 mL接种于24孔板,细胞在无双抗的培养液中培养24 h后进行转染。据Lipofectamine RNAiMAX产品说明操作,siRNA和Lipofectamine RNAiMAX用DMEM液稀释后混合放置15~20 min用于转染,经再培养48 h后提取细胞总RNA,72 h后提取细胞总蛋白。
5Real-timePCR法检测FHL1mRNA
体系配制参照SYBR Green试剂盒说明进行,选用GAPDH作为内参照。反应条件设置为:50 ℃ 2 min(1个循环);95 ℃ 10 min(1个循环);95 ℃ 15 s、60 ℃ 1 min(40个循环);95 ℃ 15 s、60 ℃ 20 s、95 ℃ 15 s、60 ℃ 15 s(1个循环)。数据采用 2-ΔΔCt法进行统计分析。
6Westernblotting法检测FHL1蛋白
3~6代的原代细胞悬液,每孔2 mL接种于6孔板,实验干预后,继续培养72 h后提取每组总蛋白。经浓度测定及标化后,取每组相同蛋白上样量经缓冲液稀释,先后进行电泳和转膜。转至PVDF膜上的蛋白,用含5 %脱脂牛奶的TBST溶液封闭2 h,再用小鼠抗大鼠FHL1单克隆抗体(1∶1 000)于4 ℃孵育过夜,内参照选用β-actin(1∶1 000)。次日, TBST溶液洗涤Ⅰ抗后,常温下山羊抗小鼠Ⅱ抗孵育1 h, TBST溶液洗涤Ⅱ抗后, ECL发光试剂盒发光,暗室显影定影,条带扫描后行灰度分析。
7CCK8法检测细胞增殖
3~6代的原代细胞悬液,每孔0.1 mL接种于96孔板,每组设3个复孔,待长至50%~70%融合时进行干预,后继续培养24 h,每孔加10 μL CCK-8,置入37 ℃、含5 %CO2的培养箱中培养0.5~2 h,450 nm波长下检测吸光度(A)。
8Transwell法测定细胞迁移
3~6代的原代细胞悬液,每孔0.5 mL接种于24孔板,干预后继续培养24 h,胰酶消化,细胞计数,调整细胞浓度为2×108/L,每孔0.1 mL的只含DMEM培养液的细胞悬液转移到小室中,下室每孔加0.5 mL含10 %胎牛血清的DMEM液。继续培养24 h后,甲醛固定、结晶紫染色后擦去小室上层细胞,显微镜下计数小室下层细胞,每个小室随机取5个视野计数用于统计分析。
9统计学处理
数据采用SPSS 20.0统计软件分析,数据以均数±标准差(mean±SD)表示,进行方差齐性及正态性检验。多组间差异的显著性检验采用单因素方差分析,多组内两两比较采用LSD检验。两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1大鼠远端肺动脉平滑肌细胞鉴定
PASMCs在倒置显微镜下观察形态呈梭形、三角形等,见图1。PASMCs经免疫细胞化学染色,DAB显色,有97%的细胞浆中可见与细胞长轴平行的棕黄色肌丝,即α-SMA,见图2。PASMCs免疫荧光染色,可见胞浆被FITC标记的荧光Ⅱ抗染成绿色,胞核被DAPI染成蓝色,见图3。上述结果证实实验成功培养PASMCs。

Figure 1. Morphology of rat distal pulmonary arterial smooth muscle cells(×100).
图1大鼠远端肺动脉平滑肌细胞形态学观察

Figure 2. α-SMA immunocytochemistry (A,×100; B,×1 000).
图2α-SMA免疫细胞化学染色
2FHL1siRNA转染效能检测
PASMCs经FHL1 siRNA转染后, FHL1 mRNA表达(5.277±0.918)与阴性转染组(33.198±10.730)相比差异有统计学意义(P<0.01),见图4A。FHL1 siRNA转染组较阴性转染组FHL1蛋白表达明显降低(P<0.01),见图4B。这些结果证实实验成功进行FHL1 siRNA转染。

Figure 3. α-SMA immunofluorescence staining of rat pulmonary arterial smooth muscle cells (×400).
图3大鼠肺动脉平滑肌细胞α-SMA免疫荧光染色

Figure 4. FHL1 mRNA (A) and protein (B) expression in PASMCs afterFHL1 siRNA transfection. 1: blank control group; 2: negative transfection group; 3: FHL1 siRNA transfection group.Mean±SD.n=3.**P<0.01vs2.
图4FHL1siRNA转染后肺动脉平滑肌细胞中FHL1mRNA和蛋白的表达
3CSE对细胞增殖的影响
不同浓度的CSE对细胞进行干预24 h后,CCK-8法检测细胞增殖,1%、3%、5%、10%和20% CSE组细胞吸光度与0%组相比,差异均有统计学意义(P<0.01),其中5%CSE对PASMCs增殖影响最明显,见图5。因此本实验选用5%作为CSE干预PASMCs的浓度。
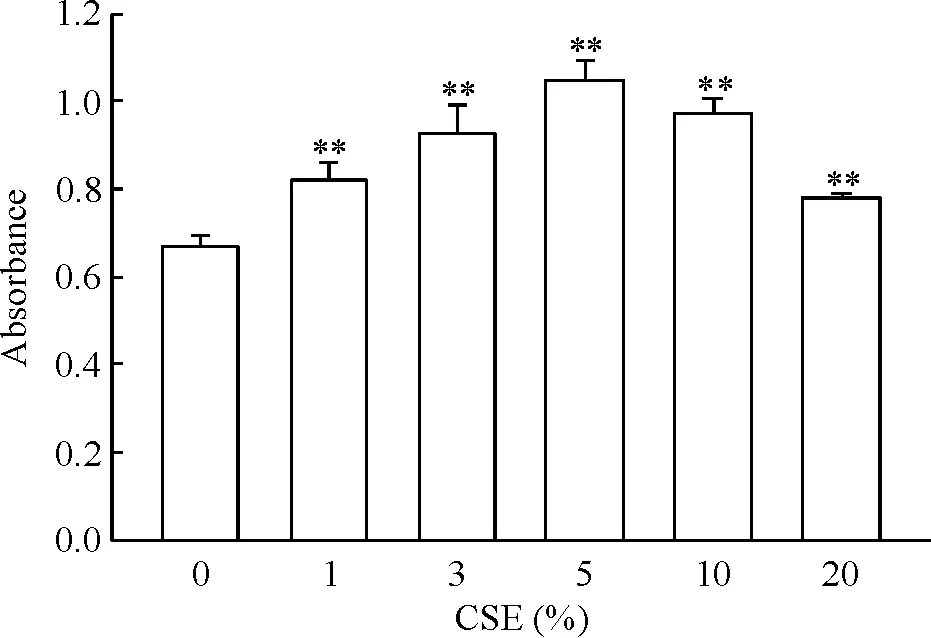
Figure 5. The proliferation of PASMCs after treatment with different concentrations of CSE. Mean±SD.n=4.**P<0.01vs0% CSE.
图5不同浓度CSE干预后肺动脉平滑肌细胞的增殖情况
4CSE对细胞FHL1mRNA和蛋白表达及细胞迁移的影响
CSE组FHL1蛋白表达较空白组明显增加(P<0.01),见图6。但CSE组与空白组FHL1 mRNA差异无统计学意义(79.879±8.669和75.636±5.257,P>0.05)。CSE组细胞迁移较空白组明显增加,见图7。

Figure 6. FHL1 protein expression in PASMCs in blank control and CSE groups. 1: blank control; 2: CSE group.
图6空白组与CSE组肺动脉平滑肌细胞中FHL1蛋白的表达

Figure 7. The migration of PASMCs 24 h after CSE intervention (crystal violet staining,×400). A: blank control group; B: CSE group.
图7CSE干预细胞24h后细胞的迁移
5CSE与FHL1siRNA转染共同干预对PASMCsFHL1蛋白表达及增殖和迁移的影响
CSE+FHL1 siRNA转染组FHL1蛋白表达较CSE组及CSE+阴性转染组明显降低,差异有统计学意义(P<0.01),见图8。CSE+FHL1 siRNA转染组细胞增殖及迁移均较CSE组及CSE+阴性转染组减弱(P<0.01),见表1。

Figure 8. FHL1 protein expression after CSE stimulation andFHL1 siRNA transfection. 1: blank control group; 2: negative transfection group; 3:FHL1 siRNA transfection group; 4: CSE group; 5: CSE + negative transfection group; 6: CSE +FHL1 siRNA transfection group. Mean±SD.n=3.**P<0.01vs1;##P<0.01vs2;△△P<0.01vs4 or 5.
图8CSE及FHL1siRNA转染分别及共同干预后FHL1蛋白的表达
表1各组细胞增殖和迁移结果
Table 1. The proliferation and migration of PASMCs (Mean±SD.n=4)

GroupProliferationMigrationBlankcontrol0.732±0.03323.250±2.986Negativetransfection0.687±0.02823.250±1.708FHL1siRNAtransfection0.547±0.032**##7.250±1.258**##CSE0.950±0.067**35.750±2.062**CSE+negativetransfection0.955±0.079##35.250±2.754##CSE+FHL1siRNAtransfection0.792±0.024△△18.750±3.363△△
**P<0.01vsblank control;##P<0.01vsnegative transfection;△△P<0.01vsCSE or CSE+negative transfection.
讨 论
FHL1蛋白是指含有4个半LIM结构域的蛋白质,是FHL蛋白家族的重要成员之一,它主要参与调节基因转录、细胞增殖、分化以及凋亡[11]。FHL1基因位于人类染色体Xq27 上,编码FHL1蛋白[12]。许多疾病通过FHL1基因的突变引起氨基酸残基结构的改变而影响LIM结构域的稳定性,最终导致疾病的发生发展[7]。早在1994年,就有学者研究发现,含LIM结构域的蛋白在骨骼肌细胞中高表达,并在其生长、分化和迁移中起到非常重要的作用[13]。但是,有关FHL1在血管平滑肌细胞中的作用研究甚少。Weng等[5]在大鼠胸主动脉平滑肌的研究中发现FHL1在人胸主动脉夹层血管平滑肌中表达明显降低,提示FHL1与血管平滑肌功能相关。而本实验发现通过FHL1 siRNA转染,有效减少FHL1 mRNA及FHL1蛋白的表达,可导致PASMCs的增殖和迁移减弱,相似的结果也同样出现于Kwapiszewska 等[4]在人原代肺动脉平滑肌细胞的研究中,说明FHL1与肺动脉平滑肌细胞的增殖和迁移相关。
香烟烟雾暴露与人类多种疾病的发生发展密切相关。本实验发现,CSE干预大鼠远端PASMCs,可导致细胞增殖和迁移能力明显增加。但是随着CSE浓度的提高,其对平滑肌细胞的增殖和迁移作用并没有继续增加。这与Hu等[14]及Silva等[15]的发现一致。因此,本实验最终选定5%CSE用于实验的干预,这与诸多国内外学者在细胞及动物实验中选用的CSE浓度是一致的。CSE组平滑肌细胞增殖和迁移均较空白组明显增高。由于肺血管重塑主要表现为血管壁平滑肌细胞的重新排列和增生改变,因此我们认为CSE所导致的肺动脉平滑肌细胞增殖和迁移与肺血管重塑密切相关。
本实验还发现,CSE导致PASMCs增殖及迁移增加,伴FHL1蛋白增加,提示FHL1蛋白与CSE所致的PASMCs增殖和迁移相关。但本实验中,CSE刺激并未导致FHL1 mRNA表达增加,究其原因,可能是CSE导致的FHL1蛋白增加的机制不是通过促进FHL1 mRNA表达,而是通过抑制FHL1蛋白的降解。目前相关研究表明,细胞内蛋白降解主要通过2条途径,即自噬和泛素蛋白酶体系统[16]。后续实验可通过检测以上2条途径中的相关基因来进一步明确CSE导致FHL1蛋白表达增加的机制。
CSE干预初步提示FHL1蛋白与CSE所致PASMCs的增殖及迁移增加有关,因此本实验进一步行FHL1 siRNA干预,发现CSE+FHL1 siRNA转染组与CSE+阴性转染组相比,CSE导致的细胞增殖和迁移作用随着FHL1表达的抑制而减弱了。这进一步证实CSE促进PASMCs增殖和迁移通过FHL1蛋白起作用。这一结果,也为香烟烟雾暴露所致的肺血管重塑和肺动脉高压的分子靶向治疗提供了研究方向。
[1] Orr R, Smith LJ, Cuttica MJ. Pulmonary hypertension in advanced chronic obstructive pulmonary disease[J]. Curr Opin Pulm Med, 2012,18(2):138-143.
[2] Santos S, Peinado VI, Ramirez J, et al. Characterization of pulmonary vascular remodelling in smokers and patients with mild COPD[J]. Eur Respir J, 2002,19(4):632-638.
[3] Seimetz M, Parajuli N, Pichl A, et al. Inducible NOS inhibition reverses tobacco-smoke-induced emphysema and pulmonary hypertension in mice[J]. Cell, 2011, 147(2):293-305.
[4] Kwapiszewska G, Wygrecka M, Marsh LM, et al. Fhl-1, a new key protein in pulmonary hypertension[J]. Circulation, 2008, 118(11):1183-1194.
[5] Weng J, Liao M, Zou S, et al. Downregulation of FHL1 expression in thoracic aortic dissection: implications in aortic wall remodeling and pathogenesis of thoracic aortic dissection[J]. Ann Vasc Surg, 2011, 25(2):240-247.
[6] Gossios TD, Lopes LR, Elliott PM. Left ventricular hypertrophy caused by a novel nonsense mutation in FHL1[J]. Eur J Med Genet, 2013,56(5):251-255.
[7] Cowling BS, Cottle DL, Wilding BR, et al. Four and a half LIM protein 1 gene mutations cause four distinct human myopathies: a comprehensive review of the clinical, histological and pathological features[J]. Neuromuscul Disord, 2011, 21(4):237-251.
[8] Xu Y, Liu Z, Guo K. Expression of FHL1 in gastric can-cer tissue and its correlation with the invasion and metastasis of gastric cancer[J]. Mol Cell Biochem, 2011, 363(1-2):93-99.
[9] 钱国清,王良兴,陈 婵,等. 大鼠细小肺动脉平滑肌细胞原代培养和鉴定方法的研究[J]. 中国应用生理学杂志,2010, 26(1):125-128.
[10] 胡 静,徐永健,张珍祥,等.香烟烟雾提取物通过PKC途径促进大鼠肺动脉平滑肌细胞bFGF表达[J]. 中国病理生理杂志,2008,24(6):1228-1230.
[11] Kadrmas JL, Beckerle MC. The LIM domain: from the cytoskeleton to the nucleus[J]. Nat Rev Mol Cell Biol, 2004, 5(11):920-931.
[12] Lee SM, Li HY, Ng EK, et al. Characterization of a brain-specific nuclear LIM domain protein (FHL1B) which is an alternatively spliced variant of FHL1[J]. Gene, 1999, 237(1):253-263.
[13] Arber S, Halder G, Caroni P. Muscle LIM protein, a novel essential regulator of myogenesis, promotes myogenic diffferiention[J]. Cell, 1994, 79(2):221-231.
[14] Hu J, Xu YJ, Zhang ZX, et al.Effect of cigarette smoke extract on proliferation of rat pulmonary artery smooth muscle cells and the relevant roles of protein kinase C[J]. Chin Med J (Engl), 2007, 120(17):1523-1528.
[15] Silva D, Cáceres M, Arancibia R, et al. Effects of cigarette smoke and nicotine on cell viability, migration and myofibroblastic differentiation[J]. J Periodontal Res, 2012, 47(5):599-607.
[16] 陈 科,程汉华,周荣家.自噬与泛素化蛋白降解途径的分子机制及其功能[J].遗传,2012,34(1):5-18.
EffectsofFHL1onproliferationandmigrationofratpulmonaryarterialsmoothmusclecellsstimulatedbycigarettesmoke
PU Gui-mei1, YANG Li1, LI Yu-ping1, CHEN Cheng-shui1, JIANG Lei2
(1DepartmentofRespiratoryMedicine,2LongwanMedicalLaboratory,theFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:wzliyp@qq.com)
AIM: To explore the role of four-and-a-half LIM domain 1 (FHL1) in the proliferation and migration of rat distal pulmonary arterial smooth muscle cells (PASMCs) stimulated by cigarette smoke extract (CSE).METHODSRat distal PASMCs were isolated and primarily cultured. The cells were divided into 6 groups: blank control group, negative transfection group,FHL1 siRNA transfection group, CSE group, CSE + negative transfection group and CSE +FHL1 siRNA transfection group. The mRNA and protein expression of FHL1 was detected by real-time PCR and Western blotting, respectively. Cell proliferation and migration were determined by CCK-8 and Transwell assays, respectively.RESULTSCSE promoted the proliferation and migration of PASMCs, and increased the expression of FHL1 protein (P<0.01), but did not change the expression of FHL1 mRNA (P>0.05).FHL1 siRNA transfection attenuated the proliferation and migration of PASMCs induced by CSE (P<0.01).CONCLUSIONFHL1 protein is involved in CSE-induced proliferation and migration of rat PASMCs.
FHL1 protein; Smoking; Pulmonary arterial smooth muscle cells
R329.21
A
10.3969/j.issn.1000- 4718.2013.11.024
1000- 4718(2013)11- 2049- 05
2013- 06- 05
2013- 07- 30
浙江省自然科学基金资助项目(No.LQ13H010002);温州市科技计划资助项目(No.Y20100292)
△ 通讯作者 Tel: 0577-55579276; E-mail: wzliyp@qq.com
