促红细胞生成素通过激活ERK和p38 MAPK抑制小鼠骨髓间充质干细胞成脂分化*
2013-10-24刘革修朱锦灿陈小宇祝爱珍刘成成
刘革修, 朱锦灿, 陈小宇, 祝爱珍, 刘成成, 赖 菁
(暨南大学血液病研究所,广东 广州 510632)
促红细胞生成素通过激活ERK和p38 MAPK抑制小鼠骨髓间充质干细胞成脂分化*
刘革修△, 朱锦灿, 陈小宇, 祝爱珍, 刘成成, 赖 菁
(暨南大学血液病研究所,广东 广州 510632)
目的探讨促红细胞生成素(EPO)是否抑制小鼠骨髓间充质干细胞(MSCs)分化为脂肪细胞及其机制。方法分离提取小鼠骨髓MSCs,用3-异丁基-1-甲基黄嘌呤、胰岛素和地塞米松联合诱导成脂分化,实验组加入不同浓度EPO干预,诱导分化第20天油红O染色观察并进行定量分析细胞分化程度;MTT法观察不同浓度EPO对MSCs增殖能力的影响。实时荧光定量PCR检测过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT/增强子结合蛋白α(C/EBPα)、脂肪酸结合蛋白4(FABP4)和脂联素mRNA表达水平;Western blotting检测PPARγ及细胞外信号调节激酶(ERK)和 p38丝裂原活化蛋白激酶(p38 MAPK)磷酸化水平。结果诱导分化20 d,EPO能显著抑制MSCs的成脂分化,降低油红O染色后的吸光度值,诱导分化过程中各浓度的EPO不影响MSCs增殖活性。EPO能够下调成脂过程中PPARγ、C/EBPα、FABP4和脂联素mRNA表达,增加分化过程中ERK、p38 MAPK及PPARγ蛋白磷酸化。结论EPO可能通过增加p38 MAPK和ERK蛋白磷酸化,下调PPARγ、C/EBPα、FABP4和脂联素mRNA表达, 从而抑制MSCs成脂分化。
促红细胞生成素; 间充质干细胞; 信号通路
在哺乳动物体内,促红细胞生成素(erythropoietin,EPO)是一种由肾脏及胎肝产生的糖蛋白。低氧条件下,EPO与其受体(EPO receptor, EPO-R) 结合发挥作用,促进红系祖细胞增殖、分化为成熟红细胞,以增加循环中红细胞数量[1]。目前临床上主要用于治疗外科手术、慢性肾功能衰竭、化疗等所导致的贫血。最近研究表明,EPO-R广泛分布于脾脏、肺、 大脑、 心肌细胞等非造血组织,意味着其具有多种非造血活性[2-3]。EPO对非造血细胞的作用包括促进内皮细胞增殖[4],保护心肌梗死引起的心肌损伤[5], 抑制血管紧张素Ⅱ诱导的心室重塑[6],改善受损神经细胞的恢复[7]。 另外,EPO能够通过减少NF-κB表达,抑制炎症因子,促进骨折愈合[8]。Hojman等[9]还证明EPO能够抑制小鼠高脂饮食导致的体重增加[9],缺乏Epo-R表达的小鼠更易导致肥胖和胰岛素抵抗,并且通过细胞实验证实了EPO能直接抑制3T3-L1前体脂肪细胞的分化[10],但尚未有研究证实其对骨髓间充质干细胞 (mesenchymal stem cells, MSCs)成脂分化的影响。本研究观察EPO是否抑制小鼠骨髓间充质干细胞分化为脂肪细胞,并对其机制进行初步探讨。
材 料 和 方 法
1材料
6周龄雄性昆明小鼠购自中山大学实验动物中心;DMEM培养基、胰蛋白酶购自HyClone; 重组人促红细胞生成素(rhEPO) 购自沈阳三生制药股份有限公司;胎牛血清、地塞米松、3-异丁基-1-甲基黄嘌呤、胰岛素和油红O染液购自Gibco; 细胞茜素红钙染色试剂盒购自上海杰美基因医药有限公司; 噻唑蓝购自科昊公司; RNAiso Reagent、cDNA 合成试剂盒和RT-PCR试剂盒购自Toyobo; 鼠抗鼠GAPDH多克隆抗体、ECL化学发光液购自联科生物公司;兔抗鼠过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)、p-PPARγ、细胞外信号调节激酶 42(extracellular signal-regulated kinase 42,ERK42)、p-ERK42、ERK44、p-ERK44、p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)和p-p38 MAPK抗体购自Cell Signaling Technology; 辣根过氧化物酶标记抗鼠Ⅱ抗和辣根过氧化物酶标记羊抗兔Ⅱ抗购自Santa Cruz。
2方法
2.1小鼠骨髓间充质干细胞的分离培养 取6周龄雄性昆明小鼠利用颈椎脱臼法处死,75%乙醇浸泡2 min,分离两侧股骨,将骨表面附有的肌肉及肌筋膜等清除干净。将股骨断开, 用1 mL 注射器抽取DMEM完全培养基反复冲洗骨髓腔,直至骨髓腔发白。收集细胞转移至15 mL的离心管中,800 r/min离心5 min,弃上清,再加入培养液重悬细胞,约5×106个细胞接种于25 cm2的培养瓶中,置于37 ℃、5% CO2的培养箱中培养。24 h后换液以去除悬浮细胞及杂质,此后每隔3 d换液1次,显微镜下观察细胞生长状况,直至细胞接近80%汇合时进行传代。取第3代细胞进行MSCs鉴定:成骨分化采用茜素红染色、成脂分化细胞采用油红O染色。
2.2MSCs的成脂诱导分化 取P3代MSCs,培养至完全融合后2 d 开始诱导分化。即用含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、5 mg/L胰岛素、1 μmol/L地塞米松的DMEM完全培养液培养3 d后,再换用含5 mg/L胰岛素的DMEM完全培养液培养1 d。如此循环5个周期,每次换液时根据实验需要加入相应浓度的EPO。
2.3油红O染色 诱导分化20 d后细胞用PBS洗涤3次,4%多聚甲醛固定30 min,油红O染液室温孵育60 min, 然后用PBS漂洗3次, 倒置显微镜下观察脂滴形成情况。用异丙醇萃取油红O, 5 min后通过酶标仪测量520 nm处的吸光度值。
2.4MTT检测细胞增殖活性 将MSCs以5×104well的密度接种于96孔板,用成脂诱导分化液培养,加入不同浓度EPO(0、0.1、1、5、10 kU/L)的培养液培养72 h。每孔加入5 g/L MTT 工作液20 μL,于37 ℃培养箱继续孵育4 h,每孔加入150 μL二甲基亚砜, 振荡5 min后在酶标仪上测量490 nm处的吸光度。
2.5实时荧光定量PCR检测成脂分化基因的表达 收集各组成脂诱导分化细胞,用Trizol试剂提取总RNA, 反转录合成cDNA后,采用实时荧光定量PCR 法检测成脂相关基因mRNA表达,荧光定量PCR 引物见表1。PCR反应条件为预变性93 ℃ 3 min,93 ℃ 1 min,60 ℃ 30 s,72 ℃ 1 min,最后72 ℃ 10 min,共45个循环。GAPDH作为内参照,分别计算各组2-ΔΔCt,用以表示PPARγ、CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein α,C/EBPα)、脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)和脂联素mRNA 相对表达量。
2.6Western blotting 收集各组成脂诱导分化细胞,PBS漂洗2遍,细胞裂解液4 ℃裂解细胞30 min,12 000 r/min 4 ℃离心10 min,BCA蛋白浓度测定试剂检测蛋白含量。取30 μg蛋白样品加上样缓冲液煮沸变性后,经10% SDS-PAGE分离后,转移到PVDF膜上, 含5%脱脂奶粉室温封闭1 h。Ⅰ抗孵育, 于4 ℃过夜,用TBST洗膜3次,加入Ⅱ抗室温孵育1 h后,再用TBST洗膜3次,ECL化学发光显影。
表1实时荧光定量PCR的引物序列
Table 1. The primer sequences for real-time fluorescence quantitative PCR analysis

NamePrimersequence(5’-3’)GAPDHForward:AGGTCGGTGTGAACGGATTTGReverse:AGGTCGGTGTGAACGGATTTGPPARγForward:GGAAGACCACTCGCATTCCTTReverse:GTAATCAGCAACCATTGGGTCAC/EBPαForward:CAAGAACAGCAACGAGTACCGReverse:GTCACTGGTCAACTCCAGCACFABP4Forward:AAGGTGAAGAGCATCATAACCCTReverse:TCACGCCTTTCATAACACATTCCAdiponectinForward:ACCACTATGATGGCTCCACTReverse:GGTGAAGAGCATAGCCTTGT
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0软件处理数据,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1小鼠骨髓间充质干细胞的分离培养
骨髓MSCs细胞接种24 h后,大部分细胞仍然悬浮,少量细胞贴壁生长,细胞生长缓慢,3~4 d后增殖加快,1周左右接近融合。通过常规贴壁法分离纯化骨髓间充质干细胞,第3代细胞形态单一,呈梭形,细胞增生活跃。第4代细胞进行成骨成脂分化鉴定显示可以分化为成骨细胞和脂肪细胞,见图1。

Figure 1. MSCs isolated from mouse bone marrow(×200). A:the primary cells; B: the fourth generation cells; C:oil red O staining after adipogenic induction; D: alizarin red staining after osteogenic inducting differentiation.
图1分离培养的小鼠MSCs
2EPO对MSCs成脂分化的影响
为了检测EPO对成脂分化的影响,诱导分化过程中加入不同浓度EPO(0、0.1、1、5和10 kU/L),20 d 后油红O染色评估分化程度。如图2所示,EPO抑制MSCs的成脂分化,随着药物浓度增加MSCs中被染色的脂滴含量明显下降。用异丙醇萃取油红O后,EPO浓度和油红O萃取后的A值呈明显的负相关,其中,5 kU/L和10 kU/L EPO能显著抑制MSCs的成脂分化(P<0.05)。根据上述结果,本文选取5和10 kU/L EPO作为后面实验研究的作用浓度。
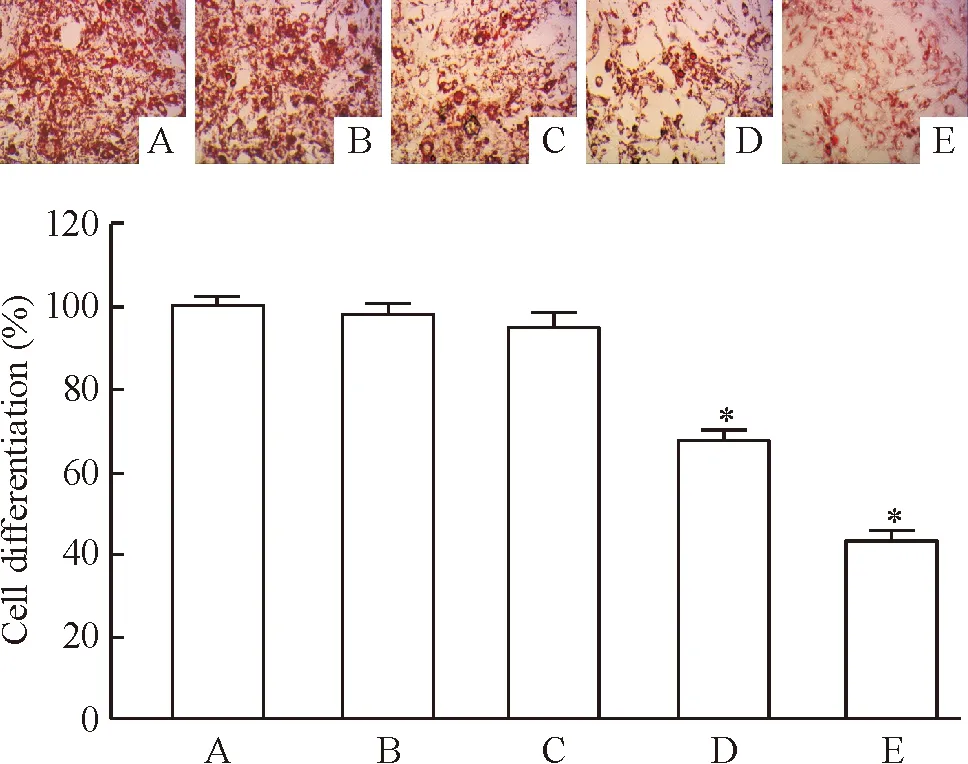
Figure 2. Oil red O staining and quantification after adipogenic induction of differentiation for 20 d(×200).A: EPO 0 kU/L; B: EPO 0.1 kU/L; C: EPO 1 kU/L; D: EPO 5 kU/L;E: EPO 10 kU/L.Mean±SD.n=5.*P<0.05vsA.
图2MSCs成脂诱导分化20d后油红O染色及定量
3EPO对MSCs增殖的影响
为了验证EPO是否存在细胞毒性,融合后的MSCs用成脂诱导分化液培养,加入不同浓度EPO(0、0.1、1、5和10 kU/L)干预,连续观察3 d,采用MTT法检测,结果显示在各时点各浓度EPO对MSCs增殖无显著影响, 见图3。

Figure 3. Effects of different concentrations of EPO on the proli-feration of MSCs. Mean±SD.n=5.
图3不同浓度EPO对MSCs增殖的影响
4EPO对MSCs成脂相关基因mRNA表达的影响
用5和10 kU/L干预MSCs成脂分化过程,观察分化第14 d MSCs的成脂相关基因表达情况,发现EPO能够下调成脂过程中PPARγ、C/EBPα、FABP4和脂联素mRNA表达,差异均有统计学意义(P<0.05), 见图4。

Figure 4. Relative PPARγ,C/EBPα,FABP4 and adiponectin mRNA levels in MSCs without and with EPO treatment (0,5 and 10 kU/L) during differentiation (day 14). Mean±SD.n=5.*P<0.05vs0 kU/L.
图4MSCs成脂分化过程中,不同浓度EPO对PPARγ、C/EBPα、FABP4和脂联素mRNA表达的影响
5EPO对MSCs向成脂细胞分化过程中ERK和p38MAPK的影响
MSCs成脂诱导分化过程中加入EPO(5和10 kU/L)处理后,上调了ERK42、ERK44和p38 MAPK磷酸化活性,同时PPARγ的磷酸化也增加,但总的PPARγ表达下降,见图5。
讨 论
骨髓间充质干细胞又称为骨髓基质细胞,与造血干细胞、造血祖细胞等构成骨髓造血微环境,调控机体的造血生理[11]。MSCs具有多向分化潜能,在骨髓腔中可以分化为成骨细胞、脂肪细胞、软骨细胞等。Naveiras等[12]证明了骨髓中的脂肪细胞对造血有负性调控作用,骨髓大量的脂肪细胞存在能够抑制造血干细胞移植后的造血重建,而抑制小鼠化疗后的骨髓脂肪则能促进造血恢复[13]。另一方面,绝经前女性的慢性失血能刺激骨髓造血,而骨质疏松这种骨髓脂肪化疾病多发生于绝经后女性[14],提示机体内骨髓的造血也有可能反作用于骨髓微环境。EPO作为机体内最重要的促进红细胞分化成熟的细胞因子,很有可能参与骨髓微环境的调节。已有研究证实了EPO通过结合表达于MSCs表面的EPO受体,能够直接促进MSCs的成骨分化[15],而MSCs的成骨分化和成脂分化是相互抑制相互平衡的调节过程。根据上述依据,所以我们推测EPO能够抑制骨髓MSCs成脂分化。

Figure 5. Effects of EPO on the expression and phosphorylation of ERK42, ERK44, p38 MAPK and PPARγ. Mean±SD.n=5.*P<0.05vs0 kU/L.
图5在MSCs成脂细胞分化过程中,EPO对ERK、p38MAPK和PPARγ表达及磷酸化的影响
通过油红O染色及其定量分析,我们发现EPO能够抑制MSCs的成脂分化,其中,5和10 kU/L EPO的抑制作用有统计学意义。随后我们用MTT法检测EPO对成脂诱导培养的MSCs是否具有细胞毒作用,结果显示在各时点各浓度EPO对MSCs增殖无影响,所以我们推测EPO对成脂分化过程中的MSCs没有直接细胞毒性作用。
MSCs成脂分化是一个伴随多种转录因子及脂肪细胞特异性基因表达的过程[16]。为了进一步验证EPO对MSCs成脂分化的影响,我们分析了多种成脂基因的表达水平。其中,PPARγ和C/EBPα是成脂分化中最关键的转录因子,它们协同作用调控着成脂分化中各种特异性因子的表达[17],而FABP4和脂联素则是分化后期脂肪细胞表达的特异性基因[18],荧光定量PCR的结果显示EPO显著抑制了 PPARγ、C/EBPα、 FABP4 和脂联素mRNA表达。
MAPK信号途径参与调节脂肪形成的各个阶段,分化前ERK和p38 MAPK调节细胞克隆增殖。另外,ERK和p38 MAPK对启动前脂肪细胞的分化过程是必需的,而在脂肪细胞成熟过程中这两条途径必须关闭,可能是由于PPARγ是ERK作用的底物,ERK磷酸化使PPARγ磷酸化增加,导致其活性下降[19-20]。另一方面,ERK和p38 MAPK是EPO受体下游的信号分子,于是我们推测EPO可能通过此信号通路发挥作用。通过研究发现EPO处理后的MSCs在分化过程中上调了ERK42、ERK44、p38 MAPK磷酸化活性,导致PPARγ的磷酸化增加,但总的PPARγ表达下降。这提示EPO通过ERK和p38 MAPK引起PPARγ磷酸化,调节成脂分化。
[1] Szenajch J, Wcislo G, Jeong JY, et al. The role of erythropoietin and its receptor in growth, survival and therapeutic response of human tumor cells: from clinic to bench -a critical review[J]. Biochim Biophys Acta, 2010, 1806(1):82-95.
[2] Grimm C, Wenzel A, Groszer M, et al. HIF-1-induced erythropoietin in the hypoxic retinaprotects against light-induced retinal degeneration[J]. Nat Med, 2002, 8(7):718-724.
[3] Digicaylioglu M, Bichet S, Marti HH, et al. Localization of specific erythropoietin binding sites in defined areas of the mouse brain[J]. Proc Natl Acad Sci U S A, 1995, 92(9):3717-3720.
[4] Anagnostou A, Liu Z, Steiner M, et al. Erythropoietin receptor mRNA expression in human endothelial cells[J]. Proc Natl Acad Sci U S A, 1994, 91(9):3974-3978.
[5] Kagaya Y, Asaumi Y, Wang W, et al. Current perspectives on protective roles of erythropoietin in cardiovascular system: erythropoietin receptor as a novel therapeutic target[J]. Tohoku J Exp Med, 2012, 227(2):83-91.
[6] 张新金,马业新,文 渊,等. 促红细胞生成素通过PI3-K/Akt信号通路抑制血管紧张素Ⅱ诱导的新生大鼠心脏成纤维细胞增殖[J].中国病理生理杂志,2009,25(2):293-298.
[7] Sirén AL, Fratelli M,Brines M, et al. Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J]. Proc Natl Acad Sci U S A, 2001, 98(7):4044-4049.
[8] Garcia P, Speidel V, Scheuer C, et al. Low dose erythropoietin stimulates bone healing in mice[J]. J Orthop Res, 2011, 29(2):165-172.
[9] Hojman P, Brolin C, Gissel H, et al. Erythropoietin over-expression protects against diet-induced obesity in mice through increased fat oxidation in muscles[J]. PLoS One, 2009, 4(6):e5894.
[10] Teng R, Gavrilova O, Suzuki N, et al. Disrupted erythropoietin signalling promotes obesity and alters hypothalamus proopiomelanocortin production[J]. Nat Commun, 2011,2:520.
[11] McGee SJ, Havens AM, Shiozawa Y, et al. Effects of erythropoietin on the bone microenvironment[J]. Growth Factors, 2012, 30(1):22-28.
[12] Naveiras O, Nardi V, Wenzel PL, et al. Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment[J]. Nature, 2009, 460(7252):259-263.
[13] Zhu RJ, Wu MQ, Li ZJ, et al. Hematopoietic recovery following chemotherapy is improved by BADGE-induced inhibition of adipogenesis[J]. Int J Hematol, 2013, 97(1):58-72.
[14] Gurevitch O, Prigozhina TB, Pugatsch T, et al. Transplantation of allogeneic or xenogeneic bone marrow within the donor stromal microenvironment[J].Transplantation, 1999, 68(9):1362-1368.
[15] Shiozawa Y, Jung Y, Ziegler AM, et al. Erythropoietin couples hematopoiesis with bone formation[J]. PLoS One, 2010, 5(5):e10853.
[16] Cristancho AG, Lazar MA. Forming functional fat: a growing understanding of adipocyte differentiation[J]. Nat Rev Mol Cell Biol, 2011, 12(11):722-734.
[17] Wu Z, Rosen ED, Brun R, et al. Cross-regulation of C/EBPα and PPARγ controls the transcriptional pathway of adipogenesis and insulin sensitivity[J]. Mol Cell, 1999, 3(2):151-158.
[18] Lefterova MI, Lazar MA. New developments in adipogenesis[J]. Trends Endocrinol Metab, 2009, 20(3):107-114.
[19] Camp HS, Tafuri SR. Regulation of peroxisome proliferator-activated receptor γ activity by mitogen-activated protein kinase[J]. J Biol Chem, 1997, 272(16):10811-10816.
[20] Hu E, Kim JB, Sarraf P, et al. Inhibition of adipogenesis through MAP kinase-mediated phosphorylation of PPARγ[J]. Science, 1996, 274(5295):2100-2103.
ErythropoietininhibitsadipogenesisofmousebonemarrowmesenchymalstemcellsbyactivatingERKandp38MAPK
LIU Ge-xiu, ZHU Jin-can, CHEN Xiao-yu, ZHU Ai-zhen, LIU Cheng-cheng, LAI Jing
(InstituteofHematology,JinanUniversity,Guangzhou510632,China.E-mail:tliugx@jnu.edu.cn)
AIM: To explore the role of erythropoietin (EPO) in the differentiation of mouse bone marrow-derived mesenchymal stem cells (MSCs) into adipocytes.METHODSThe mouse MSCs were cultured using routine methods. The cells were induced to differentiate by the cocktail medium containing 3-isobutyl-1-methylxanthine, insulin and dexamethasone, and the cells in the experiment group were treated with EPO. On the 20th day of induced differentiation, the cells were detected by oil red O staining. The mRNA expression of peroxisome proliferator-activated receptor γ (PPARγ), CCAAT/enhancer-binding protein α (C/EBPα), fatty acid binding protien 4 (FABP4) and adiponectin were determined by real-time fluorescence quantitative PCR. The phosphorylation levels of PPARγ, extracellular signal-regulated kinase (ERK) and p38 mitogen-activated protein kinase (p38 MAPK) were measured by Western blotting. MTT assay was adopted to detect the proliferation.RESULTSDuring adipogenic induction, EPO decreased lipid accumulation, and inhibited the adipogenic differentiation of MSCs without cytotoxicity. The mRNA expression of PPARγ, C/EBPα, FABP4 and adiponectin was significantly inhibited in induced cells. Moreover, EPO enhanced the activity of both p38 MAPK and ERK, and increased PPARγ phosphorylation.CONCLUSIONEPO significantly inhibits differentiation of mouse bone marrow-derived MSCs into adipocytesinvitrovia reducing the mRNA expression of PPARγ, C/EBPα, FABP4 and adiponectin, which may be mediated by the p38 MAPK and ERK signaling pathways.
Erythropoietin; Mesenchymal stem cells; Signaling pathway
R329.2+8
A
10.3969/j.issn.1000- 4718.2013.11.016
1000- 4718(2013)11- 2006- 05
2013- 07- 15
2013- 09- 26
国家自然科学基金资助项目(No.81270568)
△通讯作者 Tel: 020-85220262; E-mail: tliugx@jnu.edu.cn
