慢性阻塞性肺疾病患者肺组织中缺氧诱导因子1α的表达变化*
2013-10-24魏文婷贾晔然张红璇
魏文婷, 李 冰, 贾晔然, 陈 淼, 张红璇△
(1广东省人民医院,广东省医学科学院平洲分院综合科,广东 佛山 528200; 2深圳市龙岗中心医院,广东 深圳 518100)
慢性阻塞性肺疾病患者肺组织中缺氧诱导因子1α的表达变化*
魏文婷1, 李 冰2, 贾晔然1, 陈 淼1, 张红璇1△
(1广东省人民医院,广东省医学科学院平洲分院综合科,广东 佛山 528200;2深圳市龙岗中心医院,广东 深圳 518100)
目的检测缺氧诱导因子1α(hypoxia-inducible factor 1α HIF-1α)在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者肺组织标本中的表达及其在COPD发病过程中的作用。方法COPD病例组和对照组均16例,2组人群性别、年龄相匹配, 均为因肺部占位病变行肺叶切除术患者, 取材尽量远离病变组织,利用Western blotting和酶联免疫吸附试验(ELISA)检测2组人群肺组织标本中HIF-1α蛋白的表达。结果ELISA 检测结果显示COPD患者与对照组肺叶组织标本中HIF-1α 蛋白表达水平分别为(0.16±0.07) μg/L与(0.96±0.43) μg/L,Western blotting检测结果显示COPD患者与对照组肺叶组织标本中HIF-1α 蛋白表达水平分别为0.53±0.15和0.71±0.22,COPD病例组肺叶组织标本中HIF-1α 蛋白表达水平明显低于对照组,差异有统计学意义(P<0.05)。依据COPD疾病的严重程度将病例组人群分组,结果发现轻、中度COPD和重度COPD患者肺叶组织标本中HIF-1α蛋白水平分别为0.78±0.06和0.39±0.10;重度COPD患者肺叶组织标本中HIF-1α蛋白表达水平明显低于轻中度COPD患者,差异有统计学意义(P<0.05)。结论HIF-1α在慢性阻塞性肺疾病的进展过程中表达减少,可能与疾病的发展相关。
缺氧诱导因子1α; 慢性阻塞性肺疾病; 蛋白质印迹法; 酶联免疫吸附试验
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)以不可逆性、进行性气流阻塞为特征,与慢性支气管炎和肺气肿密切相关。COPD 的发病率和死亡率有逐年增加的趋势[1-3]。然而对于COPD患者, 目前尚无有效阻止病程进展或根治的方法。因此, 探讨COPD的发病机制, 对前瞻性地寻找COPD易患个体以及阻断COPD的发生、发展有重要意义。
缺氧诱导因子1(hypoxia-inducible factor 1, HIF-1)是哺乳动物细胞内存在的一类随细胞内氧浓度变化而介导低氧适应性反应的转录因子,是低氧条件下维持氧稳态的关键性物质,能够调节100多种靶基因的表达,与缺氧适应、众多炎症因子的表达、免疫反应、缺氧性肺动脉高压密切相关,提示了其在慢性阻塞性肺疾病发生、发展中不可忽视的重要位置。有文献指出, COPD 患者血清中的HIF-1α的表达水平要明显高于无COPD者,但是关于COPD患者肺组织中 HIF-1α表达水平的研究尚未见到大量相关报道。本课题利用蛋白质印迹法(Western blotting)和酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测2组人群肺组织标本中HIF-1α蛋白的表达水平,从而分析其在COPD发病过程中的作用。
材 料 和 方 法
1实验对象及分组
全部研究对象选自广东省人民医院2012年5月~2012年11月因肺癌手术切除的肺组织标本。本研究经过广东省人民医院伦理委员会批准, 并通过受试对象的知情同意。
COPD病例组(n=16):COPD的诊断标准按照2007年全球慢性阻塞性肺疾病倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD),所有病例均经病史、体检及相关检查[如肺功能检测:FEV1 (forced expiratory volume in one second)/FVC (forced vital capacity)和FEV1%predicted;X 射线胸部平片或胸部高分辨 CT等]确诊为COPD(FEV1/FVC<70%,且FEV1 %predicted<80%);且均根据 X 线检查(X光片和/或CT)及术中所见排除肿瘤所致阻塞性肺炎及肿瘤阻塞中央大气道的情况。
对照组(n=16):均为肺癌患者未合并COPD、支气管哮喘/肺囊性纤维化、支气管扩张或弥漫性细支气管炎,且行肺功能测试提示 FEV1/FVC>70%predicted FEV1≥80%。
所有受试者在2 周内无急性呼吸道感染。2组对象均为无民族间遗传干扰(与其他民族人通婚)、无血缘关系的汉族人。
2实验方法
2.1标本的获取 实验所用的肺组织取自尽量远离肺癌病灶(距肿瘤8 cm以上), 肉眼观察无肺癌浸润的外周肺叶组织。手术取下肺组织标本,立即置入液氮罐中速冻, 然后将组织移存于深低温冰箱 (-80 ℃) 中长期贮存, 避免组织的反复冻融。
2.2ELISA检测肺组织匀浆中HIF-1α的含量 ELISA 试剂盒购于上海BG公司。取液氮中保存的等量肺组织(50~100 mg)尽量剪碎,冰浴条件下用超声破碎仪充分匀浆后高速离心5 min,取上清液。按照ELISA试剂盒说明进行检测。用酶标仪在450 nm波长下测定吸光度(A值),根据标准品A值绘制的标准曲线查出相应细胞因子的浓度。
2.3Western blotting检测肺组织中HIF-1α的含量 取液氮中冻存组织采用凯基全蛋白提取试剂盒进行蛋白抽提;BCA蛋白浓度测定试剂盒进行定量;等量样品上12%聚丙烯酰胺凝胶电泳后,转膜至硝酸纤维膜;PBS洗膜后用5%脱脂牛奶封闭1 h;加入Ⅰ抗后4℃冰箱过夜。TBST洗膜3遍,每次10 min。加入Ⅱ抗后室温30~40 min。TBST洗膜3遍,每次10 min。显影液显影, 凝胶成像仪获取图像, 用FluorChem 8900自动图像分析软件对HIF-1α光带进行分析,以HIF-1α与β-actin蛋白条带的灰度峰比值代表HIF-1α的表达量。
3统计学处理
采用SPSS 13.0软件分析。服从正态分布的计量资料用均数±标准差(mean±SD)表示,两组间比较用t检验,以P<0.05 为差异有统计学意义。
结 果
12组对象临床资料的一般性描述
本研究采用群体样本的一般性描述。健康对照组与COPD病例组人群间的性别、年龄、吸烟指数等无统计学意义,对照组的FEV1% predicted和FEV1/FVC明显高于COPD病例组,见表1。
表1COPD病例组与对照组的临床资料
Table 1. Comparison of age, sex, smoking index and lung fuction between COPD patients and healthy subjects(Mean±SD.n=16)

ItemCOPDControlSex(male∶female)9∶710∶6Age(year)63.44±9.1663.31±8.65Smokingindex362±457377±483FEV1/FVC(%)60.4±7.983.98±5.3FEV1%predicted55.1±11.7*89.7±12.3
*P<0.05vscontrol.
2COPD病例组及其对照组人群肺组织标本中HIF-1α的表达
2组人群肺组织标本中均能明显表达HIF-1α蛋白。ELISA 检测结果显示COPD患者与对照组肺叶组织标本中HIF-1α 蛋白表达水平分别为(0.16±0.07) μg/L与(0.96±0.43) μg/L,Western blotting检测结果显示COPD患者与对照组肺叶组织标本中HIF-1α 蛋白表达水平分别为0.53±0.15和0.71±0.22,说明COPD病例组肺叶组织标本中HIF-1α 蛋白表达水平明显低于对照组,差异有统计学意义(P<0.05)。依据COPD疾病的严重程度将病例组人群分组,结果发现轻、中度COPD和重度COPD患者肺叶组织标本中HIF-1α蛋白水平分别为0.78±0.06和0.39±0.10;重度COPD患者肺叶组织标本中HIF-1α蛋白表达水平明显低于轻、中度COPD患者,差异有统计学意义(P<0.05),见图1。
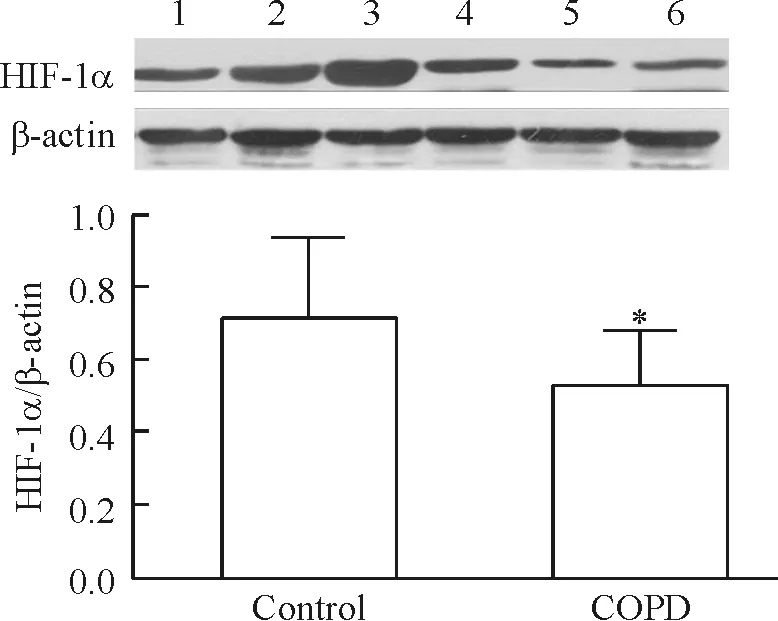
Figure 1. The expression of HIF-1α in pulmonary tissues from COPD patients and healthy subjects determined by Western blotting.1,2:control;3,4: mild COPD;5,6:severe COPD.Mean±SD.n=16.*P<0.05vscontrol.
图1COPD病例组及对照组肺组织标本中HIF-1α的表达
讨 论
COPD是一种以不完全可逆的气流受限为特征的肺部慢性疾病,是以产生低氧血症为后果的常见病、多发病;HIF-1是哺乳动物细胞内存在的低氧条件下维持氧稳态的关键性物质,是由氧调节亚单位HIF-1α和结构亚单位HIF-1β组成的异二聚体。其转录活性主要由HIF-1α的表达水平和稳定性决定,氧对HFI-1活性调节主要通过该亚基受低氧诱导。已有大量研究表明HIF-1α与COPD之间的相互关系:胡瑞成等[4]实验发现COPD患者肺部炎症细胞增多,肺部炎症细胞内HIF-lα基因强阳性表达。李启芳等[5]研究表明COPD患者肺血管有明显的无肌细动脉肌化,中膜肌性增厚,血管壁增厚和管腔变窄; COPD患者肺小动脉HIF-1α mRNA及蛋白表达均明显增强,与管壁厚度和管壁面积呈正相关,提示HIF-1α可能参与了COPD气道重塑和肺动脉高压形成的发病过程。然而,除了早产羔羊急性呼吸窘迫综合症[6]及急性心肌局部缺血再灌注损伤[7-8]以外,目前未见关于HIF-1α在肺组织中表达水平明显降低的大量相关报道。2010年Yasuo等[9]的研究中指出,在重度COPD/肺气肿病人肺组织以及肺动脉内皮细胞和肺泡间隔细胞中,HIF-1α mRNA及HIF-1α蛋白表达量明显降低,认为其与肺实质结构在分子水平上遭到明显损坏相关。
本课题以COPD及对照组肺叶组织标本为研究对象,利用ELISA法及Western blotting技术检测后发现,COPD病例组肺叶组织标本中HIF-1α 蛋白表达水平明显低于对照组,差异有统计学意义(P<0.05);且病例组人群重度COPD患者肺叶组织标本中HIF-1α蛋白表达水平明显低于轻中度COPD患者,差异有统计学意义(P<0.05)。众所周知,氧化应激反应在人类COPD/肺气肿肺组织及动物肺气肿模型肺组织中普遍存在[10-12];组蛋白脱乙酰酶2(histone deacetylase 2,HDAC2)是转录过程中非常重要的核染色质修饰酶,参与蛋白合成过程中的转录后修饰;p53基因是一种抑癌基因,细胞生长周期中的负调节因子,与细胞周期的调控、DNA修复、细胞分化、细胞凋亡等重要的生物学功能有关。在COPD/肺气肿病人肺组织中,缺氧引起的氧化应激反应可抑制HDAC2蛋白表达水平[13-14]而使p53蛋白的表达量增多[15],同时HDAC2蛋白表达水平的下降可使p53蛋白表达水平上调[15]。最终HDAC2蛋白表达水平的下降和p53蛋白表达水平的上调导致COPD/肺气肿病人血浆和肺组织中HIF-1α mRNA表达水平下降和HIF-1α蛋白表达量降低[16-17]。
综上所述, COPD是以不可逆性、进行性气流阻塞为特征的肺部慢性疾病,是一种慢性全身性炎症综合征[18],HIF-1α是低氧条件下维持氧稳态的关键性物质,与COPD的发生、发展密切相关,在疾病的进展中有重要的作用。本研究发现,重度COPD患者肺组织中HIF-1α的表达水平明显下降,可能与肺组织遭到不同程度的破坏有关,进一步分析血浆及肺组织中HIF-1α表达水平与COPD严重程度之间的关系具有重大的临床意义,值得进一步深入探讨。
[1] Pauwels RA, Buist AS, Calverley PM, et al. Global stra-tegy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary [J]. Am J Respir Crit Care Med, 2001, 163(5):1256-1276.
[2] Viegi G, Scognamiglio A, Baldacci S, et al. Epidemiology of chronic obstructive pulmonary disease (COPD) [J]. Respiration, 2001, 68(1):4-19.
[3] Wouters EF. Economic analysis of the Confronting COPD survey: an overview of results [J]. Respir Med, 2003, 97(Suppl C): S3-S14.
[4] 胡瑞成, 戴爱国, 谭双香. 慢性阻塞性肺疾病患者肺部缺氧诱导因子1α表达研究[J]. 中华结核和呼吸杂志,2002,25(8):491-492.
[5] 李启芳,戴爱国,徐 平.慢性阻塞性肺疾病患者肺小血管低氧诱导因子-α的表达[J].中华内科杂志,2006,45(2):136-139.
[6] Grover TR, Asikainen TM, Kinsella JP, et al. Hypoxia-inducible factors HIF-1α and HIF-2α are decreased in an experimental model of severe respiratory distress syndrome in preterm lambs[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 292(6): L1345-L1351.
[7] Granger A, Abdullah I, Huebner F, et al. Histone deacetylase inhibition reduces myocardial ischemia-reperfusion injury in mice[J]. FASEB J,2008,22(10):3549-3560.
[8] Natarajan R, Salloum FN, Fisher BJ, et al. Activation of hypoxia-inducible factor-1 via prolyl-4 hydoxylase-2 gene silencing attenuates acute inflammatory responses in postischemic myocardium[J]. Am J Physiol Heart Circ Physiol, 2007, 293(3): H1571-H1580.
[9] Yasuo M, Mizuno S, Kraskauskas D, et al. Hypoxia inducible factor-1α in human emphysema lung tissue[J]. Eur Respir J, 2011, 37(4): 775-783.
[10] Deslee G, Woods JC, Moore C, et al. Oxidative damage to nucleic acids in severe emphysema[J]. Chest, 2009, 135(4): 965-974.
[11] Ziel KA, Grishko V, Campbell CC, et al. Oxidants in signal transduction: impact on DNA integrity and gene expression[J]. FASEB J, 2005, 19(3):387-394.
[12] Pastukh V, Ruchko M, Gorodnya O, et al. Sequence-specific oxidative base modifications in hypoxia-inducible genes[J]. Free Radic Biol Med,2007,43(12): 1616-1626.
[13] Ito K, Ito M, Elliott WM, et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease[J]. N Engl J Med, 2005, 352(19): 1967-1976.
[14] Rahman I. Antioxidant therapeutic advances in COPD[J]. Ther Adv Respir Dis, 2008, 2(6):351-374.
[15] Kim MS, Kwon HJ, Lee YM, et al. Histone deacetylases induce angiogenesis by negative regulation of tumor suppressor genes[J]. Nat Med, 2001, 7(4): 437-443.
[16] Mizuno S, Yasuo M, Bogaard HJ, et at. HDAC inhibition causes apoptosis in human pulmonary endothelial cells and lung fibroblasts[J]. Am J Respir Crit Care Med, 2010, (Abstract Issue, in press).
[17] Ellis L, Hammers H, Pili R. Targeting tumor angiogenesis with histone deacetylase inhibitors[J].Cancer Lett, 2009, 280(2):145-153.
[18] Fabbri LM,Rabe KF.From COPD to chronic systemic inflammatory syndrome?[J].Lancet,2007,370(9589):797-799.
Expressionofhypoxia-induciblefactor1αinpulmonarytissuesfrompatientswithchronicobstructivepulmonarydisease
WEI Wen-ting1, LI Bing2, JIA Ye-ran1, CHEN Miao1, ZHANG Hong-xuan1
(1ComprehensiveDepartment,BranchofPingzhou,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Foshan528200,China;LonggangCentralHospitalofShenzhenCity,Shenzhen518100,China.E-mail:sandyzhx@hotmail.com)
AIM: To study the expression of hypoxia-inducible factor 1α (HIF-1α) in pulmonary tissues from patients with chronic obstructive pulmonary disease (COPD) μg/L and its effects on the pathogenesis of COPD.METHODSPulmonary tissues were obtained from 32 subjects (16 patients with COPD and 16 without COPD as controls) who were undergoing single or bilateral lobectomy or wedge resection for lung cancer. The specimens were obtained as far away from the cancer foci (≥8 cm) as possible. The expression of HIF-1α protein in pulmonary tissues was measured by Western blotting and enzyme-linked immunosorbent assay (ELISA).RESULTSThe expression of HIF-1α protein in pulmonary tissues from controls and COPD patients was as follows: (0.96±0.43) μg/L and (0.16±0.07) μg/L (ELISA,P<0.05); 0.71±0.22 and 0.53±0.15 (Western blotting,P<0.05). Furthermore, the level of HIF-1α protein in pulmonary tissues from mild and moderate COPD patients was obviously higher than that from severe COPD patients (P<0.05).CONCLUSIONHIF-1α may play an important role in the progress of COPD.
Hypoxia-inducible factor 1α; Chronic obstructive pulmonary disease; Western blotting; Enzyme-linked immunosorbent assay
R363
A
1000- 4718(2013)09- 1700- 04
2013- 04- 18
2013- 07- 26
广东省科技基金资助项目 (No.2009B030801247)
△通讯作者 Tel: 020-85221779; E-mail: sandyzhx@hotmail.com
10.3969/j.issn.1000- 4718.2013.09.029
