犀角地黄汤合银翘散对流感病毒感染的小鼠肺组织及大鼠肺微血管内皮细胞ICAM-1和VCAM-1表达的影响*
2013-10-24张晨月金叶智李根茂
张晨月, 张 舒, 吴 莹, 金叶智, 李根茂, 王 谦, 郝 钰
(北京中医药大学基础医学院,北京 100029)
犀角地黄汤合银翘散对流感病毒感染的小鼠肺组织及大鼠肺微血管内皮细胞ICAM-1和VCAM-1表达的影响*
张晨月, 张 舒, 吴 莹, 金叶智, 李根茂, 王 谦, 郝 钰△
(北京中医药大学基础医学院,北京 100029)
目的研究中医经典合方犀角地黄汤合银翘散(XDY)对流感病毒性肺炎小鼠肺组织及对流感病毒感染的大鼠肺微血管内皮细胞(RPMVECs)中细胞间黏附分子1(ICAM-1)和血管细胞黏附分子1(VCAM-1)表达的影响,探讨其治疗病毒性肺炎的机制。方法54只雄性BALB/c小鼠随机分为正常组、模型组和XDY组,每组18只,后2组以流感病毒滴鼻感染,XDY组灌胃给予XDY;在感染后的2、4和6 d分别取材,免疫组化法观察肺组织中ICAM-1和VCAM-1表达。从雄性Wistar大鼠中分离并原代培养RPMVECs,设置正常组、病毒组、病毒+XDY含药血清组、肿瘤坏死因子α(TNF-α)组和TNF-α+XDY含药血清组;刺激因素作用24 h后,real-time PCR检测ICAM-1和VCAM-1 mRNA水平,流式细胞术检测ICAM-1和VCAM-1蛋白表达。结果与正常组比较,模型组肺组织中ICAM-1和VCAM-1表达持续增多(P<0.01),而XDY组的表达均低于模型组 (P<0.01);与正常组比较,流感病毒和TNF-α作用的RPMVECs中 ICAM-1和VCAM-1 mRNA及蛋白表达明显升高(P<0.01),XDY能下调ICAM-1和VCAM-1 mRNA及蛋白表达 (P<0.01)。结论抑制流感病毒感染导致的RPMVECs黏附分子的表达从而抑制机体的炎症级联反应可能是XDY治疗流感病毒性肺炎的作用机制之一。
犀角地黄汤合银翘散; 病毒性肺炎; 流感病毒; 肺微血管内皮细胞; 细胞间黏附分子1; 血管细胞黏附分子1
病毒性肺炎是流感最严重的并发症之一,导致较高的死亡率[1]。因此,病毒性肺炎的防治在流感的治疗中尤为重要。犀角地黄汤合银翘散(Xijiao Dihuang and Yinqiao San decoction, XDY)是源于吴鞠通《温病条辨·上焦篇》的经典合方,该方以银翘散清解卫分之毒,以犀角地黄汤解营血之毒,两方相合,具有清热解毒、凉血止血、化瘀通络之功效,临床上临证加减用于治疗病毒性肺炎[2]。前期研究证实,流感病毒性肺炎小鼠肺组织有大量炎症细胞浸润,XDY对流感病毒没有直接的抗病毒作用,但可减少肺组织中炎症细胞的浸润,主要通过抑制病毒所致的炎症级联反应起到治疗作用[3]。黏附分子在白细胞与血管内皮细胞黏附、穿越血管壁而渗出的过程中发挥重要作用[4],因此,本研究以流感病毒感染的小鼠为模型,观察XDY对病毒性肺炎小鼠细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)表达的影响;以大鼠肺微血管内皮细胞(rat pulmonary microvascular endothelial cells, RPMVECs)为模型,研究XDY含药血清对流感病毒感染的RPMVECs中ICAM-1和VCAM-1表达影响,探讨XDY治疗病毒性肺炎的相关分子机制。
材 料 和 方 法
1材料
1.1动物及病毒株 BALB/c小鼠(动物合格证号为SGXK20070001)和清洁雄性Wistar大鼠(动物合格证号为SGXK20120001)购自北京维通利华实验动物中心;流感病毒亚洲甲型鼠肺适应株A/FM/1/34(H1N1),由中国预防医学科学院病毒学研究所提供,于9日龄鸡胚尿囊腔连续传代2次后,血凝滴度为1∶512。采用Reed Muench法[5]测定计算其对小鼠的半数致死量(50%lethal dose,LD50)为10-3.877, 半数组织培养感染剂量(50%tissue culture infectious dose,TCID50)为10-4.6/0.1 L。
1.2主要试剂 反转录试剂购自Fermentas MBI,PCR试剂购自大连宝生物工程有限公司,ICAM-1抗体和重组大鼠TNF-α购自Proteintech,SABC免疫组化试剂盒和VCAM-1抗体购自博士德。M199和胎牛血清购自HyClone,双抗和胰蛋白酶-EDTA消化液购自Solarbio,RNeasy Mini Kit 购自Qiagen,Gold View和DNA MarkerⅠ购自北京科宏博恩。内皮细胞生长添加剂(Endothelial Cell Growth Supplement,ECGS)、PE Mouse Anti-Rat CD106和PE Mouse Anti-RatCD54购自BD。Rabbit Anti-PECAM-1购自北京博奥森。Real-time PCR引物:ICAM-1上游引物5’-AGG TATCCA TCC ATC CCA CA-3’,下游引物5’-GCC ACA GTT CTC AAA GCA CA-3’; VCAM-1上游引物5’-TGA CAT CTC CCC TGG ATC TC-3’,下游引物5’-CTC CAG TTT CCT TCG CTG AC-3’,由奥科生物科技有限公司合成。
1.3药物 XDY复方,由水牛角30 g(代替犀角)、生地黄30 g、芍药12 g、丹皮9 g、连翘9 g、金银花9 g、苦桔梗6 g、薄荷6 g、竹叶4 g、生甘草5 g、荆芥穗5 g、淡豆豉5 g和牛蒡子9 g组成1剂,药材购自北京同仁堂药店。成人生药量2.3 g·kg-1·d-1,小鼠的等效剂量为成人的10倍,即23 g·kg-1·d-1。大鼠的等效剂量为成人的6.3倍,即13.8 g·kg-1·d-1。将药材煎制浓缩为含生药2.07 kg/L的合剂,4 ℃保存备用。
2方法
2.1动物分组和造模 雄性BALB/c小鼠54只,体重16~18 g,随机分为正常组、模型组和XDY组,每组18只。小鼠在乙醚轻度麻醉下,除正常组外每只小鼠以25 μL 50 LD50病毒液滴鼻感染,正常组用等量无菌PBS液滴鼻。感染后1 h,正常组和模型组予以双蒸水灌胃;XDY组给XDY 23 g·kg-1·d-1灌胃;各组均为给药2次/d,连续给药5 d。
2.2免疫组化法检测小鼠肺组织中ICAM-1和VCAM-1表达 感染后第2天、第4天和第6天,每组取6只小鼠处死,摘取肺脏,取全肺做常规固定、石蜡包埋、切片后,按试剂盒说明书操作。每组切片随机选5张,每张取5个高倍(×400)视野,用高清晰度Olympus BX51光学显微镜加制冷摄像头采集图像,Image-Pro® Plus 5.1 图像分析软件测定肺内ICAM-1和VCAM-1蛋白表达,并计算其阳性表达积分吸光度(integral absorbance,IA)。
2.3XDY含药血清的制备 Wistar大鼠,体重300 g左右,随机分为2组,含药血清组及正常组。含药血清组给予XDY药液13.8 g·kg-1·d-1灌胃,正常组给予等体积的生理盐水,每日2次,连续3 d,于末次灌药前12 h禁食。第4天早晨末次灌药后1 h,10%水合氯醛腹腔注射麻醉,腹主动脉采血,室温静置4 h后,3 000 r/min离心15 min,分离血清,经56 ℃、30 min灭活处理后,-70 ℃冰箱保存备用。
2.4RPMVECs原代培养及鉴定 根据姜明等[6]的方法,原代培养RPMVECs并进行鉴定。
2.5荧光定量PCR检测RPMVECs中ICAM-1和VCAM-1 mRNA水平 原代培养RPMVECs,设置正常组、病毒组、病毒加XDY含药血清组、TNF-α组和TNF-α加XDY含药血清组(上述各组病毒最终滴度为100 TCID50,TNF-α终浓度为100 μg/L,含药血清终浓度为15%)。干预因素作用24 h后,收集各组细胞,按RNeasy Mini Kit试剂盒操作说明书提取各组细胞总RNA,用TE绶冲液10倍稀释。PCR扩增按One Step SYBR Prime Script PT-PCR kitⅡ试剂盒说明书进行。扩增条件为:Pattern 1:42 ℃ 5 min;95 ℃10 s;Pattern 2:循环40,95 ℃ 5 s,60 ℃ 30 s,测得Ct值。结果以目的基因与内参基因的比值表示。
2.6流式细胞术检测ICAM-1和VCAM-1蛋白的表达 原代培养RPMVECs,分组同2.5。干预因素作用24 h,消化细胞,4 ℃、1 000 r/min离心5 min,弃上清,PBS溶液洗涤3次后,PE标记的ICAM-1和VCAM-1孵育30 min,4 ℃、1 000 r/min离心5 min,弃上清,再用PBS溶液洗涤3次后,4%多聚甲醛固定,流式细胞术检测平均荧光强度。
3统计学处理
数据采用SPSS 16.0软件分析。数据以均数±标准差(mean±SD)表示。多组间差异采用单因素方差分析(One-way ANOVA),组间两两比较用LSD法,以P<0.05为差异有统计学意义。
结 果
1XDY对肺组织中ICAM-1和VCAM-1表达的影响
感染后第6天各组肺组织ICAM-1和VCAM-1的免疫组化染色见图1。流感病毒感染小鼠后第2天、第4天和第6天,模型组肺组织中ICAM-1和VCAM-1表达明显增多,与正常组相比差异显著(P<0.01)。XDY组黏附分子的表达在各个时点均低于模型组,差异显著(P<0.01),见图2。
2Real-timePCR检测流感病毒感染的RPMVECs中ICAM-1和VCAM-1mRNA水平
流感病毒感染RPMVECs 24 h后,病毒组ICAM-1和VCAM-1 mRNA表达明显增多,与正常组相比有显著差异(P<0.01),病毒加XDY含药血清组黏附分子mRNA的表达低于模型组,差异显著(P<0.01);TNF-α组ICAM-1和VCAM-1 mRNA表达明显增多,与正常组相比差异显著(P<0.01),TNF-α加XDY含药血清组黏附分子mRNA的表达低于TNF-α组,差异显著(P<0.01),见图3。

Figure 1. Effect of XDY prescription on ICAM-1 and VCAM-1 expression in the lungs of mice with viral pneumonia on the 6th day after infection. A: control; B: mice were infected with influenza virus; C: mice were infected with influenza virus then treated with XDY.
图1感染后第6天小鼠肺组织ICAM-1和VCAM-1的表达

Figure 2. Effects of XDY prescription on ICAM-1 (A) and VCAM-1(B) expression in the lungs of mice with viral pneumonia. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsmodel group.
图2XDY对病毒性肺炎小鼠肺组织中ICAM-1和VCAM-1表达的影响
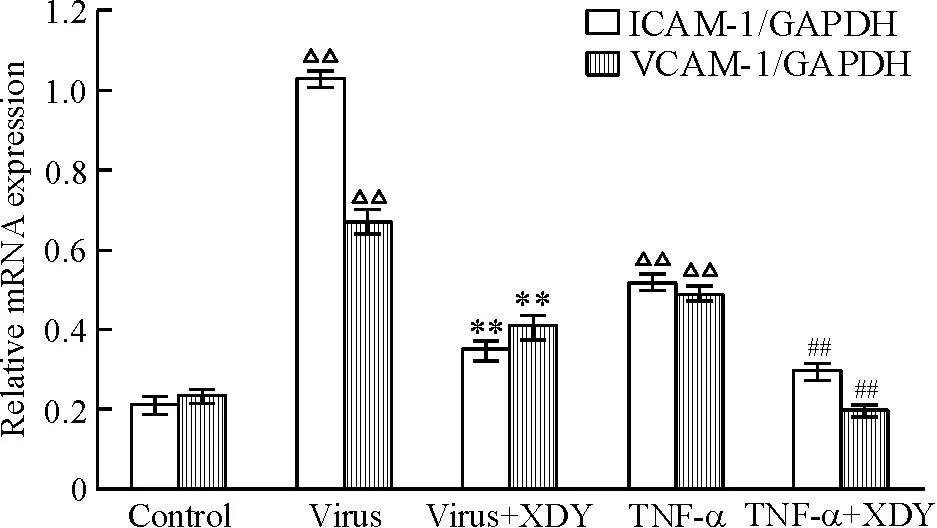
Figure 3. Effects of XDY prescription on ICAM-1 and VCAM-1 mRNA expression in RPMVECs exposed to virus or TNF-α. Mean±SD.n=3.△△P<0.01vscontrol group;**P<0.01vsvirus group;##P<0.01vsTNF-α group.
图3XDY对流感病毒感染的RPMVECs中ICAM-1和VCAM-1mRNA表达的影响
3流式细胞术检测流感病毒感染的RPMVECs中ICAM-1和VCAM-1蛋白的表达
干预因素作用24 h,与正常组比较,病毒组和TNF-α组RPMVECs的ICAM-1和VCAM-1表达升高,均有显著差异(P<0.01);与病毒组相比,病毒加含药血清组ICAM-1和VCAM-1表达降低,且均有显著差异(P<0.01);与TNF-α组相比,TNF-α加XDY含药血清组ICAM-1和VCAM-1表达降低,且均有显著差异(P<0.01),见图4、5和表1。
讨 论
XDY是治疗病毒性肺炎的经典合方。前期研究已经证明该方可降低病毒性肺炎小鼠的死亡率,延长生存时间;体外研究表明XDY含药血清可明显抑制流感病毒感染后肺泡巨噬细胞炎症细胞因子、炎症介质及自由基的产生,具有抗炎作用[7]。本研究探讨了XDY对流感病毒感染的小鼠肺组织及体外RPMVECs中黏附分子ICAM-1和VCAM-1表达的影响,以进一步阐述该方治疗流感病毒性肺炎的作用机制。
病毒性肺炎是流感的常见并发症,是导致流感较高死亡率的重要原因。前期研究表明,流感病毒在感染肺组织中的滴度与肺的病理改变并不同步,肺部炎性病变的发生不仅与病毒对细胞的直接作用有关,还与病毒感染后机体发生的炎症级联反应密切相关,过度的炎症反应似乎在病毒性肺炎的发病过程中更为重要[3]。流感病毒感染后,体内单核巨噬细胞在肺组织周围聚集并被激活,巨噬细胞释放大量的前炎症因子如TNF-α、趋化性细胞因子MCP-1及自由基等,在炎症因子作用下,肺泡上皮细胞和微血管内皮细胞被激活,高表达ICAM-1、VCAM-1等黏附分子,吸引更多炎症细胞聚集和过度活化,形成瀑布效应,导致严重病理损伤[4]。因此,ICAM-1和VCAM-1在病毒性肺炎的发病过程中尤为重要。有研究报道TNF-α通过与TNF-α受体作用导致磷脂酶C的激活,继而水解PC-PLC产生DAG,从而激活PKC;上述通路参与调节TNF-α诱导NF-κB的激活,并与ICAM-1基因启动子中的共识序列结合导致了ICAM-1表达升高[8]。又有研究证实内皮细胞上ICAM-1表达升高还会通过NF-κB之外的其它信号通路导致VCAM-1的升高[9]。
ICAM-1和VCAM-1是目前发现的介导内皮细胞与白细胞之间相互黏附的免疫球蛋白超家族黏附分子中最重要的两种,分别通过与整合素家族的αLβ2和α4相结合发挥作用[10]。ICAM-1主要表达于内皮细胞、上皮细胞及淋巴细胞等的细胞膜表面,正常情况下表达量较低,炎症因子刺激后,表达量迅速增加[11]。ICAM-1分子与αLβ2相互作用导致白细胞跨内皮迁徙最终积聚于炎症部位[4、12]。研究发现,炎症细胞黏附是腺病毒和呼吸道合胞病毒肺炎中肺部感染的重要环节,ICAM-1和其受体的相互作用又是炎症细胞黏附、聚集的关键[13]。

Figure 4. The ICAM-1 expression detected by flow cytometry in RPMVECs exposed to virus or TNF-α. A:control group;B:virus group; C:virus+XDY group; D:TNF-α group; E:TNF-α+XDY group.
图4流感病毒感染的RPMVECs中ICAM-1的表达

Figure 5. The VCAM-1 expression detected by flow cytometry in RPMVECs exposed to virus or TNF-α. A:control group;B:virus group; C:virus+XDY group; D:TNF-α group; E:TNF-α+XDY group.
图5流感病毒感染的RPMVECs中VCAM-1的表达
表1XDY对流感病毒感染的RPMVECs中ICAM-1和VCAM-1蛋白表达的影响
Table 1. Effects of XDY on the protein expression of ICAM-1 and VCAM-1 in RPMVECs exposed to virus or TNF-α (IA.Mean±SD.n=3)

GroupICAM-1VCAM-1Control1221.50±115.161514.40±111.90Virus2367.70±142.29△△2970.40±113.06△△Virus+XDY2066.50±113.13**2385.60±111.28**TNF-α4156.60±124.94△△2431.10±111.87△△TNF-α+XDY1163.20±114.93##2140.80±113.03##
△△P<0.01vscontrol group;**P<0.01vsvirus group;##P<0.01vsTNF-α group
VCAM-1又名可诱导性细胞黏附分子,不仅可以在IL-1、TNF-α、IFN-γ等炎症细胞因子的诱导下表达增加,其表达也能诱导细胞因子以及一些趋化因子的产生[14]。VCAM-1的表达也是非组成性的,在正常状态下表达很少或不表达。在细胞因子(如TNF-α、IL-1β等)或内毒素的刺激下表达于内皮细胞、上皮细胞以及树突状细胞的表面,同时可介导白细胞与内皮细胞的黏附,介导炎症反应由急性期转向慢性期的过度阶段中单核细胞的聚集[15]。
本研究发现XDY组黏附分子的表达在各个时点均低于模型组,证实了XDY能下调流感病毒引起的黏附分子的升高。前期研究证实XDY能抑制流感病毒感染肺组织中TNF-α的产生,而TNF-α又可诱导ICAM-1和VCAM-1的高表达。那么XDY降低ICAM-1和VCAM-1表达的作用是否与其对TNF-α的抑制有关呢?为此,本研究进一步观察了XDY对TNF-α刺激RPMVECs后ICAM-1、VCAM-1表达的影响,结果表明XDY能降低TNF-α所致黏附分子表达的升高。这说明不论对病毒还是炎症因子诱导的ICAM-1、VCAM-1高表达,XDY均有直接的抑制作用,从而证实了该方可作用于病毒感染后炎症级联反应中多个环节发挥治疗作用。该方抗炎作用中的具体环节及作用的分子机制,我们将在今后的研究中进一步探讨。
[1] Wang J, Oberley-Deegan R, Wang S, et al. Differentiated human alveolar type II cells secrete antiviral IL-29 (IFN-λ1) in response to influenza A infection[J]. J Immunol, 2009, 182(3):1296-1304.
[2] 吴 瑭. 温病条辨[M]. 第1版.北京:人民卫生出版社, 2005:63.
[3] 郝 钰, 李季倩, 吴 莹, 等. 犀角地黄汤合银翘散对流感病毒性肺炎小鼠肺病毒滴度和肺组织病理改变的影响[J]. 北京中医药大学学报, 2010, 33(11):739-744.
[4] Hayashi T, Hasegawa K, Ichinohe N. ICAM-1 expression on endothelium and systemic cytokine production in cutaneous neutrophilic leukocytoclastic vasculitis in NZBxNZWF1mice[J]. Histol Histopathol, 2005, 20(1):45-47.
[5] 黄帧祥. 医学病毒学基础及实验技术[M]. 第1版.北京:科学出版社, 1990:152.
[6] 姜 明, 金 岩, 刘 源, 等. 大鼠肺微血管内皮细胞培养方法的研究[J]. 实用口腔医学杂志, 2004, 20(1):24-26
[7] 吴 莹, 金叶智, 孟 建, 等. 犀角地黄汤合银翘散含药血清抑制流感病毒感染大鼠肺泡巨噬细胞致炎物质的研究[J]. 中华中医药杂志, 2010, 25(12):1974-1978.
[8] Krunkosky TM, Fischer BM, Martin LD, et al. Effects of TNF-α on expression of ICAM-1 in human airway epithelial cellsinvitro[J]. Am J Respir Cell Mol Biol, 2000, 22(6):685-692.
[9] Lawson C, Ainsworth M, Yacoub M, et al. Ligation of ICAM-1 on endothelial cells leads to expression of VCAM-1 via a nuclear factor-κB-independent mechanism[J]. J Immunol, 1999, 162(5):2990-2996.
[10] Osborn L, Hession C, Tizard R, et al. Direct expression cloning of vascular cell adhesion molecule 1, a cytokine induced endothelial protein that binds to lymphocytes[J]. Cell, 1989, 59(6):1203-1211.
[11] 杨 红, 斯 琴, 孙仁宇. 肺血管内皮细胞在大鼠急性肺损伤发生中的作用[J].中国病理生理杂志, 2000, 16(9):831-834.
[12] Zhou Z, Liu Y, Miao AD, et al. Protocatechuic aldehyde suppresses TNF-α-induced ICAM-1 and VCAM-1 expression in human umbilical vein endothelial cells[J]. Eur J Pharmacol, 2005, 513(1-2):1-8.
[13] Wang SZ, Smith PK, Lovejoy M, et al. Shedding of L-selectin and PECAM-1 and upregulation of Mac-1 and ICAM-1 on neutrophils in RSV bronchiolitis[J]. Am J Physiol, 1998, 275(5 Pt 1): L983-L989.
[14] 黄建林, 林灼锋, 罗敏琪,等. 青藤碱抑制TNF-α诱导人脐静脉内皮细胞VCAM-1表达[J].中国病理生理杂志, 2007, 23(4):634-638.
[15] Alevriadou BR. CAMs and Rho small GTPases:gatekeepers for leukocyte transendothelial migration.Focus on“VCAM-1-mediated Rac signaling controls endothelial cell-cell contacts and leukocyte transmigration”[J]. Am J Physiol Cell Physiol, 2003, 285(2):C250-C252.
EffectsofXijiaoDihuangandYinqiaoSandecoctiononICAM-1andVCAM-1expressioninmouselungtissuesandratpulmonarymicrovascularendothelialcellsinfectedwithinfluenzavirus
ZHANG Chen-yue, ZHANG Shu, WU Ying, KIM Ye-ji, LI Gen-mao, WANG Qian, HAO Yu
(SchoolofBasicMedicalSciences,BeijingUniversityofChineseMedicine,Beijing100029,China.E-mail:yuhao64@sina.com)
AIM: To investigate the effects of Xijiao Dihuang and Yinqiao San decoction (XDY) on the expression of intercellular adhesion molecule-1 (ICAM-1) and vascular cell adhesion molecule-1 (VCAM-1) in mouse lung tissues and rat pulmonary microvascular endothelial cells (RPMVECs) infected with influenza virus, and to explore its mechanism for treatment of viral pneumonia.METHODSFifty-four male BALB/c mice were randomly divided into normal group, model group and XDY group (n=18 in each group). The viral pneumonia model was established by intranasally dripping influenza A (H1N1) virus into the mice. The mice in XDY group were treated with XDY 1 h after dripping the virus. The expression of ICAM-1 and VCAM-1 in lung tissues was examined by immunohistochemical staining 2, 4 and 6 d after infection. On the other hand, RPMVECs were obtained from male Wistar rats and primarily cultured. The cells were randomly divided into control group, virus group, virus+XDY group, tumor necrosis factor α (TNF-α) group and TNF-α+XDY group. The mRNA and protein expression of ICAM-1 and VCAM-1 was evaluated by real-time PCR and flow cytometry 24 h after infection.RESULTSVirus exposure increased ICAM-1 and VCAM-1 expression in mouse lung tissues (P<0.01), and XDY treatment attenuated this effect (P<0.01). Virus and TNF-α both led to the increases in mRNA and protein expression of ICAM-1 and VCAM-1 in RPMVECs (P<0.01), which were also reduced by treatment with XDY (P<0.01).CONCLUSIONTreatment with XDY decreases virus-induced ICAM-1 and VCAM-1 expression, suggesting an important role of XDY in treatment of viral pneumonia.
Xijiao Dihuang and Yinqiao San decoction; Viral pneumonia; Influenza virus; Pulmonary microvascular endothelial cells; Intercellular adhesion molecule-1; Vascular cell adhesion molecule-1
R364.5
A
1000- 4718(2013)09- 1685- 06
2013- 05- 10
2013- 07- 17
国家自然科学基金资助项目(No.30772871)
△通讯作者 Tel: 010-64286973; E-mail: yuhao64@sina.com
10.3969/j.issn.1000- 4718.2013.09.026
