TNF-α增强人脐带间充质干细胞条件培养基的体外造血支持功能*
2013-10-24胡彩东韩之波杨舟鑫李丽娜罗伟峰及月茹王有为李扬秋韩忠朝
胡彩东, 韩之波, 杨舟鑫, 李丽娜, 罗伟峰, 及月茹, 王有为, 李扬秋, 韩忠朝,△
(1暨南大学第一临床医学院血液病研究所, 广东 广州 510632; 2中国医学科学院血液学研究所泰达生命科学技术研究中心, 天津 300457; 3中国医学科学院,北京协和医学院血液学研究所,实验血液学国家重点实验室, 天津 300020)
TNF-α增强人脐带间充质干细胞条件培养基的体外造血支持功能*
胡彩东1, 韩之波2,3, 杨舟鑫3, 李丽娜1, 罗伟峰1, 及月茹3, 王有为3, 李扬秋1, 韩忠朝1,2,3△
(1暨南大学第一临床医学院血液病研究所, 广东 广州 510632;2中国医学科学院血液学研究所泰达生命科学技术研究中心, 天津 300457;3中国医学科学院,北京协和医学院血液学研究所,实验血液学国家重点实验室, 天津 300020)
目的研究肿瘤坏死因子α(tumor necrosis factor α, TNF-α)刺激后所得的脐带间充质干细胞条件培养基对脐血CD34+细胞在半固体培养基中集落形成个数及种类的影响。方法将3~6代人脐带来源间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)以2×106接种到75cm2培养瓶中,其中刺激组加入TNF-α(10 g/L),48 h后收集上清作为条件培养基。Real-time PCR检测hUC-MSCs中各类造血因子mRNA的表达量。密度梯度离心法分离脐血单个核细胞,磁珠分选CD34+细胞,流式细胞术检测细胞纯度后分5组接种到6孔板内:TNF-α刺激hUC-MSC上清+不完全甲基纤维素培养基;hUC-MSC上清+不完全甲基纤维素培养基;TNF-α+DMEM/F12完全培养基+不完全甲基纤维素培养基;完全甲基纤维素培养基;DMEM/F12完全培养基+不完全甲基纤维素培养基。10 d后显微镜下计数各类集落形成单位(colony-forming unit, CFU)的数目,收集集落形成细胞,流式细胞术检测其表型特征。结果(1)TNF-α刺激后hUC-MSCs中粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)和白细胞介素6(interleukin-6, IL-6)mRNA表达上调。(2)两种条件培养组均可见粒系CFU(granulocyte CFU, CFU-G)、巨噬系CFU(macrophage CFU, CFU-M)和粒巨噬系CFU(granulocyte-macrophage CFU, CFU-GM),但TNF-α刺激组CFU-G和CFU-M的数目约为未刺激组的1.5倍,CFU-GM约为未刺激组的2倍;阳性对照组中除粒系、巨噬系集落外还可见红系集落;而DMEM/F12完全培养基加或不加TNF-α组10 d后均未见集落形成。(3)流式细胞术检测TNF-α刺激组与未刺激组集落细胞表型CD14、CD45和CD11b,未见明显差异。结论hUC-MSC上清作为条件培养基可在体外促进CD34+细胞分化增殖为髓系细胞,具有造血支持作用,TNF-α刺激后此作用增强。
间充质干细胞; 肿瘤坏死因子α; 造血支持
造血干/祖细胞的获得及恢复一直被认为是各类血液肿瘤治疗的关键,体外扩增造血干细胞后回输到长期化疗患者体内是主要治疗手段,早期的实验通过在长期培养体系中加入各种细胞因子如干细胞因子(stem cell factor, SCF)、白细胞介素(interleukin, IL)-3、IL-6、IL-1等来促进CD34+细胞自我更新及分化,为获得理想的造血祖细胞构成,体系中各类因子的种类及剂量一直是研究的热点。1989年Sutherland等[1]提取骨髓间充质干细胞作为滋养层细胞在体外行长期培养起始细胞(long-term culture-initiating cell, LTC-IC)实验,成功培养出造血集落,骨髓来源间充质干细胞(bone marrow-derived mesenchymal stem cells, BM-MSCs)显示出其独立的造血支持能力。随后的研究证实,间充质干细胞存在于骨髓组织中,通过分泌造血相关因子及细胞黏附作用等参与造血干细胞的自我增殖与分化,在造血系统微环境中发挥重要作用。2000年,Gerson等[2]将高剂量化疗后晚期乳腺癌患者自身MSCs及外周血祖细胞回输体内,发现在第8天患者可明显提高中性粒细胞及血小板数,且未发生毒性反应。2002年,Kadereit等[3]在MSCs作为滋养层细胞的LTC-IC实验中发现MSCs可促进CD34+细胞的扩增,同时通过调节BCL-2和P21降低造血干细胞的凋亡,而Noort等[4]提取胎肺MSCs与CD34+细胞同时移植入NOD/SCID小鼠体内,同样证实了MSCs促进CD34+细胞自我更新与分化的作用。脐带间充质干细胞由其易得性、易扩增及低免疫原性,其可利用性高于其它组织来源的间充质干细胞,而肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)作为一类重要的炎症因子,存在于各种病理生理反应中[5],其对hUC-MSCs的作用不容忽视。本研究通过TNF-α预先刺激hUC-MSCs,检测其因子分泌的变化对造血干细胞(hematopoietic stem cells,HSCs)增殖分化的影响,为完善hUC-MSCs造血支持作用的研究提供实验依据。
材 料 和 方 法
1主要试剂及仪器
DMEM/F12干粉培养基和胰酶购自Gibco;胎牛血清(fetal bovine serum,FBS)购自HyClone;人淋巴细胞分离液购自天津灏洋生物制品科技有限公司;TNF-α、甲基纤维素半固体培养基MethoCultTMH4230、H4435和人脐血CD34阳性分选试剂盒购自Stemcell;CD34-FITC (fluorescein isothiocyanate)、CD11b-PE (phycoerythrin)、CD19-PE、CD29-PE、CD54-PE、CD45-PE、CD73-PE、CD80-PE、CD86-PE、CD90-PE、CD105-PE、CD31-PE、CD117-PE、HLA-DR-PE和HLA-G-PE购自BD Biosciences;倒置相差显微镜 (Olympus);流式细胞仪(Becton Dickinson)。
2主要方法
2.1hUC-MSCs分离、培养、扩增和鉴定 脐带和脐血标本取自天津市中心妇产医院足月剖宫产新生儿,均经父母授权同意,母血检测肝炎病毒、艾滋病病毒、巨细胞病毒、梅毒、衣原体等病原学均为阴性。脐带用含青/链霉素的PBS充分冲洗去除残留血液,剪碎至(1~2)mm×1 mm×1 mm大小,依次用0.1%胶原酶Ⅱ和0.125%的胰蛋白酶于37 ℃各消化30 min,10%的人AB血清终止消化。消化混合物经细胞筛过滤,收集滤液至离心管,DMEM/F12培养基洗涤2次。最后将细胞重悬于含10%FBS的DMEM/F12完全培养基,按1×106/cm2的密度将其接种于T-75培养瓶中,37 ℃、5%CO2、饱和湿度培养箱内培养。细胞贴壁生长至80%~90%融合时,胰酶消化传代。收集80%~90%融合细胞,分别用FITC或PE标记的小鼠抗人单克隆抗体CD34、CD29、CD11b、CD19、CD45、CD54、CD73、CD80、CD86、CD90、CD105、CD31、CD117、HLA-G和HLA-DR孵育hUC-MSCs,以FITC-IgG和PE-IgG作为同型对照抗体,流式细胞术检测。
2.2hUC-MSCs条件培养液收集 复苏第3~5代hUC-MSCs,待细胞80%~90%融合时,胰酶消化细胞,台盼蓝计活细胞个数,取2×106个细胞,用10 mL含10%FBS的DMEM/F12培养基,刺激组加入TNF-α(10 μg/L),接种于75 cm2培养瓶中,置于37 ℃、5% CO2、饱和湿度的恒温箱中,培养48 h时后收集hUC-MSCs培养上清,用0.22 μm滤膜过滤,分装并冻存于-80 ℃备用。
2.3Real-time PCR检测hUC-MSCs各类造血相关因子基因表达 收集上述刺激组与未刺激组hUC-MSCs,提取RNA并逆转为cDNA,行real-time PCR检测粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、巨噬细胞集落刺激因子(macrophage colony-stimulating factor, M-CSF)、GM-CSF、干细胞因子(stem cell factor, SCF)、基质细胞衍生因子1(stromal-derived factor 1, SDF-1)和IL-6 mRNA表达量,反应条件为95 ℃ 2 min激活热启动酶,94 ℃ 15 s,60 ℃ 30 s,45个循环,60 ℃收集荧光信号。引物序列见表1。

表1 Real-time PCR引物序列
2.4分离纯化脐血CD34+细胞 收集足月妊娠脐血标本,获知情同意,病原学检测后PBS按1∶2的比例稀释,以2∶1的比例平铺至人淋巴细胞分离液上,2 300 r/min离心20 min,抽取中间的白膜层(单个核细胞层),PBS溶液洗涤2次。用人脐血CD34阳性分选试剂盒分选CD34+细胞。部分分选细胞CD34-FITC抗体标记,流式细胞术检测分选细胞纯度,余细胞用DMEM/F12重悬,浓度1×107/L。
2.5造血祖细胞集落培养 按以下分组接种以上CD34+细胞至6孔板:TNF-α刺激hUC-MSC上清+不完全甲基纤维素培养基;hUC-MSC上清+不完全甲基纤维素培养基;TNF-α+DMEM/F12完全培养基+不完全甲基纤维素培养基;完全甲基纤维素培养基;DMEM/F12完全培养基+不完全甲基纤维素培养基。每组2个复孔,终体积2 mL,其中条件培养液与甲基纤维素比例为1∶4,CD34+细胞悬液与终培养基体积比例为1∶10,于37 ℃、5%CO2,饱和湿度孵箱中培养,观察集落形成单位的形态和种类,第10天记录≥50个细胞组成的集落形成单位数量。
2.6流式细胞术检测分析 分别取第10天实验组中形成集落形成单位的细胞孵育抗CD11b-PE、CD45-PE和CD14-PE鼠抗人抗体,流式细胞术分析,结果由CellQuest软件处理,检测集落形成单位细胞的免疫表型。
3统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件进行两样本t检验,以P<0.05为差异有统计学意义。
结 果
1hUC-MSCs形态与表型特征
倒置显微镜观察到hUC-MSCs在2~4 h内即贴壁生长,纺锤形,2~3 d细胞增长达高峰,呈旋涡状排列。流式细胞术检测发现,细胞表面标志CD11b、CD19、CD34、CD45、HLA-G、CD80、CD86、CD117、CD31和HLA-DR为阴性;CD29、CD54、CD73、CD90和CD105为阳性,可认为所分选细胞为脐带间充质干细胞。
2Real-timePCR检测造血相关因子的表达
Real-time PCR检测TNF-α(10 μg/L)刺激48 h后脐带间充质干细胞各类造血相关因子mRNA表达的变化,其中刺激后G-CSF和IL-6表达量上调,差异有统计学意义;GM-CSF虽无统计学意义,主要是因为不同个体间差异较大,导致方差较大,见图1。

Figure 1. Quantitative analysis of G-CSF, M-CSF, GM-CSF, SCF, SDF-1 and IL-6 mRNA expression in control and TNF-α (10 μg/L)-stimulated hUC-MSCs. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图1TNF-α刺激组与未刺激组hUC-MSCs中G-CSF、M-CSF、GM-CSF、SCF、SDF-1和IL-6mRNA的相对表达量
3造血集落形成单位形态及集落数
流式细胞术检测分选细胞中CD34+细胞比例大于95%,见图2,符合后续实验要求。
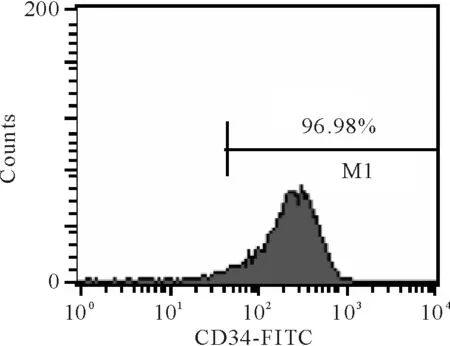
Figure 2. The frequency of the umbilical cord blood-derived CD34+cells after isolation assayed by flow cytometry.
图2脐血分选CD34+细胞纯度分析
倒置显微镜观察实验组、阳性对照组和阴性对照组集落形成情况。(1)阳性对照组与实验组均有集落形成,但各集落形成单位的种类和数量不同;只加入TNF-α组及阴性对照组未见集落形成单位。(2)实验组中可见粒系集落形成单位(granulocyte colony-forming unit,CFU-G)、巨噬系集落形成单位(macrophage colony-forming unit,CFU-M)和粒-巨噬集落形成单位(granulocyte-macrophage colony-forming unit,CFU-GM),未见红系爆式集落形成单位 (erythroid burst-forming unit,BFU-E)、红系集落形成单位(erythroid colony-forming unit,CFU-E)和粒-红-巨噬-巨核集落形成单位(granulocyte-erythroid-macrophage-megakaryocyte colony-forming unit,CFU-GEMM),阳性对照各系集落形成单位均可见,见图3。(3)计数刺激组与未刺激组各类集落数,差异有统计学意义,见图4。由此可见,hUC-MSC条件培养基单独作用能促进CD34+细胞的分化,即促进造血干细胞主要向除红细胞以外的髓系细胞分化,加入TNF-α后该作用加强。

Figure 3. CFU-M(A),CFU-G(B),CFU-GM (C),BFU-E(D) and CFU-GEMM(E) after cultured for 10 d in conditioned culture medium and positive control(×40).
图3条件培养基及阳性对照组培养第10天各类集落形态

Figure 4. The numbers of CFU formed by umbilical cord blood derived-CD34+cells in control and TNF-α stimulation group. Mean±SD.n=3.*P<0.05vscontrol.
图4刺激组与未刺激组条件培养基中集落细胞数比较
4集落形成单位的细胞免疫表型检测结果
收集第10天集落形成细胞,流式细胞术检测CD11b-PE、CD45-PE和CD14-PE,刺激组与未刺激组相比无明显差异,均高表达髓系标志CD45,见表2。
表2集落形成细胞表型分析
Table 2. Phenotypic characteristics of the colony-forming cells (%.Mean±SD.n=3)

GroupCD45CD14CD11bControl99.01±0.4640.16±5.1841.88±8.28TNF-α98.20±1.0337.57±2.4952.51±6.99
讨 论
骨髓造血微环境一般定义为基质干细胞、造血因子及细胞外基质,而其中主要的基质干细胞即BM-MSCs。BM-MSCs主要通过细胞-细胞接触及分泌各类造血相关蛋白因子发挥其造血支持作用,其中包括维持HSCs的稳定性,促进其自我更新及多向分化[6-7]。本实验主要收集TNF-α刺激48 h后hUC-MSC培养上清,体外检测其对CD34+细胞集落形成的影响,从分泌因子的角度考虑其造血支持能力。
一般认为TNF-α单独作用于造血集落是一种造血负调控因子,在体外实验中从1~100 U/mL的浓度,TNF-α对CFU-E、CFU-G、CFU-M、CFU-GM和CFU-GEMM表现出不同的抑制作用[8-10],然而动物实验中,直接注射TNF-α到正常及白血病小鼠体内,小鼠骨髓及脾脏CFU-M、CFU-GM及BFU-E表现为促进,仅CFU-E表现为抑制[11]。可见TNF-α对造血干/祖细胞的影响不能单独定论,其作用方向与其作用环境相关。G-CSF、M-CSF、GM-CSF、SCF、SDF-1和IL-6均为公认的造血相关因子,且在过去的研究中证实MSCs主要通过分泌造血相关因子,结合其基质成分调节造血功能[12-13]。本实验real-time PCR 结果显示hUC-MSCs本身表达上述各类因子,经TNF-α刺激48 h后G-CSF、M-CSF、GM-CSF和IL-6表达量上调或具有上调趋势,这与集落形成中对照组与刺激组均形成集落且刺激组CFU-GM较未刺激组大约两倍的结果相符。由此可见,hUC-MSCs单独具有促进CD34+细胞分化为造血祖细胞形成造血集落的功能,而TNF-α刺激后通过上调其造血因子的表达加强此作用,且此加强作用远远超过了TNF-α本身对上述集落形成的抑制作用。此外,TNF-α刺激hUC-MSCs后,其表达SCF下调,我们认为这是间充质干细胞置身于类似炎症微环境中,表现出与各类血细胞类似的分化成熟趋势,但并未改变其基本性状,相反有可能激发了其它因子的分泌。同时刺激前后hUC-MSCs均未检测到促红细胞生成素(erythropoietin, EPO),这可能与MSCs本身特性有关,在以往实验中BM-MSCs同样未检测到EPO表达,有报道显示BM-MSCs与CD34+共培养体系集落形成实验中可形成BFU-E,但其数量相对于粒系集落则少之又少。且Roodman等[9]在体外实验中证实TNF-α刺激15 min后即表现出对CFU-E和BFU-E形成的抑制效果,同时不同个体红系集落对TNF-α的敏感性差异达上百倍。本实验最后收集记录形成在流式细胞术中CD45的近乎全阳性表达的结果与上述RT-PCR结果是相符的。因此我们认为本实验中无红系集落形成可能与hUC-MSCs本身支持红系分化较弱[14]及TNF-α对CFU-E的抑制作用有关[15]。综合来看,我们可以认为TNF-α在体内实验中出现与体外实验相反结果可以用其在体内与MSCs相互作用来解释,即与本实验结果相符。
鉴于本实验仅收集培养上清而无hUC-MSCs与CD34+细胞共培养,即无细胞间直接接触作用,其中hUC-MSCs对造血干细胞的作用仅限其分泌的因子,与经典的LTC-IC实验结果可能有出入,但足以说明hUC-MSCs间接对造血干/祖细胞的作用,即hUC-MSCs能通过分泌造血相关因子促进造血集落形成,TNF-α通过上调hUC-MSCs的G-CSF、M-CSF、GM-CSF和IL-6表达量加强其造血支持作用,而深入、更全面的TNF-α对hUC-MSCs造血支持能力的影响有待于体内试验的开展。
[1] Sutherland HJ, Eaves CJ, Eaves AC, et al. Characterization and partial purification of human marrow cells capable of initiating long-term hematopoiesisinvitro[J]. Blood,1989,74(5):1563-1570.
[3] Kadereit S, Deeds LS, Haynesworth SE, et al. Expansion of LTC-ICs and maintenance of p21 and BCL-2 expression in cord blood CD34+/CD38-early progenitors cultured over human MSCs as a feeder layer[J]. Stem Cells,2002,20(6):573-582.
[4] Noort WA, Kruisselbrink AB, in’t Anker PS, et al. Mesenchymal stem cells promote engraftment of human umbilical cord blood-derived CD34+cells in NOD/SCID mice[J]. Exp Hematol,2002,30(8):870-878.
[5] Satomi N, Haranaka K, Kunii O. Research on the production site of tumor necrosis factor (TNF)[J]. Jpn J Exp Med,1981,51(6):317-322.
[6] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science,1999,284(5411):143-147.
[7] Mendez-Ferrer S, Michurina TV, Ferraro F, et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche[J]. Nature,2010,466(7308):829-834.
[8] Broxmeyer HE, Williams DE, Lu L, et al. The suppressive influences of human tumor necrosis factors on bone marrow hematopoietic progenitor cells from normal donors and patients with leukemia: synergism of tumor necrosis factor and interferon-gamma[J]. J Immunol,1986,136(12):4487-4495.
[9] Roodman GD, Bird A, Hutzler D, et al. Tumor necrosis factor-alpha and hematopoietic progenitors: effects of tumor necrosis factor on the growth of erythroid progenitors CFU-E and BFU-E and the hematopoietic cell lines K562, HL60, and HEL cells[J]. Exp Hematol,1987,15(9):928-935.
[10] Beran M, O’Brien S, Gutterman JU, et al. Tumor necrosis factor and human hematopoiesis: I. Kinetics and diversity of human bone marrow cell response to recombinant tumor necrosis factor alpha in short-term suspension culturesinvitro[J]. Hematol Pathol,1988,2(1):31-42.
[11] Johnson CS, Chang MJ, Furmanski P.Invivohematopoietic effects of tumor necrosis factor-alpha in normal and erythroleukemic mice: characterization and therapeutic applications[J]. Blood,1988,72(6):1875-1883.
[12] Sze SK, De Kleijn DP, Lai RC, et al. Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells[J]. Mol Cell Proteomics,2007,6(10):1680-1689.
[13] 毛文哲, 许 超, 李扬秋, 等. 长期培养人脐带间充质干细胞PCNA、IL-6、IL-11和galectin-3的表达[J]. 中国病理生理杂志,2012,28(6):1051-1056.
[14] 莫世静, 童秀珍, 钟 茜, 等. 骨髓间充质干细胞通过上调EPO表达减轻缺氧损伤引起的PC12细胞凋亡[J]. 中国病理生理杂志,2013,29(1):62-69.
[15] Chen HW, Chen HY, Wang LT, et al. Mesenchymal stem cells tune the development of monocyte-derived dendritic cells toward a myeloid-derived suppressive phenotype through growth-regulated oncogene chemokines[J]. J Immunol,2013,190(10):5065-5077.
TNF-αenhanceshematopoiesis-supportiveeffectofconditionedculturemediumfromhumanumbilicalcord-derivedMSCsinvitro
HU Cai-dong1, HAN Zhi-bo2,3, YANG Zhou-xin3, LI Li-na1, LUO Wei-feng1, JI Yue-ru3, WANG You-wei3, LI Yang-qiu1, HAN Zhong-chao1, 2, 3
(1InstituteofHematology,theFirstClinicalMedicalCollege,JinanUniversity,Guangzhou510632,China;2TEDALifeScienceandTechnologyResearchCenter,InstituteofHematology,ChineseAcademyofMedicalSciences,Tianjin300457,China;3StateKeyLaboratoryofExperimentalHematology,InstituteofHematology,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Tianjin300020,China.E-mail:hanzhongchao@hotmail.com)
AIM: To study the influence of tumor necrosis factor-alpha (TNF-α)-stimulated conditioned culture medium from human umbilical cord-derived mesenchymal stem cells (hUC-MSCs) on the colony-forming ability of umbilical cord blood CD34+cells in semisolid medium.METHODSThe hUC-MSCs were cultured in 75-cm2culture flasks at a concentration of 2×106cells per flask, with or without TNF-α (10 μg/L), and their culture supernatants were harvested as the conditioned culture medium 48 h later. The hUC-MSCs were collected and their RNA was extracted. Real-time PCR was performed to detect the mRNA expression of hematopoietic factors. Umbilical cord blood mononuclear cells were isolated by Ficoll-Paque density gradient centrifugation, and then CD34+cells were isolated using Human Cord Blood CD34 Positive Selection Kit. The CD34+cells were divided into the following five groups: TNF-α group (TNF-α-stimulated hUC-MSC culture supernatant added into incomplete methylcellulose medium), control group (unstimulated hUC-MSC culture supernatant added into incomplete methylcellulose medium), positive group (complete methylcellulose medium with recombinant human cytokines), TNF-α+DMEM/F12 group (TNF-α and DMEM/F12 medium with 10% FBS added into incomplete methycellulose medium) and DMEM/F12 group (DMEM/F12 medium with 10% FBS added into incomplete methycellulose medium). Ten days later, the number of the colony-forming units (CFU) was counted, and the cells were collected to detect the surface markers by flow cytometry.RESULTS(1) TNF-α stimulation significantly up-regulated the mRNA expression of granulocyte colony-stimulating factor (G-CSF) and interleukin-6 (IL-6) in hUC-MSCs. (2) Granulocyte CFU (CFU-G), macrophage CFU (CFU-M) and granulocyte-macrophage CFU (CFU-GM) were observed in both TNF-α and control groups. The numbers of CFU-G and CFU-M in TNF-α group were 1.5 times as large as those in control group, and the number of CFU-GM in TNF-α group was even twice as large as that in control group. Granulocyte-erythroid-macrophage-megakaryocyte CFU (CFU-GEMM) and erythroid burst-forming units (BFU-E) were only observed in positive group, and no CFU was observed in TNF-α+DMEM/F12 and DMEM/F12 groups. (3) Flow cytometry showed no differences of CD14, CD45 and CD11b expression on the colony-forming cells between TNF-α and control groups.CONCLUSIONTNF-α can enhance the hematopoiesis-supportive effect of conditioned culture medium from hUC-MSCsinvitro.
Mesenchymal stem cells; Tumor necrosis factor-alpha; Hematopoiesis
R363
A
1000- 4718(2013)09- 1679- 06
2013- 05- 10
2013- 07- 15
国家重大科学计划“973计划”(No.2011CB964800)
△通讯作者 Tel:022-23909172;E-mail:hanzhongchao@hotmail.com
10.3969/j.issn.1000- 4718.2013.09.025
