不同环境温度对精氨酸加压素引起的大鼠低温的影响及其与尾部散热变化的关系*
2013-10-24杨永录杨春涛
杨永录, 卜 舒, 杨春涛, 张 洁, 汪 诚
(成都医学院体温与炎症四川省高校重点实验室,四川 成都 610500)
不同环境温度对精氨酸加压素引起的大鼠低温的影响及其与尾部散热变化的关系*
杨永录△, 卜 舒, 杨春涛, 张 洁, 汪 诚
(成都医学院体温与炎症四川省高校重点实验室,四川 成都 610500)
目的探讨不同环境温度对精氨酸加压素(AVP)引起的大鼠低温及其与尾部散热变化的关系,以确定是否外周给予AVP能提高大鼠尾部散热反应。方法实验用成年雄性SD大鼠,在3种不同环境温度(12 ℃、22 ℃和32 ℃)下,用无线遥测技术连续记录体核温度和尾部皮肤温度。上午10:00给大鼠腹腔注射AVP(10 μg/kg)或V1a受体阻断剂(30 μg/kg)。同时观察AVP或V1a受体阻断剂对大鼠背斜方肌微血管直径和理毛行为的影响。结果(1)在3种不同环境温度中,AVP引起大鼠低温均伴有尾部皮肤温度降低反应。(2) V1a受体阻断剂能够阻断AVP引起低温和尾部皮肤温度降低效应。(3)AVP能明显引起背斜方肌微血管收缩反应。(4)AVP能提高大鼠的理毛行为(唾液理毛),而且这种作用也能被外周给予V1a受体阻断剂所阻断。(5)内源性AVP不参与正常大鼠尾部散热过程。结论外周给予AVP引起大鼠低温,不是由于其降低了体温调定点,可能是由于其抑制了体温调节性产热和提高唾液理毛活动以增加体表蒸发散热所致。
精氨酸加压素; 低温; 尾部皮肤温度; 散热; 理毛行为
精氨酸加压素(arginine vasopressin,AVP)在正常体温调节中有重要的作用[1-3]。往动物大脑腹中隔区注射AVP能引起正常体温降低;当狗的前脑基底部局部受热时,可见血浆中AVP浓度明显升高;视前区及隔区受热时,AVP升高尤其明显;若将动物暴露于冷环境中或冷却同样部位时,可抑制AVP的释放和降低血浆中AVP浓度[1-3]。外周注射AVP也可引起正常体温降低,而注射精氨酸加压素V1受体阻断剂可导致正常体温升高[2,4-5]。许多研究者报告,AVP引起低温与AVP抑制棕色脂肪产热和提高尾部皮肤散热有关[1,3,6]。所以,研究者认为AVP引起的低温反应是体温调定点降低所致[1-3]。
但是,众所周知AVP对外周血管有强烈的收缩作用,外周血管收缩能使皮肤血流量降低,而引起皮肤散热减少[7]。另外,以往的研究是使用热电偶温度计测量尾部皮肤温度[1-3],这种人工测量方法可引起动物应激性体温变化,而影响实验结果的准确性[8-9]。所以,我们认为AVP引起低温反应与皮肤散热的关系需要进一步研究。为此,本实验用无线遥控测温技术连续测量大鼠体核温度和尾部皮肤温度的变化,首先观察AVP引起低温反应与尾部皮肤散热变化的关系以及不同环境温度对其效应的影响;然后观察了AVP和V1a阻断剂对大鼠背斜方肌微血管直径和理毛行为的影响。
材 料 和 方 法
1动物、药品和试剂
实验用成年雄性SD大鼠(四川医学科学院实验动物研究所提供)176只,体重220~310 g。AVP和V1a受体阻断剂均为Sigma产品。
2双探头无线遥测温度传感器的植入方法
使用Model TA10TA-F40无线遥测温度传感器(DSI) 连续测量大鼠体核温度的变化。
术前用1%碘伏溶液浸泡手术器械和传感器60 min以上,腹腔注射4%戊巴比妥钠溶液(40 mg/kg)麻醉动物,剃去腹部手术部位的鼠毛,将动物置于大鼠手术台上,用碘伏常规消毒腹部手术部位,在腹中部正中线做1.5 cm切口,将无线遥测传感器植入腹腔。手术结束后,给大鼠肌肉注射青霉素(2×104U)以防感染,然后至少让动物恢复7 d以上再进行实验。
3大鼠尾部皮肤温度的测量
将无线遥控测温探头固定于大鼠尾部背侧距根部1.5 cm处,用无线遥控测温系统间隔5 min测量1次大鼠尾部皮肤温度[9]。
散热反应指标用散热指数(heat loss index,HLI)表示[9],HLI=(Tsk-Ta)/(Tc-Ta)。HLI可以排除环境温度(Ta)和体核温度(Tc)对皮肤温度(Tsk)的影响,正常值为0~1。当HLI值为0时,表示皮肤血管完全处于收缩状态;HLI值为1时,表示皮肤血管完全处于舒张状态。
4实验分组与步骤
用无线遥控测温系统测量大鼠体核温度。将体内置有无线温度遥测探头的大鼠放入清洁鼠笼内,然后置于遥控测温系统的接收板上。大鼠体内无线遥测探头间隔5 min采集1次温度信号,经遥测接收板接收后,输入计算机储存和数据处理。
实验前1 d下午,将大鼠称体重后,置于22 ℃人工气候箱内(重庆永生实验仪器厂产品)进行适应性过夜,动物处于自由活动、进食和进水状态。气候箱内昼光期和暗光期时间各12 h,即6:00~18:00开灯,18:00~次日06:00关灯。
实验当天,根据实验的需要将人工气候箱的温度分别设置为12 ℃、22 ℃或32 ℃。所有实验均在06:00开始记录大鼠体核温度和尾部皮肤温度,给药时间为10:00。
实验分为两部分:(1)观察AVP对正常大鼠体核温度和尾部皮肤温度的影响。实验分为AVP组和对照组。AVP组:腹腔分别注射AVP 1、5 或10 μg/kg (1、5 或10 mg/L盐水);对照组:腹腔注射无菌生理盐水1 mL/kg。(2)观察V1a受体阻断剂对正常大鼠体核温度和尾部皮肤温度的影响。V1a受体阻断剂组:腹腔注射V1a受体阻断剂30 μg/kg(30 mg/L盐水);对照组动物同实验(1)。
5大鼠背斜方肌微血管直径变化的观察
实验用雄性大白鼠,体重100~120 g,用400 mg/kg戊巴比妥钠麻醉动物,大鼠背部去毛,自颈部至腰部沿脊柱中线做皮肤切口,将肌肉筋膜轻轻剥离,在肌肉侧面做一小切口,并用小弯剪轻轻剥开肌肉游离面(沿肩胛线),小剪刀伸向肌肉底部将其完全与底层肌肉剥离[10]。这样就得到一个宽为1.5 cm左右的游离肌肉瓣,观察时使动物侧卧位。用Olympus公司SZX16型体视显微镜和DP70型摄像头,观察AVP对大鼠背斜方肌微循环的影响。
6大鼠理毛行为的观察
大鼠理毛行为的观察是在长居鼠笼中进行,避免更换鼠笼引起应激反应而影响理毛活动。观察理毛行为的指标主要包括咀嚼、后足搔抓、洗脸(移动前肢梳洗鼻口部、眼部和耳部)和梳理清洁全身(用舌舔体表的毛和皮肤);观察理毛行为的方法是计算15 s内理毛活动的次数,重复5次取平均值[11]。以给药前的理毛次数作为对照值,观察腹腔注射生理盐水、AVP或V1a受体阻断剂后大鼠理毛活动的变化,每次测量间隔时间为10 min。
7统计学处理
数据用均数±标准差(mean±SD)表示,用SPSS 13.0软件分析,各处理组之间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1AVP对大鼠体核温度和尾部皮肤温度的影响
给药前各组体核温度和各组尾部皮肤温度之间无明显差异,见图1。对照组给予盐水后,体核温度出现快速而短暂的体温升高反应,尾部皮肤温度则出现短暂的降低反应。这种现象是由于注射刺激和移动动物而引起的应激性反应。给予大鼠分别给AVP 1、5和10 μg/kg可引起大鼠体核温度出现剂量依赖性降低,给药35 min后,分别较对照组降低(0.73±0.12) ℃、(1.36±0.15)℃ 和(1.52±0.14) ℃,见图1。 给予AVP 1、5和10 μg/kg也可引起大鼠尾部皮肤温度出现剂量依赖性的快速降低反应,给药60 min后,分别较对照组降低达(1.85±0.17)℃、(2.58±0.19)℃ 和(3.55±0.23)℃,见图1。另外,同时也观察到AVP引起低温反应时,鼠耳血管明显变细,皮肤颜色变白,这种反应持续15~18 min。进一步分析发现,散热指数也明显降低。腹腔注射AVP 1 μg/kg 45 min后,HLI降低0.12 U;注射AVP 5和10 μg/kg 60 min后,分别降低了0.18和0.22 U,见图2。
2环境温度对AVP引起体核温度和尾部皮肤变化的影响
将大鼠置于12 ℃环境温度中,体核温度为(36.60±0.18)℃,与22 ℃中性温度的体核温度(36.88±0.25) ℃比较无明显差异;尾部皮肤温度为(26.45±0.45)℃,较22 ℃环境中动物尾部皮肤温度降低2.3 ℃,HLI升高0.11 U,见图3。腹腔注射AVP 10 μg/kg 后,体核温度和尾部皮肤温度分别降低2.28 ℃ 和5.62 ℃,其降低幅度明显大于22 ℃环境中AVP引起体核温度(1.52 ℃)和尾部皮肤温度(3.55 ℃)下降的幅度;HLI降低0.23U,与22 ℃环境中大鼠HLI比较无明显差异,见图3。
将大鼠置于32 ℃高温环境温度中,体核温度和尾部皮肤温度分别为(37.42±0.16) ℃和(33.31±0.36)℃,与22 ℃中性温度的体核温度和尾部皮肤温度比较分别升高1.2 ℃和4.4 ℃,HLI则降低0.21 U,见图4。腹腔注射AVP 10 μg/kg 后,体核温度和尾部皮肤温度分别只降低1.03 ℃和1.48 ℃,其降低幅度均明显低于22 ℃和12 ℃环境中的体核温度和尾部皮肤温度下降的幅度;HLI降低0.20 U,与22 ℃和12 ℃环境温度中大鼠HLI比较无明显变化,见图4。

Figure 1. Effects of intraperitoneal injection of different doses of AVP (1, 5 and 10 μg/kg) on core and tail skin temperatures. Mean±SD. ANOVA between saline and 1 μg/kg AVP for 60 min: core temperature,P<0.05; tail skin temperature,P<0.01. ANOVA between 5 and 10 μg/kg AVP for 90 min: core temperature,P<0.01; tail skin temperature,P<0.01.
图1腹腔注射不同剂量AVP对大鼠体核温度和尾部皮肤温度的影响
3V1a受体阻断剂对AVP引起的大鼠体核温度和尾部皮肤温度变化的影响
腹腔注射V1a受体阻断剂(30 μg/kg)能明显阻断AVP引起尾部皮肤温度降低反应和低温反应,见图5。

Figure 2. Time-course of heat loss index of rats treated with saline or AVP. Mean±SD.
图2给大鼠注射生理盐水或AVP引起散热指数变化的时间曲线
4AVP对大鼠背斜方肌微血管直径的影响
腹腔注射AVP 10 μg/kg 2 min后,大鼠背斜方肌微血管出现收缩反应,注射8~10 min后,微血管直径从(21±5) μm 减少到(13±2) μm,然后逐渐恢复,到注射后18~20 min恢复到基线水平,见图6。
5V1a受体阻断剂对AVP引起大鼠理毛行为变化的影响
给大鼠腹腔注射AVP 40 min后,其理毛活动明显增加,从给药前的(4.67±0.68) 次/15 s 增加至(26.80±4.08) 次/15 s;而V1a受体阻断剂可以完全阻断AVP引起的理毛活动变化,见表1。
讨 论
AVP能引起正常体温降低[1-5]。许多学者认为,中枢和外周给AVP引起的低温反应与其能抑制BAT产热和提高尾部散热反应有关[1-3,5-6]。但众所周知,VP是一种强烈的血管收缩剂,可引起皮肤血管收缩,使皮肤血流量降低,皮肤颜色出现苍白现象[7,10]。鉴于AVP对皮肤血管有强烈的收缩作用,我们首先观察了外周给予AVP引起大鼠低温反应与尾部皮肤温度变化的关系,因为皮肤温度的变化与皮肤血管收缩引起血流量的变化有密切关系[12]。实验发现,给大鼠腹腔注射不同剂量AVP可引起剂量依赖性低温反应,但出乎意料的是外周给予AVP不仅未引起大鼠尾部温度升高,而且出现剂量依赖性的快速降低反应;同时也观察到大鼠耳部皮肤颜色明显变白。本实验结果与文献报道的中枢和外周给予AVP能引起大鼠尾部皮温升高的实验结果完全相反,即给大鼠分别腹腔注射AVP 1 μg、5 μg或10 μg/kg均能引起皮肤血管收缩,使尾部血流量减少而导致尾部皮肤温度降低。由于AVP是通过V1a受体引起低温和血管收缩,实验也观察了V1a受体阻断剂对AVP引起低温和尾部皮肤温度降低反应的影响,给予V1a受体阻断剂可以明显阻断AVP引起的低温和尾部皮肤温度降低反应,这一结果支持了外周给予AVP不提高大鼠尾部散热反应的实验结果。
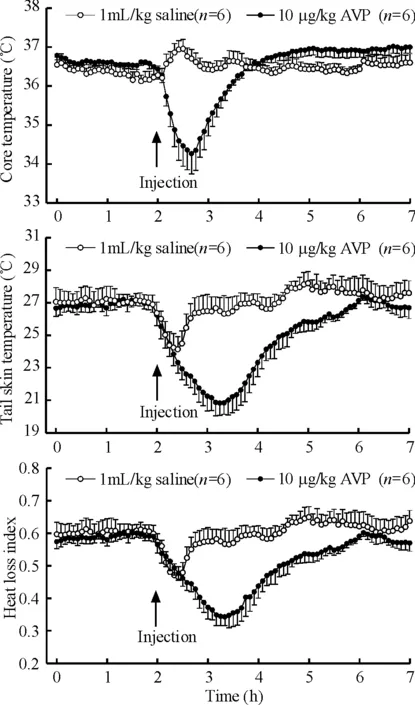
Figure 3. Effects of AVP on core temperature, tail skin temperature and heat loss index in the rats at an ambient temperature of 12 ℃.Mean±SD.
图3AVP对12℃环境温度中大鼠体核温度和尾部皮温以及散热指数的影响
A

Figure 4. Effects of AVP on core temperature, tail skin temperature and heat loss index in the rats at an ambient temperature of 32 ℃.Mean±SD.
图4AVP对32℃环境温度中大鼠体核温度与尾部皮温以及散热指数的影响
内源性AVP对正常大鼠体温有紧张性调节作用[5,13]。实验给大鼠腹腔注射V1a受体阻断剂能明显提高体核温度,这一结果与我们以往的研究结果一致[5,13];但V1a受体阻断剂对尾部皮肤温度无明显影响,证明内源性AVP也不参与调节大鼠尾部散热过程。实验结果也是对外源性AVP不参与调节大鼠尾部散热实验结果的有力支持。
药物和化学物质对体温调节功能的影响与环境温度和皮肤温度变化有密切的关系[12]。为此,我们又观察了32 ℃和12 ℃环境温度对AVP引起低温和皮肤温度降低的影响。给置于32 ℃和12 ℃环境中大鼠分别腹腔注射AVP后,不仅均可引起明显的低温反应,而且同样也引起尾部皮肤温度明显降低现象,与22 ℃环境中的实验结果相似。这一结果进一步证明,在AVP引起大鼠低温反应过程中不提高尾部散热反应。但仔细分析实验结果可以看出,在32 ℃环境中,对照组大鼠体核温度时间曲线和AVP组体核基线温度以及尾部皮肤基线温度均明显高于22 ℃环境中的实验结果;虽然AVP能引起体核温度和尾部皮肤温度明显降低,但其降低幅度均小于22 ℃环境中的实验结果,出现这种实验现象与大鼠在32 ℃环境中皮肤温度与环境温度的温差减小,使皮肤散热降低有关[12];另外,体核与皮肤的温差必须在5 ℃以上才能使体内热传导到体表[14],而本实验在32 ℃环境中大鼠体核基线温度与尾部皮肤基线温度的温差只有4.09 ℃,这样也影响了机体正常散热。

Figure 5. Effects of intraperitoneal administration of saline or V1a receptor antagonist (V1a-ANT) on core and tail skin temperatures after treatment with AVP.Mean±SD.
图5腹腔注射生理盐水或V1a受体阻断剂对AVP引起大鼠体核温度和尾部皮肤变化的影响
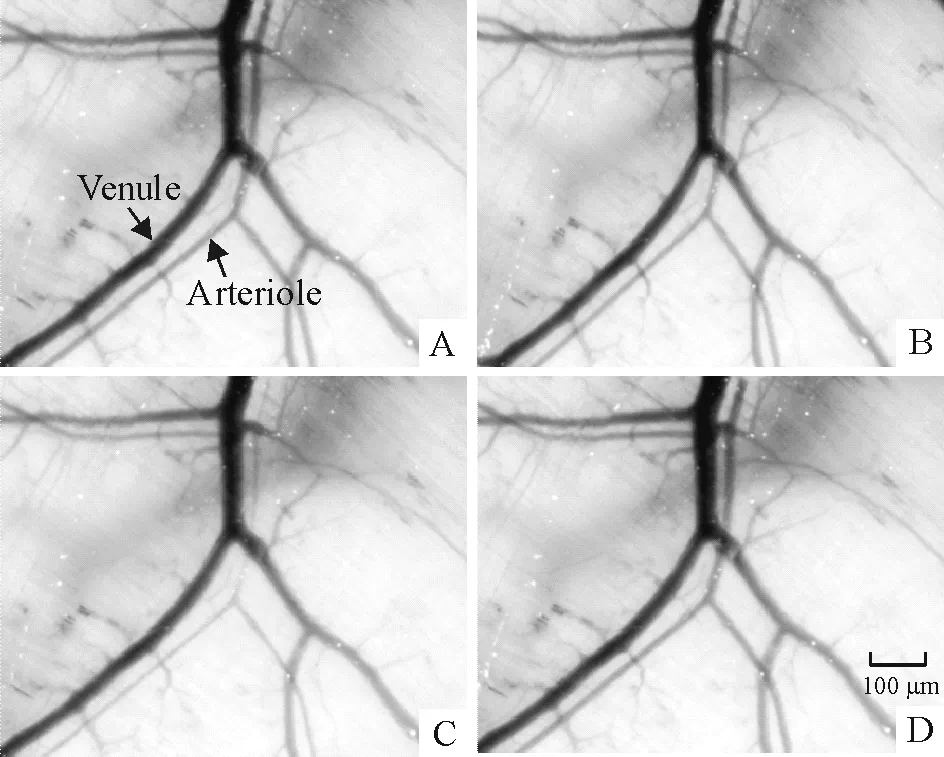
Figure 6. Effect of AVP on microvascular diameter in rat spinotrapezius muscle. A: baseline; B, C and D: 5, 10 and 20 min after AVP treatment, respectively.
图6AVP对大鼠背斜方肌微血管直径的影响
表1腹腔注射AVP和V1a阻断剂对大鼠理毛活动的影响
Table 1. Effects of intraperitoneal injection of arginine vasopressin(AVP) and vasopressin V1a receptor antagonist (V1a-ANT) on grooming activities in rats (counts per 15 s. Mean±SD)
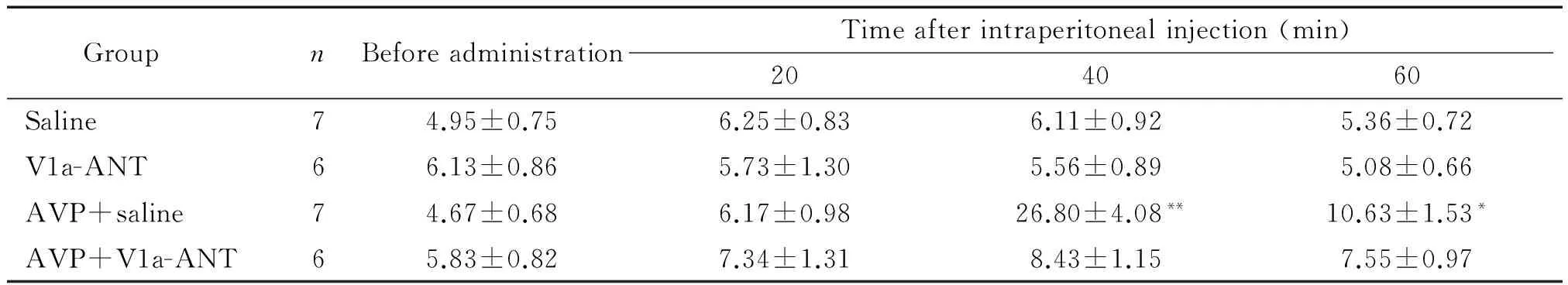
GroupnBeforeadministrationTimeafterintraperitonealinjection(min)204060Saline74.95±0.756.25±0.836.11±0.925.36±0.72V1a-ANT66.13±0.865.73±1.305.56±0.895.08±0.66AVP+saline74.67±0.686.17±0.9826.80±4.08**10.63±1.53*AVP+V1a-ANT65.83±0.827.34±1.318.43±1.157.55±0.97
*P<0.05,**P<0.01vssaline group.
在12 ℃环境中,大鼠体核基线温度与22 ℃环境中体核基线温度无明显差异;但尾部皮肤基线温度明显低于22 ℃环境中的尾部皮肤基线温度。这是由于当环境温度低于热中性温度区时,一方面环境温度降低可引起机体战栗或非战栗产热增加,以补充散失的热量,使体温保持恒定;另一方面能引起外周血管收缩使皮肤血流量减少以及环境温度降低引起的皮肤散热量增加,而致皮肤温度降低[12]。腹腔注射AVP引起的低温反应和尾部皮肤温度降低反应均明显大于22 ℃环境中的实验结果,说明环境温度低于热中性温度区能促进AVP引起的低温反应和进一步降低尾部皮肤温度,这可能与环境温度降低有利于机体散热有关[12]。另外,AVP能抑制棕色脂肪组织(brown adipose tissue,BAT)产热以及抑制体内脂肪分解使脂代谢产生的能量减少也是重要的原因之一[4-6]。
为了确定是否外周注射AVP可以引起大鼠外周血管收缩而引起皮肤温度降低,我们观察了AVP对大鼠背斜方肌微血管直径的影响,因为大鼠背斜方肌是研究血管活性物质和药物对外周表浅血管影响的一个理想部位[10]。我们观察到给大鼠腹腔注射AVP后能明显减小背斜方肌微血管的直径,说明AVP引起的尾部皮肤温度降低与皮肤血管收缩和血流量减少有关。
这里需要指出的是本实验用无线遥控测温技术连续测量AVP对正常大鼠尾部皮肤温度影响的结果与以往人工测量的结果完全不同,即AVP能引起外周血管收缩而使皮肤温度降低。为什么以往用热电偶或电子温度计测量的结果是AVP引起大鼠尾部皮肤温度升高[1-3,5-6]?要解释这样的实验结果是困难的,因为AVP能引起外周血管收缩导致尾部血流量降低[7,15]。一种可能的解释是由于以往的研究者是人工反复测量直肠温度和尾部皮肤温度,这样的操作过程能引起应激性的体核温度变化和尾部皮肤温度变化,可能导致实验结果出现虚假现象[8,16]。
啮齿类动物无出汗和喘息蒸发散热的功能[17],主要是通过尾部皮肤、唾液分泌与唾液蒸发引起机体散热[9,17]。然而有趣的是本实验发现,外源性和内源性AVP不调节尾部皮肤散热过程。有文献报告,中枢给予AVP能提高大鼠的理毛活动[18]。本实验外周给AVP也能引起大鼠理毛活动明显增加,而V1a受体阻断剂能完全阻断AVP的这种效应。实验充分说明,外周给予AVP引起的理毛活动可能在AVP引起的低温中有重要的作用, 因为唾液通过理毛而润湿皮肤引起蒸发散热的效应与出汗蒸发散热效应相似[17]。
综上所述,本实验结果不支持以往中枢和外周给予AVP引起的低温反应是由于体温调定点下移所致的假设,因为本实验用不同剂量AVP以及在不同环境温度下AVP引起的低温均伴有尾部皮肤散热反应降低现象。如果AVP引起大鼠低温反应与体温调定点降低有关,应该伴有尾部散热增加反应。最近我们实验室证明,AVP能兴奋视前区/下丘脑前部(preoptic area/anterior hypothalamus,PO/AH)热敏神经元和抑制冷敏神经元的活动[19]。所以,我们认为AVP 引起低温反应主要是由于AVP能兴奋PO/AH热敏神经元和抑制冷敏神经元的活动[19],而引起BAT产热较少[4-6],降低脂肪分解使脂代谢产生的能量减少[4-5]和促进理毛活动引起散热增加有关。
[1] Richmond CA. The role of arginine vasopressin in thermoregulation during fever[J]. J Neurosci Nurs, 2003, 35 (5): 281-286.
[2] Pittman QJ, Chen X, Mouihate A, et al. Arginine vasopressin, fever and temperature regulation[J]. Prog Brain Res, 1998,119: 383-392.
[3] 杨永录,沈字玲,黄 涛. 精氨酸加压素在调节性低温中的作用及其机制的研究进展[J]. 成都医学院学报, 2009, 4(1): 61-65.
[4] Yang YL, Wang N, Shen ZL, et al. Simultaneous telemetric monitoring of the circadian changes in core and BAT temperature in rats: endogenous vasopressin may contribute to reduced BAT thermogenesis and body temperature in the light phase of the circadian cycle[J]. J Therm Biol, 2012, 37 (4): 316-332.
[5] 杨永录, 赖 雁,唐 瑜,等. 内源性精氨酸加压素在昼光期大鼠紧张性体温调节中的作用[J]. 中国病理生理学志,2011,27(12): 2558-2564.
[6] Paro FM, Almeida MC, Carnio EC, et al. Role of L-glutamate in systemic AVP-induced hypothermia[J]. J Appl Physiol, 2003, 94(1): 271-277.
[7] Dünser MW, Mayr AJ, Tur A, et al. Ischemic skin lesions as a complication of continuous vasopressin infusion in catecholamine-resistant vasodilatory shock: incidence and risk factors[J]. Crit Care Med, 2003, 31(5): 1394-1398.
[8] Dallmann R, Steinlechner S, von Hörsten S. Stress-induced hyperthermia in the rat: comparison of classical and novel recording methods[J]. Lab Anim, 2006,40(2): 186-193.
[9] Gordon CJ, Puckett E, Padnos B. Rat tail skin temperature monitored noninvasively by radiotelemetry: characterization by examination of vasomotor responses to thermomodulatory agents[J]. J Pharmacol Toxicol Methods, 2002, 47(2): 107-114.
[10] Friesenecker B, Tsai AG, Dunser MW, et al. Oxygen distribution in microcirculation after arginine vasopressin-induced arteriolar vasoconstriction[J]. Am J Physiol Heart Circ Physiol, 2004, 287(4): H1792-H1800.
[11] Lumley LA, Robison CL, Chen WK, et al. Vasopressin into the preoptic area increases grooming behavior in mice [J]. Physiol Behav, 2001, 73(4): 451-455.
[12] Gordon CJ. Response of the thermoregulatory system to toxic insults[J]. Front Biosci (Elite Ed), 2010, 2: 293-311.
[13] Yang YL, Shen ZL, Zou Q, et al. Physostigmine-induced hypothermic response in rats and its relationship with endogenous arginine vasopressin[J]. Life Sci, 2009, 85(15-16): 586-591.
[14] 杨永录,杨 镇,景志敏, 等. 环境温度对毒死蜱引起大鼠低温的影响与尾部散热变化的关系[J]. 中国急救医学,2005,25(10):733-735.
[15] Wienzek H, Freise H, Giesler I, et al. Altered blood flow in terminal vessels after local application of ropivacaine and prilocaine[J]. Reg Anesth Pain Med,2007, 32(2): 233-239.
[16] Sharp JL, Zammit TG, Azar TA,et al. Stress-like responses to common procedures in individually and group-housed female rats[J]. Contemp Top Lab Anim Sci, 2003, 42(1): 9-18.
[17] Gordon CJ. Temperature and toxicology: an integrative, comparative, and environmental approach[M]. Boca Raton: CRC Press, 2005:13-50.
[18] Lumley LA, Robison CL, Chen WK, et al. Va-sopressin into the preoptic area increases grooming behavior in mice[J]. Physiol Behav, 2001, 73(4):,451-455.
[19] Tang Y, Yang YL,Wang N, et al. Effects of arginine va-sopressin on firing activity and thermosensitivity of rat PO/AH area neurons[J]. Neuroscience,2012, 219:10-22.
Effectofdifferentambienttemperaturesonargininevasopressin-inducedhypothermiainratsanditsrelationshipwithheatlossfromthetail
YANG Yong-lu, BU Shu, YANG Chun-tao, ZHANG Jie, WANG Cheng
(KeyLaboratoryofThermoregulationandInflammationofSichuanHigherEducationInstitutes,ChengduMedicalCollege,Chengdu610500,China.E-mail:ylyang@cmc.edu.cn)
AIM: To determine the effect of different ambient temperatures on arginine vasopressin (AVP)-induced hypothermia in rats and its relationship with the change of heat loss from the tail, and to assess if peripheral AVP administration increases heat loss from the tail.METHODSThe core temperature and tail skin temperature in adult male Sprague-Dawley rats at three different ambient temperatures (12 ℃, 22 ℃ and 32 ℃) were monitored by wireless telemetry. The rats were intraperitoneally injected with AVP (10 μg/kg) or vasopressin V1a receptor antagonist (30 μg/kg) at 10:00 AM. The diameters of microvessels in the spinotrapezius muscle and the grooming behavior in the rats were also observed after treatment with AVP or vasopressin V1a receptor antagonist.RESULTSAVP-induced hypothermia in the rats at three ambient temperatures was accompanied by a decrease in tail skin temperature. V1a receptor antagonist attenuated the hypothermia and the decrease in tail skin temperature induced by AVP (10 μg/kg). AVP induced significant constriction of the microvessels in the spinotrapezius muscle. AVP also enhanced the grooming behavior (salivary grooming) in the rats and this effect was inhibited by peripheral administration of vasopressin V1a receptor antagonist. Endogenous AVP did not mediate the heat loss from the tail in normal rats.CONCLUSIONPeripheral AVP induces hypothermia in rats. It does not lower the set point of body temperature, and its hypothermic effect may attribute to the suppression of thermoregulatory heat production and the increase in salivary grooming (saliva spreading for evaporative heat loss).
Arginine vasopressin; Hypothermia; Tail skin temperature; Heat loss; Grooming
R364.6
A
1000- 4718(2013)09- 1672- 07
2013- 04- 22
2013- 07- 12
国家自然科学基金资助项目(No.30870901);成都医学院学科建设项目专项经费资助(No.CYXK2012003)
△通讯作者Tel: 028-62739330; E-mail: ylyang@cmc.edu.cn
10.3969/j.issn.1000- 4718.2013.09.024
