siRNA靶向干扰组蛋白H3表达对人鼻咽癌细胞增殖的抑制作用*
2013-10-24李彬彬黄国良董子明何志巍
李彬彬, 黄国良, 孔 霞, 李 蓉, 董子明, 何志巍,△
(广东医学院 1病理生理学教研室, 2广东省医学分子诊断重点实验室,广东 东莞 523808;3郑州大学基础医学院病理生理学教研室,河南 郑州 450001)
siRNA靶向干扰组蛋白H3表达对人鼻咽癌细胞增殖的抑制作用*
李彬彬1, 黄国良2, 孔 霞1, 李 蓉1, 董子明3, 何志巍1,2△
(广东医学院1病理生理学教研室,2广东省医学分子诊断重点实验室,广东 东莞 523808;3郑州大学基础医学院病理生理学教研室,河南 郑州 450001)
目的应用RNA干扰技术抑制人鼻咽癌细胞株CNE1中组蛋白H3的表达,观察其对鼻咽癌细胞增殖的影响。方法构建针对组蛋白H3的小干扰RNA(siRNA)的真核表达载体,转染CNE1细胞并筛选获得稳定表达细胞株。实时荧光定量RT-PCR和Western blotting检测细胞中组蛋白H3 mRNA和蛋白表达的改变;CCK-8法和平板克隆形成实验观察细胞增殖能力的改变;双萤光素酶报告系统检测细胞激活蛋白1(AP-1)转录活性的改变。结果与阴性对照组和空白对照组相比,siRNA-H3质粒转染组的组蛋白H3 mRNA和蛋白表达均显著下降,细胞生长速度明显减慢,表皮生长因子诱导的细胞克隆形成能力和AP-1转录活性均受到明显抑制。结论通过RNA干扰技术阻断组蛋白H3的表达,可抑制CNE1细胞的生长、增殖,其机制可能与下调AP-1转录活性有关。组蛋白H3 可能是潜在的肿瘤治疗新靶点。
鼻咽肿瘤; 组蛋白H3; RNA干扰; 激活蛋白1
表观遗传(epigenetics)是指DNA序列不发生变化但基因表达却发生了可遗传的改变[1]。通常DNA序列的改变是永久性的,而许多表观遗传的改变则是可逆的。表观遗传修饰主要包括以下4个方面:DNA甲基化、组蛋白修饰、染色质重构和非编码RNA的调控。任何一个方面的异常都将影响染色体结构和基因表达,导致多种疾病及肿瘤的发生[2]。组蛋白修饰是细胞内基因转录调控的重要信息平台,它通过整合上游分子通路,产生适宜的细胞核信号,如转录激活或转录抑制,从而调节基因的表达。近年来大量研究显示,组蛋白H3异常修饰介导了肿瘤发生、演进的多个过程,是肿瘤表观遗传学的重要机制[2-3]。激活蛋白1 (activator protein-1, AP-1)是细胞内重要的核转录因子, 参与调控细胞增殖、分化和转化等过程,促进肿瘤的发生、发展[4-5]。但对AP-1转录活性的调控机制目前尚未阐明。RNA干扰(RNA interference, RNAi)是一种选择性沉默基因表达的有效工具,对此,我们构建了U6启动子驱动的、组蛋白H3基因的小干扰RNA (small interfering RNA, siRNA)表达质粒,降低人鼻咽癌CNE1细胞中组蛋白H3的表达,并探讨其对CNE1细胞增殖的影响和机制。
材 料 和 方 法
1材料和主要试剂
1.1菌株、细胞和质粒 大肠杆菌DH5α和人鼻咽癌CNE1细胞为本实验室保存;mU6pro质粒由美国明尼苏达大学惠赠;pcDNA3.1质粒由广东医学院张湘宁博士惠赠;pRTU14 AP-1 reporter vector 由德国Helmholtz Zentrum München研究中心惠赠。
1.2主要试剂 限制性内切酶BbsⅠ和XbaⅠ均购自NEB;T4 DNA连接酶购自大连TaKaRa;兔抗人组蛋白H3和H2A多抗购自Cell Signaling;红外标记羊抗兔Ⅱ抗购自Rockland;JetPEI 转染试剂购自Polyplus;G418和表皮生长因子(epidermal growth factor, EGF)购自Sigma-Aldrich;Cell Counting Kit-8 (CCK-8) 试剂盒购自日本同仁化学研究所;Dual-Luciferase Reporter Assay System 购自Promega。
2方法
2.1组蛋白H3 siRNA序列的设计和合成 在NCBI数据库中查找人类组蛋白H3 mRNA的序列(NM_003537),其编码序列(coding sequence,CDS)为1~411 bp。参考Choi等[6]的研究结果,选取16~34位(CAGACAGCTCGGAAATCCA)作为靶位点。按照mU6pro质粒的结构,设计包含BbsⅠ和XbaⅠ酶切残端并能表达发夹结构RNA的2条寡核苷酸序列: 正义链5’-TTTGCAGACAGCTCGGAAATCCATTCAAGA-GATGGATTTCCGAGCTGTCTGTTTTTT-3’,反义链5’-CTAGAAAAAACAGACAGCTCGGAAATCCATCTCTT-GAATGGATTTCCGAGCTGTCTG-3’。同时,设计1对阴性对照序列,经BLAST同源比对,此序列不与任何人类基因序列同源。所有序列由上海生工生物工程技术服务有限公司合成。
2.2真核表达质粒mU6pro-siRNA-H3的构建 建立退火体系:50 μmol/L正反义链模板10 μL,5×Annealing Buffer 5 μL,加灭菌ddH2O 至50 μL。在PCR仪上进行退火反应:95 ℃ 2 min,每90 s下降1 ℃,降至25 ℃,-20 ℃保存。BbsⅠ和XbaⅠ双酶切mU6pro质粒,纯化后的线性化载体与退火产物连接,构建重组质粒mU6pro-siRNA-H3(si-H3)和阴性对照质粒mU6pro-siRNA-mock(si-mock)。转化感受态细菌DH5α,用含氨苄青霉素的LB平板培养基培养并筛选转化子,挑取单个菌落,在含100 mg/L氨苄青霉素的LB液体培养基中扩大培养。取培养好的菌液进行菌落PCR法鉴定,上游引物在U6启动子区域设计:5’-ATATCCCTTGGAGAAAAGCCCTT-3’,而下游引物则是该质粒上M13R2的序列: 5’-CACAGGAAACAGCTATGACCAT-3’。阳性克隆送上海英骏生物技术有限公司测序。
2.3基因转染及稳定表达细胞株筛选 CNE1细胞常规培养于含10%胎牛血清RPMI-1640培养基中,以5×105cells/well接种于6孔板中,培养至70%~80%融合,使用Polyplus 公司的JetPEI 转染试剂进行si-H3和si-mock质粒的转染。因mU6pro质粒缺乏抗性筛选标记,故与pcDNA3.1质粒按10∶1进行共转染,具体操作按说明书进行。转染后24 h,将细胞以1∶10的比例传代至10 cm 培养板皿中,次日加入选择性抗生素G418 200 mg/L进行加压筛选,构建稳定干扰组蛋白H3的CNE1细胞株。
2.4实时荧光定量RT-PCR 检测组蛋白H3 mRNA的表达 Trizol试剂提取细胞总RNA,按照Roche逆转录试剂盒说明合成cDNA第1链;以cDNA为模板,7500实时定量PCR仪进行实时定量PCR反应。组蛋白H3上游引物5’-GTTGCTGATTCGGAAGCTGC -3’,下游引物5’-GAAGCGAAGATCGGTCTTGAA-3’;GAPDH上游引物5’-CTCCTCCTGTTCGACAGTCAGC-3’,下游引物5’- CCCAATACGACCAAATCCGTT -3’。检测各模板的阈值循环数(Ct),ΔΔCt=(Ct目的基因-CtGAPDH)实验组-(Ct目的基因-CtGAPDH)对照组,以2-ΔΔCt表示实验组目的基因的表达相对于对照组的变化倍数。
2.5Western blotting检测转染细胞组蛋白H3的表达 酸溶性蛋白抽提法提取组蛋白[7]:收集的细胞用PBS洗2次,加入细胞裂解液 (10 mmol/L HEPES,pH 7.9,1.5 mmol/L MgC12,10 mmol/L KCl,0.5 mmol/L DTT和1.5 mmol/L PMSF),冰浴1 h;4 ℃、8 000 r/min离心10 min,弃上清,沉淀用0.2 mol/L H2SO4重悬,冰浴30 min;收集上清液,加人5倍体积的冰丙酮,-20 ℃沉淀过夜;收集沉淀蛋白,用去离子水溶解沉淀,-80 ℃保存。
取等量样品,进行15%SDS-PAGE,将凝胶中的蛋白转移到硝酸纤维素膜上,5%脱脂奶粉封闭2 h;加入组蛋白H3抗体(1∶1 000),4 ℃孵育过夜;加入红外标记的羊抗兔Ⅱ抗(1∶10 000),室温孵育1 h;Odyssey近红外双色激光成像系统扫描成像,组蛋白H2A作为内参照,Quantity One软件进行半定量分析。
2.6CCK-8法检测细胞体外增殖能力 取对数生长期的细胞,以1 000 cells/well接种到96孔板,每组设5个平行孔并设不含细胞的空白对照,37 ℃连续培养5 d;每天于同一时间取出加入CCK-8试剂10 μL/well,继续培养2 h,在多功能酶标仪上测定450 nm波长各孔吸光度(A450)。根据每组细胞A450值绘制生长曲线。
2.7平板克隆形成实验检测细胞克隆形成能力 取对数生长期的细胞,以300 cells/well接种于含EGF(0 μg/L或10 μg/L)培养基的6孔板中,每组设3个平行孔,静置培养2周;用PBS清洗细胞2次,甲醇固定15 min后,0.4%结晶紫染色15 min,流水冲洗;将平皿倒置并叠加1张带网格的透明胶片,用肉眼直接计数克隆。
2.8双萤光素酶报告基因分析检测AP-1转录活性 取对数生长期的细胞,以1.0×105cells/well接种到24孔板,每组设3个平行孔,次日共转染AP-1-luc 报告质粒和pRL-TK 内参照质粒。转染24 h后移去培养基,换用无血清培养基饥饿24 h后用30 μg/L EGF刺激3 h,加入100 μL细胞裂解液,室温下轻缓晃动15 min。收集细胞裂解液,按Dual-Luciferase Reporter Assay System 说明书分别测定萤火虫萤光素酶和海肾萤光素酶的活性,以两者的比值反映AP-1转录活性。
3统计学处理
应用SPSS 17.0及GraphPad Prism软件分析。计量资料采用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1重组质粒si-H3的PCR鉴定和测序结果
重组质粒si-H3及其阴性对照质粒si-mock分别转化大肠杆菌DH5α,挑选氨苄青霉素抗性菌液进行阳性克隆菌液PCR鉴定,阳性克隆的PCR产物大小为385 bp。将阳性克隆菌液进行测序,结果与所设计的寡核苷酸序列一致, 表明si-H3和si-mock真核表达质粒构建成功。
2稳定干扰组蛋白H3CNE1细胞株的构建
将si-H3质粒、si-mock质粒与pcDNA3.1质粒共转染CNE1细胞,采用G418加压筛选获得稳定干扰组蛋白H3的CNE1细胞株及阴性对照细胞株。采用实时荧光定量RT-PCR(图1)和Western blotting(图2)检测组蛋白H3 mRNA和蛋白表达水平。与空白对照组(blank)相比,阴性对照组(si-mock)细胞组蛋白H3的mRNA和蛋白表达均无明显差异。与空白对照及阴性对照组相比,转染si-H3质粒的CNE1细胞组蛋白H3的mRNA出现明显降低,约为阴性对照组的33.6%,差异有统计学意义(P<0.05)。与空白对照及阴性对照组相比,转染si-H3质粒的CNE1细胞组蛋白H3的蛋白表达水平亦明显下调,约为阴性对照组的38.8%,差异有统计学意义(P<0.05)。这表明已成功构建稳定干扰组蛋白H3表达的CNE1细胞株。
3siRNA-H3对CNE1细胞增殖的影响
在细胞接种后1~5 d,以CCK-8法检测细胞增殖能力。与空白对照组相比,阴性对照组细胞的增殖能力无明显改变;但与空白对照组和阴性对照组相比,转染si-H3质粒的CNE1细胞在48 h后生长速度明显减慢,细胞群体倍增时间延长,差异有统计学意义(P<0.01),见图3。这表明siRNA下调组蛋白H3的表达可明显抑制CNE1细胞的增殖。
4siRNA-H3对CNE1细胞克隆形成能力的影响
EGF作为肿瘤促进因子,如图4所示,可以促进CNE1细胞的克隆形成能力,主要引起集落形成大小的增加。在无或有EGF(10 μg/L)刺激下,与空白对照组相比,阴性对照组细胞的克隆形成数目及集落形成大小均无明显改变;但与空白对照组和阴性对照组比较,转染si-H3质粒的CNE1细胞的集落形成数目及集落形成大小均明显减少,差异有统计学意义(P<0.05),见图4。表明在有或无EGF刺激下,下调组蛋白H3表达均可有效抑制CNE1细胞的克隆形成能力。

Figure 1. The mRNA level of histone H3 in stably transfected cells detected by real-time fluorescence quantitative RT-PCR. Mean±SD.n=3.*P<0.05vssi-mock.
图1实时荧光定量RT-PCR检测转染细胞中组蛋白H3mRNA的表达
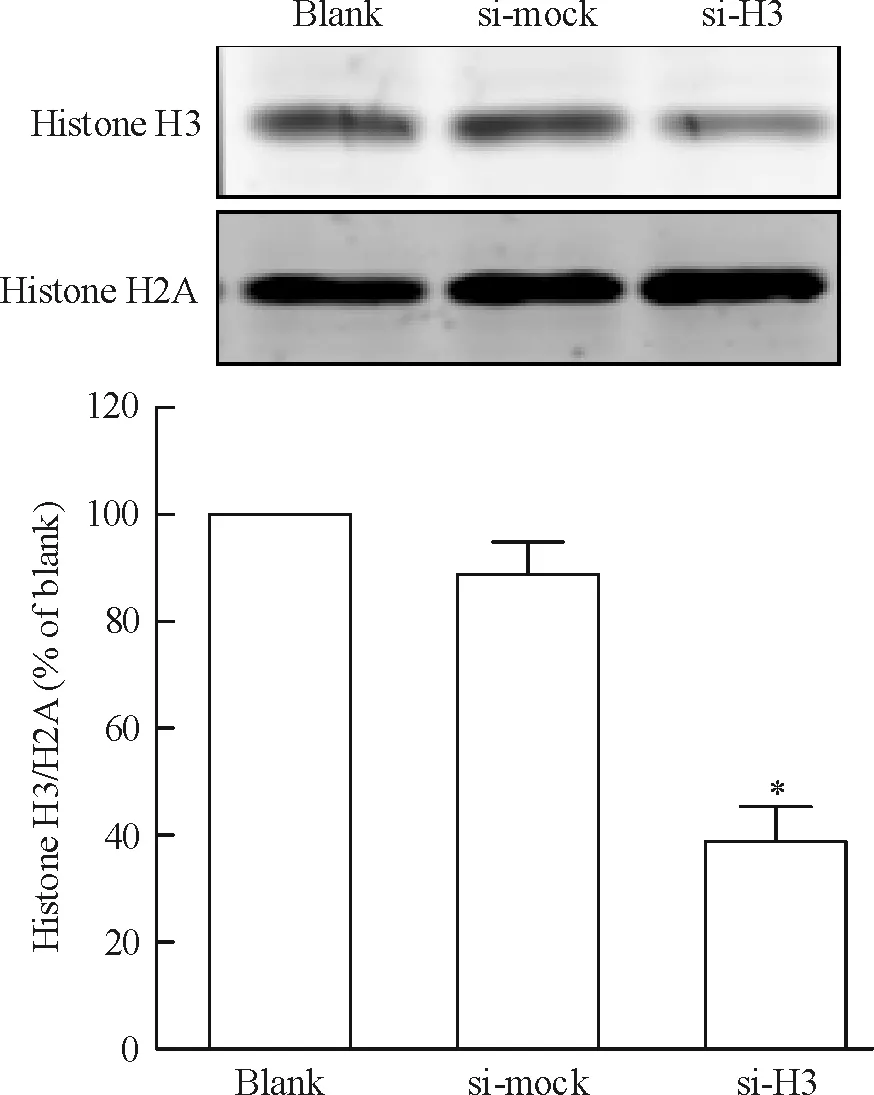
Figure 2. The expression of histone H3 protein in stably transfected cells detected by Western blotting. Mean±SD.n= 3.*P<0.05vssi-mock.
图2Westernblotting检测转染细胞中组蛋白H3的表达
Figure 3. The effect of histone H3 knockdown on CNE1 cell proliferation. Mean±SD.n=3.*P<0.05.**P<0.01vssi-mock group.
图3干扰组蛋白H3表达对CNE1细胞增殖的影响
Figure 4. The effect of histone H3 knockdown on colony formation of CNE1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vssi-mock.
图4干扰组蛋白H3表达对CNE1细胞克隆形成能力的影响
5siRNA-H3对CNE1细胞AP-1转录活性的影响
如图5所示,EGF (30 μg/L) 可以明显增强CNE1细胞转录因子AP-1的启动子活性,约为对照组的2.82倍。在无或有EGF(30 μg/L)刺激下,与阴性对照组相比,阴性对照组细胞的AP-1的转录活性均无明显改变;但与空白对照组和阴性对照组比较,转染si-H3质粒的CNE1细胞转录因子AP-1启动子活性明显降低,与空白对照组相比分别下降了约52.8%和73.1%,差异有统计学意义(P<0.05)。表明在有或无EGF刺激下,下调组蛋白H3表达均可明显抑制CNE1细胞的AP-1转录活性。

Figure 5. The effect of histone H3 knockdown on AP-1 transcriptional activation in CNE1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vssi-mock.
图5干扰组蛋白H3表达对CNE1细胞AP-1转录活性的影响
讨 论
核小体是染色质的基本单位,核小体的核心由组蛋白H2A、H2B、H3 和H4各2个分子形成的八聚体和缠绕在上面的DNA分子构成。组蛋白在翻译完成后,其N-末端氨基酸残基会发生乙酰化、磷酸化、甲基化、泛素化、糖基化等共价修饰,从而提供一种识别的标志,称为组蛋白密码[8]。组蛋白的这些修饰几乎都能影响染色质的结构和功能,进而改变组蛋白和DNA的相互作用,在基因转录调控中起关键作用。
大量研究表明[2-3],组蛋白修饰异常可引起相应染色体结构和基因转录水平的改变,影响细胞增殖、分化和凋亡,在肿瘤发生、发展中起重要作用。Feil等[9]报道,不利环境因素、饮食习惯等可以在不改变DNA序列的情况下,通过DNA甲基化和组蛋白共价修饰来扰乱相关基因的转录和表达,从而介导某些肿瘤的发生。近年来,组蛋白H3修饰异常与肿瘤发生的关系取得很大的进展。Tzao等[10]发现食管鳞癌患者中H3 K18乙酰化和H3 K27三甲基化水平与肿瘤分化程度呈正相关,H3 K27三甲基化水平低下的患者呈现较好的预后,提示H3 K27三甲基化水平可作为预测食管鳞癌患者预后的指标。H3 Ser10磷酸化是保证染色体浓缩和分离必不可少的因素之一。由AIM-1/Aurora B过表达引起的组蛋白H3 Ser10磷酸化水平的增高被发现在人类多种肿瘤中如结直肠癌、肝癌[11-12],可促进染色体的不稳定。我们在前面的研究中也发现[7],H3 Ser10磷酸化在低分化鼻咽癌组织中的表达明显高于鼻咽炎症组织和癌旁正常组织,并且与EB病毒潜伏性膜蛋白1(latent membrane protein 1,LMP1)的表达呈正相关关系。Nishikawa等[13]研究显示,EB 病毒阳性而LMP1呈低表达的鼻咽癌细胞TWO3-EBV经乙烯基丁酸酯或去乙酰化酶抑制剂trichostatin A 处理后,出现LMP1 表达水平上升,同时,TWO3-EBV细胞中乙酰化组蛋白H3 和H4 的表达也持续上升,显示组蛋白过乙酰化能上调EBV感染鼻咽癌细胞中的LMP1 的表达水平。
近年来研究发现组蛋白H3具有“癌基因”效应。Choi等[6]发现在小鼠JB6 C141细胞中过表达组蛋白H3可促进细胞的增殖和转化,集落形成能力增强,而采用siRNA降低组蛋白H3的表达则可明显抑制细胞的恶性转化。AP-1属于一类由即刻早期基因家族包括Jun、Fos和激活转录因子(activating transcription factor,ATF)组成的核转录因子。多种肿瘤刺激因子如EGF、佛波酯、紫外线以及氧化应激等均能诱导AP-1的激活。AP-1被发现在多种肿瘤组织中呈高表达,通过调控下游多个靶基因的转录活化在细胞增殖、转化以及肿瘤细胞侵袭和转移等过程中发挥作用[4-5]。近年来研究发现[6,14],组蛋白H3 Ser10磷酸化通过促进即刻早期反应基因c-jun、c-fos的转录激活进而调控AP-1的转录活性包括转录激活能力、DNA结合能力及稳定性,在EGF、佛波酯等促进的细胞恶性转化中起重要作用。
本研究利用siRNA干扰CNE1细胞组蛋白H3基因,实时荧光定量RT-PCR和Western blotting结果显示组蛋白H3表达在mRNA和蛋白水平均出现了明显的降低,证明合成的siRNA能有效地沉默组蛋白H3基因,下调组蛋白H3的表达。在此基础上,采用CCK-8 实验和平板克隆形成实验检测CNE1细胞增殖能力的改变,结果显示siRNA-H3沉默的CNE1细胞的增殖被显著抑制,生长速度明显减慢,其克隆形成数目和克隆形成大小均明显减少。双荧光素酶报告系统检测显示与细胞增殖相关的AP-1转录活性被明显抑制。EGF是一强有力的促细胞分裂因子,它通过与EGF受体结合激活酪氨酸蛋白激酶活化引起的级联反应促进细胞的增殖和转化。本研究也发现,EGF可明显促进CNE1细胞的增殖,并可增强AP-1的转录活性。但下调组蛋白H3的表达可显著抑制EGF促进的细胞克隆形成能力及AP-1的转录活性。这些结果提示组蛋白H3作为正调控因子介导CNE1细胞的增殖和转化,组蛋白H3对转录因子AP-1活性的调控可能是组蛋白H3介导细胞恶性转化的重要机制。组蛋白H3有望成为肿瘤化疗和基因治疗的重要靶点。
[1] Esteller M. The necessity of a human epigenome project [J]. Carcinogenesis, 2006, 27(6):1121-1125.
[2] Jones PA, Baylin SB. The epigenomics of cancer [J]. Cell, 2007, 128(4):683-692.
[3] Esteller M. Cancer epigenomics: DNA methylomes and histone-modification maps [J]. Nat Rev Genet, 2007, 8(4):286-298.
[4] Angel P, Karin M. The role of Jun, Fos and the AP-1 complex in cell-proliferation and transformation [J]. Biochim Biophys Acta, 1991, 1072(2-3):129-157.
[5] 周长春, 刘芝华, 齐 军,等. AP-1 和肿瘤的关系研究进展[J]. 世界华人消化杂志, 2006, 14(1):1-5.
[6] Choi HS, Choi BY, Cho YY, et al. Phosphorylation of histone H3 at serine 10 is indispensable for neoplastic cell transformation [J]. Cancer Res, 2005, 65(13): 5818-5827.
[7] Li B, Huang G, Zhang X, et al. Increased phosphorylation of histone H3 at serine 10 is involved in Epstein-Barr virus latent membrane protein-1-induced carcinogenesis of nasopharyngeal carcinoma [J]. BMC Cancer, 2013, 13:124.
[8] Jenuwein T, Allis CD. Translating the histone code [J]. Science, 2001, 293(5532): 1074-1080.
[9] Feil R. Environmental and nutritional effects on the epigenetic regulation of genes [J]. Mutat Res, 2006, 600(1-2):46-57.
[10] Tzao C, Tung HJ, Jin JS, et al. Prognostic significance of global histone modifications in resected squamous cell carcinoma of the esophagus [J]. Mod Pathol, 2009, 22(2):252-260.
[11] Sistayanarain A, Tsuneyama K, Zheng H, et al. Expression of Aurora-B kinase and phosphorylated histone H3 in hepatocellular carcinoma [J]. Anticancer Res, 2006, 26(5A): 3585-3593.
[12] Ota T, Suto S, Katayama H,et al. Increased mitotic phosphorylation of histone H3 attributable to AIM-1/Aurora-B overexpression contributes to chromosome number instability [J]. Cancer Res, 2002, 62(18):5168-5177.
[13] Nishikawa J, Kis LL, Liu A, et al. Upregulation of LMP1 expression by histone deacetylase inhibitors in an EBV carrying NPC cell line [J]. Virus Genes, 2004, 28(1):121-128.
[14] Clayton AL, Rose S, Barratt MJ, et al. Phosphoacetylation of histone H3 on c-fos- and c-jun-associated nucleosomes upon gene activation [J].EMBO J, 2000, 19(14):3714-3726.
SmallinterferingRNA-mediatedsilencingofhistoneH3inhibitsproliferationofhumannasopharyngealcarcinomacells
LI Bin-bin1, HUANG Guo-liang2, KONG Xia1, LI Rong1, DONG Zi-ming3, HE Zhi-wei1,2
(1DepartmentofPathophysiology,2GuangdongProvincialKeyLaboratoryofMedicalMolecularDiagnostics,GuangdongMedicalCollege,Dongguan523808,China;3DepartmentofPathophysiology,BasicMedicalCollegeofZhengzhouUniversity,Zhengzhou450001,China.E-mail:zhiweihe688@yahoo.com)
AIM: To study the effect of histone H3 down-regulation by RNA interference on the proliferation of human nasopharyngeal carcinoma CNE1 cells.METHODSThe small interfering RNA (siRNA) vector targeting histone H3 was constructed and transfected into CNE1 cells, and then stably transfected CNE1 cells were established. The expression of histone H3 mRNA and protein was measured by real-time fluorescence quantitative RT-PCR and Western blotting, respectively. The proliferation ability of CNE1 cells was evaluated by CCK-8 and colony-forming assays. The transcriptional activity of activator protein-1 (AP-1) was examined by dual-luciferase reporter gene assay.RESULTSCompared with negative control and blank control groups, histone H3 mRNA and protein expression was markedly decreased in siRNA-H3 stably transfected CNE1 cells. Knockdown of histone H3 caused a significant inhibition of cell proliferation. Furthermore, the colony formation and AP-1 transcriptional activity promoted by epidermal growth factor were obviously suppressed.CONCLUSIONKnockdown of histone H3 could significantly inhibit the proliferation of CNE1 cells by down-regulating the AP-1 transcriptional activity, and therefore histone H3 might serve as a therapeutic target in cancer treatment.
Nasopharyngeal neoplasms; Histone H3; RNA interference; Activator protein-1
R739.6
A
1000- 4718(2013)09- 1625- 06
2013- 06- 07
2013- 07- 10
国家自然科学基金资助项目(No. 81071638);广东省医学科学技术研究基金资助项目(No. A2011424)
△通迅作者 Tel: 0769-22896324; E-mail: zhiweihe688@yahoo.com
10.3969/j.issn.1000- 4718.2013.09.015
