钙中性蛋白酶2及Bax在肝纤维化大鼠肝组织中的表达变化及意义*
2013-10-24谢汝佳温静静
谢汝佳, 韩 冰, 杨 婷, 温静静, 杨 勤
(贵阳医学院病理生理教研室, 贵州 贵阳 550004)
钙中性蛋白酶2及Bax在肝纤维化大鼠肝组织中的表达变化及意义*
谢汝佳, 韩 冰, 杨 婷, 温静静, 杨 勤△
(贵阳医学院病理生理教研室, 贵州 贵阳 550004)
目的探讨钙中性蛋白酶2(calpain 2)及Bcl-2相关X蛋白(Bax)在肝纤维化过程中的表达变化及其在肝纤维化过程中的可能作用。方法雄性Wistar大鼠40只,随机分为正常对照4周、8周组和肝纤维化模型4周、8周组,每组各10只。肝纤维化组按3 mL/kg体重的剂量皮下注射40% CCl4植物油溶液,每隔3 d注射1次,造模时间分别为4周和8周;对照组大鼠皮下注射等量植物油溶液。采用TUNEL法检测肝组织中肝细胞凋亡情况;real-time PCR检测肝组织中calpain 2及bax mRNA的表达变化。免疫组织化学法及Western blotting检测肝组织中calpain 2及Bax蛋白的表达情况。结果Real-time PCR检测发现肝纤维化4周和8周组大鼠肝组织中calpain 2及bax mRNA表达较相应的正常对照组显著增加。免疫组化及Western blotting检测显示肝纤维化4周组大鼠肝组织中calpain 2蛋白的表达与正常4周组比较无显著差异;随着肝纤维化程度的加重,肝纤维化8周时大鼠肝组织中calpain 2的表达显著增加;而肝组织中Bax的表达从肝纤维化4周时就显著增加,肝纤维化8周时达到高峰。此外,通过TUNEL法检测发现肝纤维化4周和8周组大鼠肝组织中肝细胞凋亡的数目较正常组大鼠显著增加。结论Calpain 2与Bax可能参与了肝纤维化的发生发展过程。
肝纤维化; 钙中性蛋白酶2; Bcl-2相关X蛋白
钙中性蛋白酶(calpain)属于半胱氨酸蛋白水解酶超家族成员之一,广泛分布于绝大多数哺乳动物组织中。Calpain家族成员在细胞内发挥多种生理作用,涉及到细胞骨架的重塑、信号转导、细胞周期调控和凋亡等[1-2]。目前国内外对calpain与肝脏疾病关系的研究主要集中在肝脏的缺血-再灌注损伤和化学药物所致的急性肝损伤方面,关于calpain与肝纤维化的关系及相关机制研究目前国内外尚无报道。本研究采用CCl4复制肝纤维化动物模型,观察肝纤维化形成过程中肝组织calpain 2及Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)的表达变化,探讨它们在肝纤维化发病过程中可能的作用。
材 料 和 方 法
1动物及试剂
清洁级雄性Wistar大鼠40只,体重(160±20)g,购自贵阳医学院实验动物中心[许可证号为SCXK-(黔)2002-0001];calpain 2多克隆抗体购自Cell Signaling Technology;Bax多克隆抗体及原位TUNEL检测试剂盒购自武汉博士德生物技术有限公司;免疫组化Envision II 抗检测试剂盒购自上海基因科技有限公司;丙烯酰胺、过硫酸铵、甘氨酸、三羟甲基氨基甲烷、十二烷基硫酸钠及Bradford蛋白定量试剂盒均购自北京鼎国昌盛生物技术有限公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜及增强化学发光(enhanced chemiluminescent, ECL)试剂盒购自Millipore;Trizol购自Invitrogen;逆转录试剂盒购自Fermentas;SYBR Green购自大连宝生物工程有限公司;calpain 2、bax及内参照β-actin的引物委托上海捷瑞生物工程有限公司设计合成。引物序列如下:β-actin上游引物5’-GAGAGGGAAATCGTGCGTGAC-3’,下游引物5’-CATCTGCTGGAAGGTGGACA-3’;calpain 2上游引物5’-GGAAGAAGATGAAGATGATGAG-3’,下游引物5’-TTGCTGAGGTGGATGTTG-3’;bax上游引物5’-ACACCTGAGCTGACCTTGGA-3’,下游引物5’-CCGTGTCCACGTCAGCAATC-3’。
2方法
2.1动物分组与模型制备 实验动物适应性喂养1周后,随机分成4组,分别为正常对照4周、8周组和肝纤维化模型4周、8周组,每组各10只。肝纤维化组按3 mL/kg体重的剂量皮下注射40% CCl4植物油溶液,每隔3 d注射1次,造模时间分别为4周和8周;对照组大鼠皮下注射等量植物油溶液。分别于相应时点处死各组大鼠。大鼠处死前称体重,留取血液及全部肝脏,称肝脏湿重,每只大鼠取相同部位肝脏用4%中性甲醛固定,剩余肝组织-80 ℃低温冰箱保存;血液1 500 r/min离心10 min后将血清置于-80 ℃低温冰箱保存。
2.2肝脏指数测定 肝脏指数(%)=肝脏重量/体重×100%。
2.3肝组织病理学检查 4%中性甲醛固定后的肝组织石蜡包埋,常规组织切片, 苏木素-伊红(hematoxylin-eosin, HE)染色及Masson染色后光镜下观察肝组织的病理变化,参照肝纤维化分级法[3]进行胶原纤维增生程度半定量分析。
2.4血清生化指标检测 血清丙氨酸氨基转移酶 (alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测采用Siemens Advil 1650全自动生化分析仪测定。
2.5TUNEL法检测肝组织中肝细胞凋亡 严格按照试剂盒说明书操作。在荧光显微镜下观察凋亡的细胞,以细胞核发绿色荧光的细胞作为凋亡细胞,并计算凋亡指数。凋亡指数(%)=凋亡细胞数/细胞总数×100%。
2.6Real-time PCR检测肝组织中calpain 2及bax mRNA表达 提取肝组织总RNA并进行定量,逆转录合成cDNA,反应体系20 μL:总RNA 1 μg,5×PCR Buffer 4 μL,10 mmol/L dNTP 2 μL,10 μmol/L Oligo(dT) 1 μL,RNase Inhibitor 1 μL,MMLV反转录酶 1 μL,DEPC H2O补足体积。反应条件:25 ℃ 10 min,48 ℃ 60 min,95 ℃ 5 min。Real-time PCR 反应体系25 μL:反转录产物 2 μL,10 μmol/L上、下游引物各1.0 μL,2×SYBR Green I 12.5 μL,DEPC H2O补足体积。反应条件为50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,最后两步重复40个循环。以β-actin作为内参照,2-ΔΔCt为目的基因的相对表达强度,所有样本均重复3孔。
2.7免疫组织化学技术检测肝组织中calpain 2及Bax蛋白表达 切片常规脱蜡水化,3%H2O2处理,加封闭液后,分别滴加兔抗大鼠calpain 2和Bax多克隆抗体 (工作浓度为1∶100),4 ℃过夜。次日滴加羊抗兔IgG,在37 ℃孵育30 min,二氨基联苯胺(diaminobenzidine, DAB)显色,苏木素复染。阴性对照以磷酸盐缓冲液(phosphate-buffered saline,PBS)缓冲液代替Ⅰ抗。每个样本随机抽取5个高倍镜下视野,以胞浆黄染的细胞作为阳性表达的细胞,计算出阳性表达细胞占细胞总数的百分比。阳性细胞百分率(%)=阳性细胞数/细胞总数×100%。
2.8Western blotting 检测肝组织中calpain 2及Bax表达 提取肝组织总蛋白并进行蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分离蛋白质后,采用全湿电转移装置将蛋白质分子转移到PVDF膜上,电转移结束后PVDF膜用Tris缓冲盐溶液(Tris-buffered saline,TBS)洗涤1次(每次5 min),封闭缓冲液(5%脱脂奶粉)在室温下封闭1 h。封闭完成后TBS-吐温20(TBS-Tween 20,TBST)洗膜3次(每次5 min),然后将PVDF膜与Ⅰ抗稀释液(calpain 2稀释浓度为1∶1 000,Bax稀释浓度为1∶200)4 ℃封闭过夜。次日早上用TBST洗膜3次(每次5 min)后,PVDF膜与Ⅱ抗稀释液(1∶4 000)在室温下孵育1 h, TBST洗膜3次(每次5 min),加入ECL化学发光试剂A、B液各0.5 mL,混匀,润透PVDF膜后室温作用1 min。暗室中将PVDF膜迅速封入保鲜膜中,Kodak X-ray film压片,放射自显影1 min。X-ray film置于显影液中2~3 min,定影液中1.5 min,清水冲洗晾干。
3统计学处理
计量资料以均数±标准差(mean±SD)表示,用SPSS 统计软件(13.0 版)进行组间方差分析,以P<0.05为差异有统计学意义。
结 果
1各组大鼠肝脏指数与血清ALT、AST活性比较
由表1可见,肝纤维化模型4周和8周组大鼠肝脏指数均高于相应的正常对照组(P<0.01);肝纤维化模型4周和8周组大鼠血清AST和ALT活性也较相应的正常组大鼠显著增加(P<0.01)。上述结果提示肝纤维化大鼠出现明显的肝脏肿大及肝功能异常。

表1 各组大鼠肝脏指数、血清ALT活性、血清AST活性和肝细胞凋亡指数
**P<0.01vscorresponding control groups;△△P<0.01vs4-week liver fibrosis group.
2肝组织病理学变化
各组大鼠肝组织经HE染色和Masson染色,光镜下可见正常4周和8周组大鼠肝细胞以中央静脉为中心呈放射状排列,无胶原纤维增生;模型4周组大鼠肝细胞脂肪样变明显,可见部分空泡样变,Masson染色可见少量被染成蓝绿色的胶原纤维;模型8周组大鼠肝细胞脂肪样变严重,肝小叶结构破坏,可见假小叶形成。Masson染色可见肝组织内有大量被染成蓝绿色的胶原纤维,见图1、表2。

Figure 1. HE (A~D,×400) and Masson (E~H,×100) staining of rat hepatic tissues in each group. A,E: 4-week control group; B,F:8-week control group; C,G: 4-week liver fibrosis group; D,H: 8-week liver fibrosis group.
图1各组大鼠肝组织HE及Masson染色结果
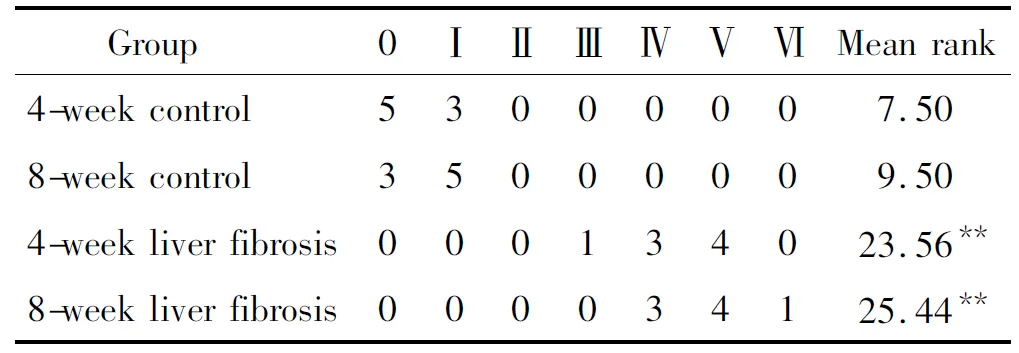
表2 各组大鼠肝纤维化程度分级
**P<0.01vscorresponding control groups.
3TUNEL法检测肝组织中肝细胞凋亡情况
TUNEL法检测肝细胞凋亡情况显示,正常4周和8周组大鼠肝组织中仅有少量肝细胞发生凋亡;而肝纤维化4周和8周组大鼠肝组织中凋亡肝细胞的数目明显增加,与正常对照组比较有显著差异,见图2、表1。

Figure 2. The apoptosis of hepatocytes in each group detected by TUNEL (×400). A: 4-week control group; B:8-week control group; C: 4-week liver fibrosis group; D: 8-week liver fibrosis group.
图2TUNEL法检测各组大鼠肝细胞凋亡情况
4Real-timePCR检测肝组织中calpain2及baxmRNA的表达
Real-time PCR 结果显示,肝纤维化4周和8周组大鼠肝组织中calpain 2及bax mRNA 的表达较相应的正常对照组明显增高(P<0.01),见表3。
表3Real-timePCR检测大鼠肝组织中calpain2和baxmRNA的表达
Table 3. The expression of calpain 2 and bax mRNA in liver tissues detected by real-time PCR(Mean±SD.n=5)

Groupcalpain2bax4-weekcontrol93.97±34.7364.61±16.588-weekcontrol82.94±26.5855.39±8.414-weekliverfibrosis173.63±28.60**231.21±20.30**8-weekliverfibrosis167.93±50.39**148.99±25.75**△△
**P<0.01vscorresponding control groups;△△P<0.01vs4-week liver fibrosis group.
5免疫组织化学法检测肝组织中calpain2及Bax蛋白的表达
免疫组织化学染色显示,正常4周和8周组大鼠肝组织中calpain 2及Bax蛋白表达量较少,仅在汇管区有少量表达;肝纤维化4周时,大鼠肝组织中calpain 2表达有所增加,但与正常4周组比较无显著差异,而肝组织中Bax的表达则较正常4周组显著增加;肝纤维化8周时,肝组织中calpain 2及Bax的表达均较正常8周组明显增多。肝纤维化大鼠肝组织中calpain 2及Bax阳性表达主要位于肝细胞胞浆内,见图3、表4。
6Westernblotting检测肝组织中calpain2及Bax蛋白的表达
Western blotting结果显示,正常肝组织内有少量calpain 2和Bax的表达;肝纤维化4周时,大鼠肝组织中calpain 2的表达与正常4周组比较无显著差异,而Bax的表达则显著增加;到肝纤维化8周时,肝组织中calpain 2和Bax的表达均较正常8周组明显增多,见图4。

Figure 3. The expression of calpain 2 (A~D) and Bax (E~H) in liver tissues detected by immunohistochemistry (×400). A,E: 4-week control group; B,F:8-week control group; C,G: 4-week liver fibrosis group; D,H: 8-week liver fibrosis group.
图3免疫组化检测各组大鼠肝组织calpain2及Bax的表达
表4免疫组化检测大鼠肝组织中calpain2及Bax蛋白的表达
Table 4. The expression of calpain 2 and Bax proteins in liver tissues detected by immunohistochemistry (%.Mean±SD.n=5)

Groupcalpain2Bax4-weekcontrol8.28±0.532.58±0.258-weekcontrol9.88±1.593.44±0.384-weekliverfibrosis11.16±1.4525.46±1.68**8-weekliverfibrosis23.10±3.77**△△18.06±1.89**△△
**P<0.01vscorresponding control groups;△△P<0.01vs4-week liver fibrosis group.

Figure 4. The expression of calpain 2 and Bax in liver tissues analyzed by Western blotting. A: 4-week control group; B:8-week control group; C: 4-week liver fibrosis group; D: 8-week liver fibrosis group.Mean±SD.n=5.*P<0.05,**P<0.01vscorresponding control groups;△△P<0.01vs4-week liver fibrosis group.
图4Westernblotting检测各组大鼠肝组织calpain2及Bax的表达
讨 论
Calpain属于半胱氨酸蛋白水解酶超家族成员之一。迄今为止,已经在哺乳动物细胞内先后发现了14种calpain家族蛋白酶[4]。目前,研究最多的是calpain1和calpain 2。研究发现,calpain1只需微摩尔浓度Ca2+就可激活,而calpain 2则需要毫摩尔浓度Ca2+才能激活[5-6],由于细胞内Ca2+浓度波动在微摩尔水平以下,所以calpain 2可能在病理情况下才能激活[7]。因此,在某些病理环境下尤其是高钙环境下, 当calpain 2被激活后就可介导一系列的病理变化,包括细胞肥大、细胞凋亡等。体外实验发现,calpain能切割Bcl-2家族促凋亡成员Bax,产生18 kD活性片段,后者能促进线粒体细胞色素C(cytochrome C, Cyt C)的释放,从而介导细胞凋亡的发生[8-9]。而应用钙蛋白酶抑制剂,则可阻断Bax的激活及其继发的Cyt C的释放,从而抑制细胞凋亡的过程[10]。这说明Bax可能介导了calpain在内源性凋亡途径中的作用。
我们的实验结果显示,肝纤维化4周时,calpain 2 mRNA的表达水平已较正常4周组显著增加, 但calpain 2在蛋白水平的表达与正常4周组比较无显著变化;随着肝纤维化的进展,到肝纤维化8周时,calpain 2在mRNA及蛋白水平的表达均明显增高。此外,我们还发现肝组织中Bax mRNA及蛋白的表达在肝纤维化4周和8周组均较相应的正常对照组明显增加,同时肝纤维化大鼠肝组织中凋亡肝细胞的数目也显著增加。通过上述实验结果我们推测,calpain 2的表达变化可能参与了肝纤维化过程中肝细胞凋亡的发生,其机制可能是calpain 2激活肝组织中的促凋亡蛋白Bax,产生活性的促凋亡片段Bax/p18。与完整的Bax不同,Bax/p18的活性在线粒体中不被抗凋亡蛋白Bcl-2所抑制[11],因此可促进肝细胞凋亡的发生。有研究表明肝细胞凋亡不仅是肝脏疾病早期损伤的重要病理改变, 也是肝硬化等晚期病变形成的基本条件[12]。Takehara等[13]敲除抗凋亡因子bcl-xL后, 可引发小鼠体内肝细胞自发凋亡并引起肝纤维化, 提示肝细胞凋亡能够独立导致肝纤维化的发生。由于肝细胞是肝脏唯一的实质细胞,肝细胞凋亡的增加势必会促进肝纤维化的发生和发展。
[1] 吴金兰,万福生. 钙蛋白酶与心血管疾病的关系[J]. 生命的化学,2011,31(1): 102-106.
[2] Altznauer F, Conus S, Cavalli A, et al. Calpain-1 regulates Bax and subsequent Smac-dependent caspase-3 activation in neutrophil apoptosis[J]. J Biol Chem, 2004,279(7):5947-5957.
[3] 程明亮,杨长青. 肝纤维化的基础研究及临床[M]. 第2版.北京:人民卫生出版社,2002:269-270.
[4] 李明辉, 陈瑞珍. Calpain与心肌细胞凋亡[J].中国病理生理杂志, 2009, 25(7): 1438-1440.
[5] Zhao W, Shi Z, Yuan F. μ-and m-calpain expression and activity changes following diethylstilbestrol injection in the rat anterior pituitary[J]. Neural Regen Res, 2011, 6(1):60-65.
[6] Miyazaki T, Koya T, Kigawa Y, et al. Calpain and atherosclerosis[J]. J Atheroscler Thromb, 2013, 20(3):228-237.
[7] Campbell RL, Davies PL. Structure-function relationships in calpains[J]. Biochem J, 2012, 447(3):335-351.
[8] Gao G, Dou QP. N-terminal cleavage of Bax by calpain generates a potent proapoptotic 18-kDa fragment that promotes Bcl-2-independent cytochrome C release and apoptotic cell death[J]. J Cell Biochem, 2000, 80(1):53-72.
[9] Yoo JO, Lim YC, Kim YM, et al. Transglutaminase 2 promotes both caspase-dependent and caspase-independent apoptotic cell death via the calpain/Bax protein signaling pathway[J]. J Biol Chem, 2012, 287(18):14377-14388.
[10] 邓志宽. 钙蛋白酶引起神经元死亡的机制[J]. 国外医学:神经病学神经外科学分册,2002,29(4):321-324.
[11] Sobhan PK, Seervi M, Deb L, et al. Calpain and reactive oxygen species targets bax for mitochondrial permeabilisation and caspase activation in zerumbone induced apoptosis[J]. PLoS One, 2013, 8(4): e59350.
[12] Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis[J]. Hepatology, 2004,39(2):273-278.
[13] Takehara T, Tatsumi T, Suzuki T, et al. Hepatocyte-specific disruption of Bcl-xL leads to continuous hepatocyte apoptosis and liver fibrotic responses[J]. Gastroenterology, 2004, 127(4):1189-1197.
Expressionofcalpain2andBaxinratfibroticlivertissues
XIE Ru-jia, HAN Bing, YANG Ting, WEN Jing-jing, YANG Qin
(DepartmentofPathophysiology,GuiyangMedicalCollege,Guiyang550004,China.E-mail:qinyang@gmc.edu.cn)
AIM: To observe the expression of calpain 2 and Bcl-2-associated X protein (Bax) in rat fibrotic liver tissues and to explore their effects on hepatic fibrosis.METHODSForty male Wistar rats were randomly divided into four groups (eachn=10): 4-week control group, 8-week control group, 4-week liver fibrosis group and 8-week liver fibrosis group. Liver fibrosis model was induced by subcutaneous injection of 40% CCl4(3 mL/kg) every 3 days for 4 or 8 weeks. The apoptosis of hepatocytes was detected by TUNEL. Additionally, the mRNA expression of calpain 2 and bax was determined by real-time PCR, and the protein expression of calpain 2 and Bax was determined by immunohistochemistry and Western blotting.RESULTSReal-time PCR showed that the mRNA expression of calpain 2 and bax in liver tissues was elevated in 4-week and 8-week liver fibrosis groups. The results of immunohistochemistry and Western blotting revealed that there was no difference of calpain 2 protein expression in liver tissues between 4-week liver fibrosis group and control group, but that in 8-week liver fibrosis group was obviously increased. The protein expression of Bax in 4-week and 8-week liver fibrosis groups was higher than that in control groups. Additionally, the numbers of apoptotic hepatocytes in 4-week and 8-week liver fibrosis groups were obviously increased compared with control groups.CONCLUSIONCalpain 2 and Bax may play important roles in the process of liver fibrosis.
Liver fibrosis; Calpain 2; Bcl-2-associated X protein
R363
A
1000- 4718(2013)09- 1603- 06
2013- 01- 14
2013- 07- 02
贵州省科技厅国际科技合作项目(No.黔科合外G字[2010]7016号)
△通讯作者 Tel:0851-6908578; E-mail:qinyang@gmc.edu.cn
10.3969/j.issn.1000- 4718.2013.09.011
