何首乌饮对快速老化小鼠性激素及其受体的影响
2013-10-10王超陈泓强李亚丽张明明
王超 陈泓强 李亚丽 张明明
随着社会的发展,环境污染、职业竞争、生育年龄推迟等多种因素均加快了女性性腺衰老和性激素失衡,致使卵巢功能降低,导致了卵巢早衰、不孕、更年期提前等许多女性疾病的发生。我们的前期研究发现补肾方剂何首乌饮能对抗大鼠卵巢组织衰老[1],本研究拟在前期的实验基础上,观察何首乌饮对快速老化小鼠雌二醇(E2)、黄体生长激素(LH)、卵泡刺激素(FSH)水平的影响及其受体表达的变化,探讨何首乌饮延缓卵巢衰老的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物:SAMP8小鼠,SPF级,60只,雌性,30~40 g;SAMP1小鼠,SPF级,12只,雌性,30~40 g;购自北京大学医学部实验动物科学部,动物许可证号:SCXK(京)2006-0008。
1.1.2 试剂与仪器:何首乌饮:何首乌(炙)、肉苁蓉、怀牛膝、淫羊霍、丹参、茯苓,用水提取成浓缩液。雌二醇(E2)、黄体生长激素(LH)、卵泡刺激素(FSH)试剂盒购自德国罗氏诊断有限公司;雌激素受体 α(ERα)、LH受体(LHR)、FSH受体(FSHR)引物均由上海生工工程公司合成;ERα小鼠单克隆抗体、LHR、FSHR兔多克隆抗体均购自Santa Cruz公司。
1.2 实验方法
1.2.1 动物分组与给药:SAMP8小鼠,60只,随机分为模型组、何首乌饮低剂量:10 g·kg-1、何首乌饮中剂量组:20 g·kg-1、何首乌饮高剂量组:40 g·kg-1、阳性药维生素VE组:35 mg/kg,每组12只动物。另设SAMP1小鼠为对照组。何首乌饮和VE组每日分别灌胃何首乌饮和VE,连续8周,对照组和模型组灌胃给予蒸馏水。
1.2.2 血清指标检测:采用阴道涂片法观察小鼠动情期,在小鼠动情前期眼眶取血,离心,分离血清,全自动微粒子化学发光免疫分析方法检测血清E2、LH、FSH含量。
1.2.3 卵巢指数的检测:处死小鼠,取卵巢,称重,计算卵巢指数=卵巢/体重×100%。
1.2.4 荧光定量PCR方法测定卵巢组织中ERα、LHR和FSHR mRNA的表达 取卵巢组织,Trizol一步法提取总RNA,鉴定完整性,进行逆转录反应,荧光定量PCR仪扩增,ERα引物为:上 游 5,-TCAACTGGGCAAAGAGAGTG-3,下 游 5,-GACGAGACCAATCATCAGAATC-3,长度为 104 bp;LHR引物为:上 游 5,-GGCTGGGATTACGATTATGAC-3,下 游 5,-AGGGATTGAAAGCATCTGGT-3,长度为76 bp;FSHR引物为:上游5,-GTCCTGATGAGCAAGTTTGG-3,下游 5,-AGGGATTCTTTCTGGAGTGG-3,长 度 为 100 bp;GAPDH 引 物 为:上 游 5,-TGAACGGGAAGCTCACTGG-3,下游 5,-GCTTCACCACCTTCTTGATGTC-3,长度为120 bp。完成扩增后,以对照组为标准,以GAPDH为内参照基因,计算ERα、LHR、FSHR表达的相对定量值用于统计分析。
1.2.5 Western-blot方法测定卵巢组织中ERα、LHR、FSHR蛋白的表达取卵巢,加入细胞裂解液研磨,离心取上清,用蛋白定量测定试剂盒进行总蛋白测定。电泳分离蛋白,PVDF膜用脱脂奶粉常温封闭,分别加入ERα、LHR、FSHR一抗(稀释度1∶200~1∶500),加入过氧化物酶标记的二抗(稀释度 1∶1 000),滴加酶的作用底物ECL,暗室中X线底片曝光,显影,定影。将X胶片条带扫描后输入图像分析系统,结果以与内参照基因GAPDH的比值表示,进行统计分析。
1.3 统计学分析应用SPSS11.5统计软件,计量资料以±s表示,采用ANOVA分析处理和Dunnet t检验,P<0.05为差异有统计学意义。
2 结果
2.1 激素水平及卵巢指数的变化 模型组较对照组血清中E2、卵巢指数明显下降(P<0.01),LH、FSH明显上升(P <0.01);与模型组比较,VE组、何首乌饮组E2、卵巢指数均明显上升(P <0.01),FSH均明显下降(P <0.01),VE组、何首乌饮中、高剂组LH明显下降(P<0.01)。见表1。
表1 何首乌饮对SAMP8小鼠激素水平的影响±s
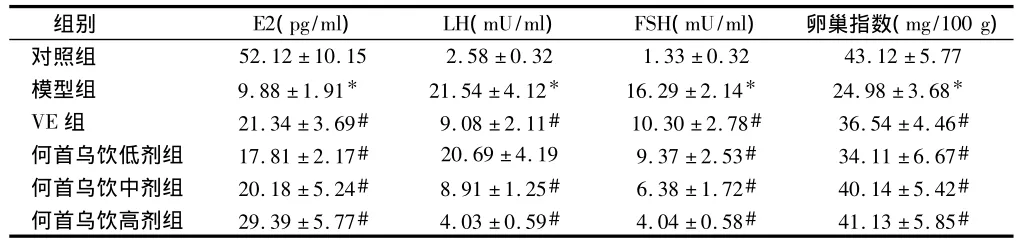
表1 何首乌饮对SAMP8小鼠激素水平的影响±s
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01
组别 E2(pg/ml) LH(mU/ml) FSH(mU/ml) 卵巢指数(mg/100 g)52.12±10.15 2.58±0.32 1.33±0.32 43.12±5.77模型组 9.88±1.91* 21.54±4.12* 16.29±2.14* 24.98±3.68*VE组 21.34±3.69# 9.08±2.11# 10.30±2.78# 36.54±4.46#何首乌饮低剂组 17.81±2.17# 20.69±4.19 9.37±2.53# 34.11±6.67#何首乌饮中剂组 20.18±5.24# 8.91±1.25# 6.38±1.72# 40.14±5.42#何首乌饮高剂组 29.39±5.77# 4.03±0.59# 4.04±0.58# 41.13±5.85#对照组
2.2 卵巢组织中ERα、LHR、FSHR表达的变化 模型组较对照组卵巢组织中ERα、LHR、FSHR mRNA和蛋白表达均明显下降(P<0.01);与模型组比较,VE组、何首乌饮组ERα、LHR、FSHR mRNA和蛋白表达均明显上升(P<0.01)。见表2。
表2 何首乌饮对SAMP8小鼠卵巢ERα、LHR、FSHR表达的影响±s

表2 何首乌饮对SAMP8小鼠卵巢ERα、LHR、FSHR表达的影响±s
注:与对照组比较,*P <0.01;与模型组比较,#P<0.01
蛋白对照组 0.98±0.12 0.89±0.13 0.95±0.11 0.79±0.09 1.0组别 ERα mRNA 蛋白LHR mRNA 蛋白FSHR mRNA 4±0.14 0.88±0.13模型组 0.39±0.05* 0.33±0.04* 0.37±0.05* 0.28±0.04* 0.44±0.06* 0.36±0.05*VE组 0.64±0.12# 0.55±0.06# 0.55±0.07# 0.49±0.06# 0.62±0.07# 0.53±0.06#何首乌饮低剂组 0.47±0.05# 0.41±0.05# 0.38±0.05 0.31±0.04 0.47±0.06 0.39±0.05何首乌饮中剂组 0.69±0.08# 0.65±0.07# 0.59±0.06# 0.53±0.07# 0.61±0.09# 0.68±0.09#何首乌饮高剂组 0.71±0.12# 0.69±0.08# 0.69±0.09# 0.59±0.07# 0.68±0.11# 0.75±0.11#
3 讨论
卵巢衰老是女性机体衰老的开始,因此卵巢衰老越来越被人们大量关注。临床研究认为卵巢衰老开始的标志是FSH水平升高[2],通常把女性FSH≥20 mU/ml作为卵巢功能低下的一个标准,之后的FSH、LH持续升高,E2持续降低,最后导致绝经的发生[3]。我们观察到SAMP8快速老化小鼠血清中E2水平明显降低,LH、FSH明显上升,同时小鼠卵巢指数明显下降,表明SAMP8小鼠出现了性激素水平异常,卵巢老萎缩。何首乌饮治疗组能明显降低LH、FSH水平,升高E2,升高卵巢指数,表明何首乌饮能够调节生殖内分泌功能,直接作用于卵巢,延缓其衰退。
雌激素在女性机体中起着重要的作用,雌激素缺乏,不仅会对女性生殖功能影响巨大,而且会引起骨质疏松[4]、心血管病[5]等多种病症。雌激素主要通过与其受体ER结合而发挥生物学作用,激素靶器官对激素的反应是通过循环中激素浓度和靶器官受体的含量二方面而决定的。已知ER分两个亚型,即ERα、ERβ,两类受体有着不同的功能,研究认为,ERα主要存在于卵囊泡膜细胞,可通过负反馈回路调节排卵[6]。我们观察到SAMP8小鼠卵巢组织中ERαmRNA和蛋白表达明显降低,而给予何首乌饮治疗后ERαmRNA和蛋白均显著升高,提示何首乌饮可以通过调节卵巢组织中的激素受体而发挥其调控内分泌的作用。
在生理状态下,LH、FSH共同作用,调控卵巢各种性激素的合成与分泌,促进卵泡的正常生长发育,LH的主要作用是促进排卵和黄体形成,FSH的主要作用是促进卵泡成熟及分泌雌激素,但二者均需要与相应的受体结合而发挥生物效应[7]。其中,LHR存在于卵泡膜细胞和窦期卵泡的颗粒细胞,FSHR存在于窦前期卵泡和窦期卵泡的颗粒细胞。我们的结果显示SAMP8快速老化小鼠卵巢中LHR、FSHR mRNA和蛋白表达均下降,何首乌饮能显著提高LHR、FSHR mRNA和蛋白表达,提示何首乌饮可通过上调LHR、FSHR表达而起到促卵泡生长的作用。
我们的结果显示何首乌饮能上调ERα、LHR、FSHR的表达而起到调节调控性激素,从而达到延缓快速老化小鼠卵巢衰老的作用,可能是何首乌饮防止衰老的作用机制之一。这一问题的阐述,有利于何首乌饮的临床应用和推广。
1 张娜,李亚丽,牛嗣云,等.中药何首乌饮抗大鼠卵巢组织衰老的机理.解剖学报,2008,39:187-191.
2 Orvieto R,Meltcer S,Liberty G,et al.Does day-3 LH/FSH ratio influence in vitro fertilization outcome in PCOSpatients undergoing controlled ovarian hyperstimulation with different GnRH-analogue?Gynecol Endocrinol,2012,28:422-444.
3 胡立君,高凤春.综合疗法对围绝经期综合征患者血清雌激素的影响.中国妇幼保健,2012,27:2994-2996.
4 Miller PD.A review of the efficacy and safety of denosumab in postmenopausal women with osteoporosis.Ther Adv Musculoskelet Dis,2011,3:271-282.
5 Manrique C,Lastra G,Habibi J,et al.Loss of Estrogen Receptorα Signaling Leads to Insulin Resistance and Obesity in Young and Adult Female Mice.Cardiorenal Med,2012,2:200-210.
6 Pastore MB,Jobe SO,Ramadoss J,et al.Estrogen receptor-α and estrogen receptor-βin the uterine vascular endothelium during pregnancy:functional implications for regulating uterine blood flow.Semin Reprod Med,2012,30:46-61.
7 付灵梅,谭朝阳,王丽君,等.紫石英对排卵障碍大鼠卵巢局部卵泡刺激素受体、黄体生成素受体表达的影响.中国实验方剂学杂志,2011,17:184-186.
