rDNA介导的菊粉酶基因整合载体构建及在K.marxianus中应用
2013-09-27袁文杰,陈丽杰,孔亮,孜力汗,任剑刚,白凤武
袁 文 杰, 陈 丽 杰, 孔 亮, 孜 力 汗, 任 剑 刚, 白 凤 武
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023)
0 引 言
燃料乙醇是迄今为止国内外公认的,发展最成熟的生物能源产品,可以与汽油以一定比例配混使用.然而,我国人口多耕地少的基本国情,使目前粮食类淀粉质原料燃料乙醇产业的规模化发展受到了制约.不与人争粮,不与粮争地,是当前乃至未来我国燃料乙醇产业发展的基本方针.
菊芋俗称洋姜或鬼子姜,与其他农作物相比具有适应性强、耐贫瘠、耐寒、耐旱、种植简易及产量高等特点[1].利用我国现有的非耕地资源种植欧亚菊芋,不仅可以为生物能源产品生产开辟新的原料来源,而且有助于生态环境保护.我国已将菊芋作为重点发展的非粮能源植物列入生物产业发展“十一五”“十二五”规划中.
在前期的研究中,本实验室经过筛选、驯化和诱变选育了乙醇发酵性能优良且具有菊粉酶生产能力的马克斯克鲁维酵母(Kluyveromyces marxianusYX01,K.marxianusYX01),研究开发了集菊粉酶生产、菊粉水解和乙醇发酵为一体(simultaneous inulase production, inulin saccharification and ethanol fermentation,SISF)的技术,可以通过一步法将菊芋粉发酵生成乙醇[2].本工艺可采用生菊芋粉进行乙醇发酵,原料不需蒸煮和预先糖化,节省能源及设备投资,降低生产成本,同时还减少了因蒸煮而造成的可发酵性糖的损失.但是为了满足SISF工艺,必须使发酵过程中的菊粉酶分泌、菊粉酶酶解速度与发酵速度相等.虽然K.marxianusYX01具有良好的菊粉酶生产能力,但实验结果表明,发酵条件下K.marxianusYX01的菊粉酶生产能力不足,致使发酵过程中酶解速度较慢,达到发酵终点所需的发酵时间比现有乙醇生产工艺显著延长,发酵罐设备生产强度相应降低.提高发酵条件下菊粉酶的表达量和活性,可能是解决这一问题的有效途径.
由于K.marxianus属于非常规酵母,用于基因表达的载体种类还不多,并且带有附加型载体的细胞不适于长期培养[3-5].染色体整合表达是稳定表达外源基因的另一选择.Douglas等[6]使用来源于S.cerevisiae的可重复使用的URA3基因簇表达系统在K.marxianusLDH基因位置插入外源基因并成功表达.
核糖体rDNA序列是真核生物基因组DNA中的中等重复并有转录活性的基因家族.酵母基因组中rDNA有100~200个重复单元,是构建高拷贝数整合型载体较为理想的重复顺序.以rDNA为整合位点提高整合拷贝数的应用策略,已经成功应用于多种外源基因的表达[7-10].唐南筠等[11]也利用rDNA作为整合位点,实现外源基因在K.lactis中的表达.由于rDNA在物种中具有很强的保守性,Klabunde等[12]以来源于H.polymorpha的rDNA为整合位点,成功实现了外源基因在H.polymorfa、P.stipitis、S.cerevisiae和A.adeninivorans中的表达.因为K.marxianus的rDNA序列尚属未知,本文尝试以S.cerevisiae的rDNA为整合位点,实现INU基因在K.marxianusYX01中的过量表达,并对获得的基因工程菌进行菊芋生料乙醇发酵研究,以期为实现菊芋非粮乙醇工业化生产奠定基础.
1 材料与方法
1.1 实验菌株和质粒
菌株及质粒列于表1.其中K.marxianusYX01为本实验的出发菌株,分泌菊粉酶并具有良好的乙醇发酵性能;酿酒酵母S.cerevisiae288c为模式菌株,用作扩增pgk启动子和整合位点rDNA的模板.
1.2 酶和化学试剂
引物合成和序列测定委托TaKaRa(大连)公司完成.TaqDNA聚合酶、T4DNA连接酶、限制内切酶、DNA marker等购自TaKaRa(大连)公司;G418购自Sigma公司(美国,密苏里州);DNA纯化试剂盒、质粒提取试剂盒与凝胶回收试剂盒均购自Solarbio公司(北京).菊粉购自内蒙古亿利生物技术有限公司;菊芋购自山东济宁,用前进行烘干粉碎,稀酸水解处理后100g菊芋粗粉中含有65g总糖.
1.3 培养基
YPD培养基、YPD选择培养基、菊粉培养基及菊芋粗粉发酵培养基同文献[13].
1.4 引物设计
根据S.cerevisiaepgk启动子(GenBank登录号BK006937.1)序列,设计引物pgk forward primer和pgk reverse primer,5′和3′端分别引入酶切位点SpeⅠ和SacⅡ.根据Saccharomyces paradoxusNRRL Y-17217 的 rDNA 基 因(GenBank登录号 BR000309.1)序列,设计引物rDNA F 和rDNA R,分别在 5′和 3′端引入BamHⅠ和BssHⅡ酶切位点.根据K.marxianus的菊粉酶基因(GenBank登录号X57202)序列,设计引物inu F和inu R,在5′和3′端引入SacⅡ和HpaⅠ酶切位点(引物序列见表2).

表1 实验菌株和质粒Tab.1 Strains and plasmids

表2 文中所用的引物序列Tab.2 The primer sequences in this paper
1.5 表达载体各元件的克隆
利用设计的引物及高保真EasyPfuDNA聚合酶,按表3反应程序PCR扩增表达载体构建所需的3个元件片段.

表3 3个克隆元件的PCR反应程序Tab.3 The PCR systems used in cloning of three components
1.6 菊粉酶基因整合表达载体的构建
PCR产物经凝胶回收纯化后,分别与克隆载体pMD19-T连接并转化E.coliDH5α感受态细胞.阳性克隆提取质粒后测序,验证正确的质粒分别 命 名 为 pMD19-T/inu、pMD19-T/pgk 和pMD19-T/rDNA.载体pMD19-T/pgk经SpeI/SacⅡ双酶切后,回收目的片段,用T4DNA连接酶连接至经SpeI/SacⅡ双酶切的pFA6a,重组正确的载体命名为pFA6a-pgk;将载体pMD19-T/inu经SacⅡ/HpaⅠ双酶切后,回收目的片段,用T4DNA连接酶连接至经SacⅡ/HpaⅠ双酶切的pFA6a-pgk,重组正确的载体命名为pFA6a-pgk-inu.将 载 体 pMD19-T/rDNA 经BamHⅠ/BssHⅡ双酶切后,回收目的片段,用T4DNA连接酶连接至经BamHⅠ/BssHⅡ双酶切的 pFA6a-pgk-inu,重 组 正 确 的 载 体 命 名 为pFA6a-rDNA-pgk-inu.质粒的提取、酶切、连接和E.coli转化均按Sambrook等[14]的方法进行.
1.7 重组质粒载体转化K.marxianus YX01
重组质粒载体pFA6a-rDNA-pgk-inu用SphⅠ酶切线性化后,利用电击法转化K.marxianusYX01.操作方法按说明书进行.SphⅠ的单酶切位点位于3.3kb rDNA片段的中部,重组质粒载体经该酶线性化后可以特异整合到K.marxianusYX01染色体的特定部位,以实现外源基因的同源重组.
1.8 重组菌的筛选与鉴定
用含300μg/mL G418的YPD选择培养基筛选阳性重组菌.提取转化子的基因组DNA,利用PCR方法进行验证.鉴定引物序列为Id F/R(表2).筛选得到的重组菌株命名为K/r.
1.9 重组菌株产菊粉酶性能的考察
在由PCR鉴定得到的重组菌株中,通过初筛得到发酵性能较好的两株菌株 K/r-1和 K/r-2.取菌浓度相同的K.marxianusYX01和重组菌株 K/r-1和 K/r-2,接至菊粉培养基,使初始接种量OD值为1.250mL摇瓶中装液量100mL,8层纱布封口,摇床转速150r/min,温度30℃条件下培养.每24h取样测定生物量(干质量)、菊粉酶活性.测定方法同文献[13].
1.10 重组菌株的菊芋生料补料发酵
取菌浓度相同的K.marxianusYX01和重组菌株 K/r-1和 K/r-2,接至200g/L 菊芋粗粉发酵培养基中(糖浓度为127g/L),使初始接种量OD值为1.250mL摇瓶中装液量100mL,厌氧塞封口,摇床转速150r/min,温度30℃条件下培养.发酵12h时向培养基中补加8g粗菊粉,使菊粉终浓度达到280g/L,每12h取样测定总糖及乙醇含量.测定方法同文献[13].
2 结果与讨论
2.1 菊粉酶基因多拷贝整合表达载体的构建
分别以K.marxianusYX01和S.cerevisiae288c的基因组DNA为模板,PCR扩增获得INU基因、pgk启动子基因、rDNA基因,经Blast比对,3个PCR产物的DNA序列与模板的相似性达100%.依次将克隆得到的目的片段连接至pFA6a骨架上,成功构建得到重组整合表达载体pFA6a-rDNA-pgk-inu.重组质粒的 PCR 验证结果和酶切结果都与理论相符.整个构建过程如图1所示.
2.2 K.marxianus YX01的转化及重组菌株的鉴定
利SphⅠ酶切载体 pFA6a-rDNA-pgkinu,回收9.7kb的线性目的片段,利用电击法进行转化.对选择平板上的抗性菌落进行PCR鉴定.PCR鉴定以重组菌株的基因组DNA为模板,以YZ F/R为引物进行PCR扩增.扩增的片段包括Kan R后半部分基因、pgk启动子基因和INU基因的前半部分,预期的目标序列的长度为1.9kb;而出发菌株无整合片段,PCR结果应为阴性.PCR的电泳结果如图2所示.基因工程菌在无筛选压力下连续培养50代以上,仍然保持G418抗性.实验中选择了酿酒酵母rDNA结构单元中的NTS1至28SrDNA部分片段,长约3.3kb作为同源重组位点,整合的质粒长度基本与rDNA的一个重复单元长度一致,使得整合后的质粒比较稳定.
2.3 重组菌株产酶性能的考察
将初筛选出来的两株菌 K/r-1和 K/r-2接种在菊粉培养基中进行培养,考察菊粉酶分泌情况.按照前述的实验方法1.9,在摇瓶中对重组菌株的生长和产酶能力进行了测定,实验结果如图3所示(A为酶活力,ρ为菌浓度).
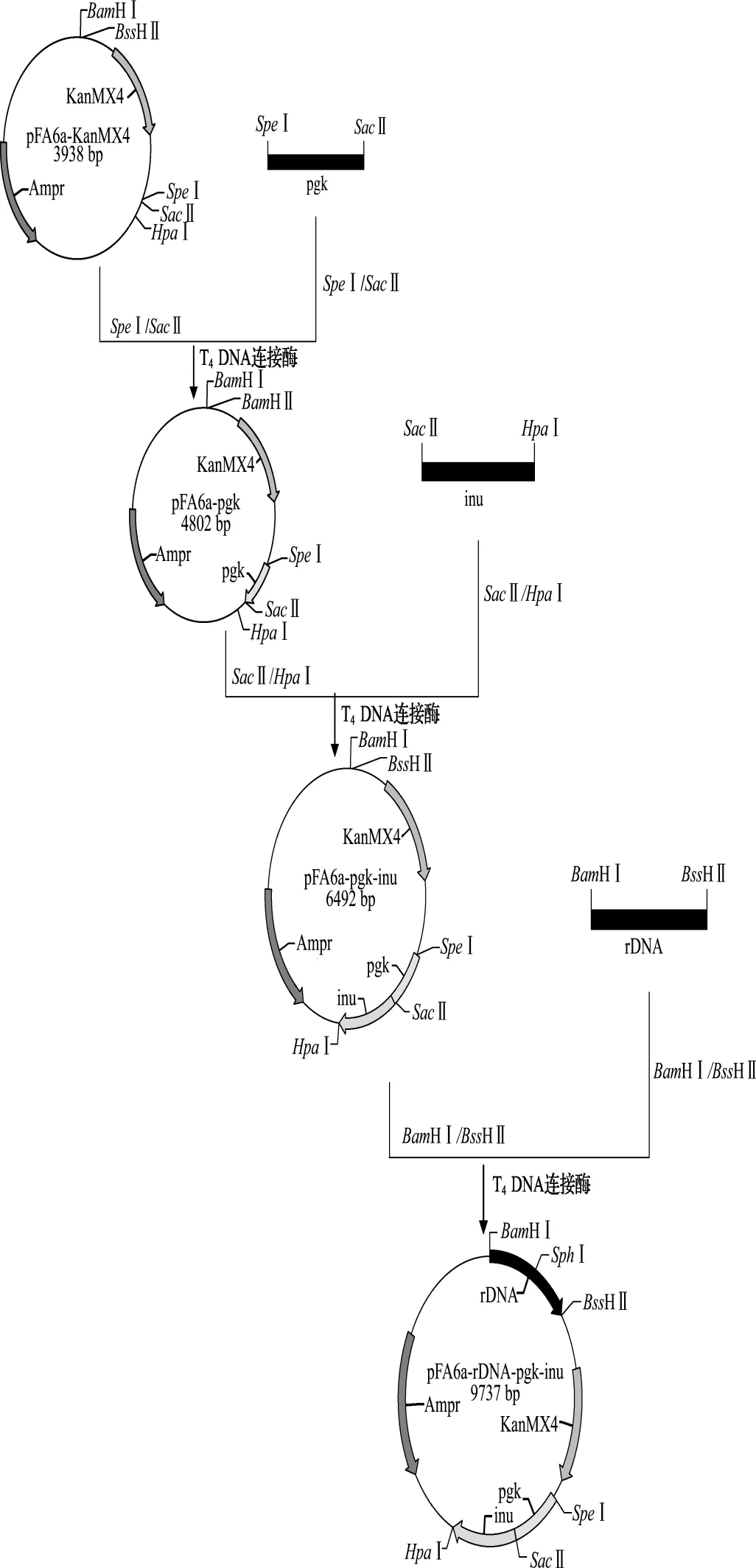
图1 整合载体pFA6a-rDNA-pgk-inu的构建策略Fig.1 The construction strategy of recombinant vector pFA6a-rDNA-pgk-inu
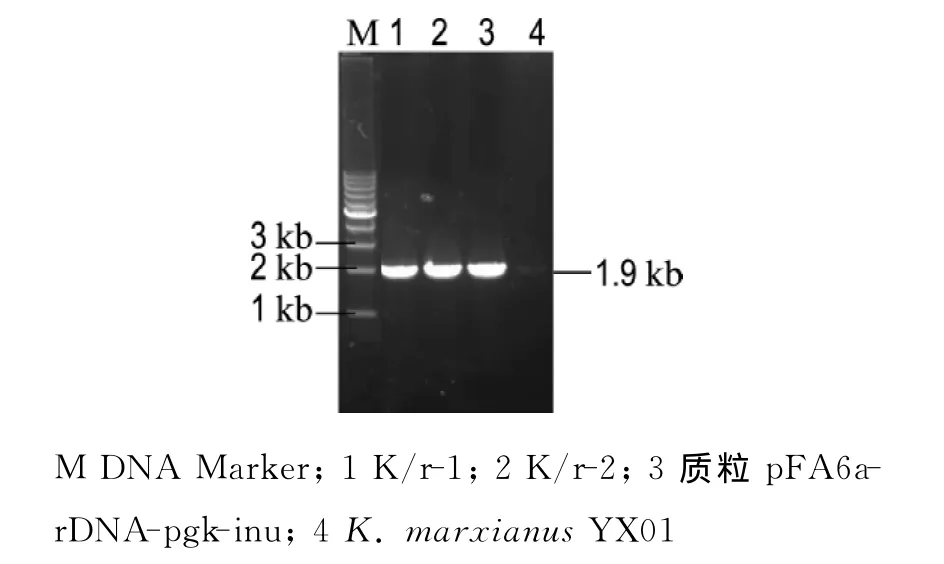
图2 阳性转化子的PCR鉴定结果Fig.2 The detection of positive transformant by PCR
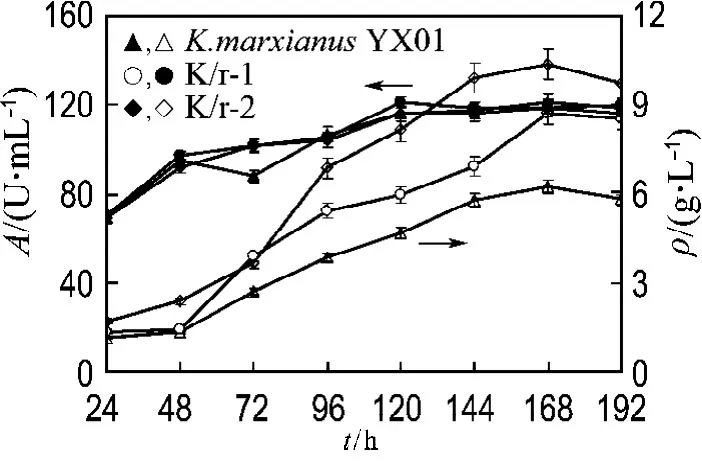
图3 出发菌株和重组菌株 K/r-1、K/r-2的生长情况及菊粉酶活力的变化Fig.3 Yeast cell growth and inulinase activity of the host and recombinants K/r-1and K/r-2
从图3中可以看出,两个重组菌株的生物量几乎与出发菌株一致,维持在9g/L左右.重组菌株K/r-1和K/r-2分泌的菊粉酶活力均高于出发菌株.在168h时,K/r-2菌株的最高酶活力达140U/mL,K/r-1菌株的最高酶活力为120U/mL,分别是出发菌株(80U/mL)的1.8、1.5倍,说明所构建的质粒载体pFA6a-rDNA-pgk-inu转化K.marxianus后成功地实现了菊粉酶基因的过量表达,达到了本文研究的预期目的.来自于酿酒酵母的rDNA可以整合到非常规酵母K.marxianus的染色体基因组中,且不影响生长,说明rDNA位点整合在真核微生物中存在广泛的普适性.rDNA位点整合将有益于外源基因在K.marxianus中的表达,促进该种微生物在工业生物技术中的应用.
2.4 重组菌株的菊芋粉补料批式发酵
对重组菌株 K/r-2和 K/r-1的菊芋粉乙醇发酵进行了生料的批式补料工艺的考察.发酵使用菊芋粗粉培养基,无其他营养盐添加,结果如图4所示(ρts为总糖浓度,ρe为乙醇浓度).
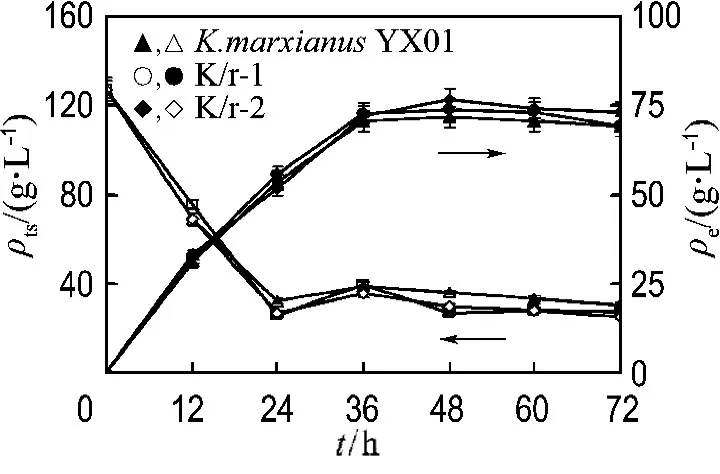
图4 出发菌株和重组菌株 K/r-1、K/r-2的菊芋粉乙醇补料发酵性能Fig.4 Ethanol fermentation performance of K/r-1 and K/r-2in the fed-batch fermentations from rawJerusalem artichoke
由实验结果可以看出,重组菌株K/r-2和K/r-1的发酵性能明显好于出发菌株K.marxianusYX01.发酵在48h达到终点,重组菌株的乙醇产量均比出发菌株要高,其中K/r-2的最高乙醇浓度为76.5g/L,K/r-1的最高乙醇浓度为73.5 g/L,均高于出发菌株的71.5g/L.在发酵过程中,发酵醪中总糖水平急剧下降,说明出发菌株K.marxianusYX01的发酵能力很强.种子培养液中具有的菊粉酶活力使得发酵液中的还原糖在发酵初期达到很高水平,在12h时,K/r-2的为26g/L左右,而出发菌株K.marxianusYX01的为16g/L,与种子液的菊粉酶活力正相关.补加菊芋粉后,发酵醪中总糖浓度得到了回升,随着发酵的进行逐渐被消耗.到发酵终点时,K/r-2剩余总糖为25g/L左右,而出发菌株K.marxianusYX01的为30g/L,说明由于菊粉酶活力的升高,糖的利用率及乙醇对糖的得率都得到了提升,证明了菊粉酶活性是SISF技术的关键控制点的推论.
菊粉酶是能够水解β-2,1-D-果聚糖苷键的一类水解酶,能够水解菊粉为果糖及低聚果糖,在果糖生产及菊芋生产发酵产品等方面引起了广泛关注.来源于Aspergillusniger和K.marxianus的菊粉酶基因已经成功地实现了在P.pastoris中的表达[15-16].Liu等构建了菊粉酶的酵母细胞表面展示载体并转化Yarrowialipolytica[17],利用菊芋生产柠檬酸,提高了柠檬酸的产量.
非粮作物菊芋是生产燃料乙醇的理想原料之一,但目前尚无满足工业化生产的菌种与工艺.本实验通过过量表达菊粉酶基因,提高了出发菌株K.marxianus菊粉酶活力,相应地提高了发酵终点乙醇浓度.本文的结果远高于文献[18]报道的克鲁维酵母能够利用菊粉发酵生产乙醇,乙醇体积分数达到6%~7%,糖醇转化效率79.0%~87.4%的结果.为提高终点乙醇浓度,降低发酵过程中醪液黏度,利用该基因工程菌本实验室正在开发新的发酵工艺,数据将另文发表.
3 结 论
本文以酿酒酵母rDNA结构单元的NTS1至28S(长约3.3kb)DNA片段作为同源重组位点,构建了菊粉酶重组表达载体pFA6a-rDNA-pgk-inu,实现了菊粉酶基因在K.marxianusYX01中的过量稳定表达,提高了出发菌株K.marxianusYX01菊粉酶活力.利用菊芋生料的乙醇发酵浓度得到提高,剩余残糖的浓度降低.在菊芋粉浓度为280g/L,总糖浓度为180g/L条件下,发酵48h,乙醇浓度可达76.5g/L,达到理论转化率的96%,为我国利用非粮作物菊芋生产燃料乙醇奠定了基础.
[1]Margaritis A,Bajpai P.Ethanol production fromJerusalemartichoketubers (Helianthustuberosus)usingKluyveromycesmarxianusandSaccharomycesrosei[J].Biotechnology and Bioengineering,1982,24(4):941-953.
[2]YUAN Wen-jie,ZHAO Xin-qing,GE Xu-meng,etal.Ethanol fermentation withKluyveromyces marxianusfromJerusalemartichokegrown in salina and irrigated with a mixture of seawater and freshwater[J].Journal of Applied Microbiology,2008,105(6):2076-2083.
[3]Ball M M, Raynal A, Guerineau M,etal.Construction of efficient centromeric,multicopy and expression vectors for the yeastKluyveromyces marxianususing homologous elements and the promoter of purine-cytosine-like permease [J].Journal of Molecular Microbiology and Biotechnology,1999,1(2):347-353.
[4]Bartkeviciute D,Sieksteke R,Sasnauskae K.Heterologous expression of theKluyveromyces marxianusendopolygalacturonase gene (EPG1)using versatile autonomously replicating vector for a wide range of host [J].Enzyme and Microbial Technology,2000,26(9-10):653-656.
[5]Babiker M A,Sanom N,Hisashi H.Random and targeted gene integrations through the control of non-homologous end joining in the yeastKluyveromycesmarxianus[J].Yeast,2010,27(1):29-39.
[6]Douglas C P,Vineet R,Nancy A,etal.Sequential gene integration for the engineering ofKluyveromycesmarxianus[J].Journal of Biotechnology,2007,127(3):408-416.
[7]刘向勇,沈 煜,郭 亭,等.rDNA介导的多拷贝整合表达载体的构建及其在酿酒酵母工业菌株中的应用[J].山东大学学报:理学版,2005,40(3):105-109.LIU Xiang-yong,SHEN Yu,GUO Ting,etal.Construction of a ribosomal DNA multi-copy integration vector and application in the industrialSaccharomycescerevisiaestrain [J].Journal of Shandong University:Natural Science,2005,40(3):105-109.(in Chinese)
[8]葛菁萍,曹喜生,宋 刚,等.木酮糖激酶基因整合表达载体构建及在酿酒酵母中的过表达[J].微生物学报,2010,50(6):762-767.GE Jing-ping,CAO Xi-sheng,SONG Gang,etal.Construction of integrative vector for xylulokinase gene and its overexpression inSaccharomyces cerevisiae[J].Acta Microbiologica Sinica,2010,50(6):762-767.(in Chinese)
[9]支晓慧,王丽娜,朱 平,等.基于rDNA序列的酵母整合载体的构建及应用 [J].中国医药生物技术,2011,6(5):330-335.ZHI Xiao-hui,WANG Li-na,ZHU Ping,etal.Construction and application ofSaccharomyces cerevisiaeintegration vector based on rDNA sequence [J].Chinese Medicinal Biotechnology,2011,6(5):330-335.(in Chinese)
[10]姜 勇,张学成,孙平楠,等.以rDNA为同源重组位点酵母表达鲑鱼降钙素基因多拷贝整合载体的构建[J].中国海洋大学学报:自然科学版,2009,39(3):443-447.JIANG Yong,ZHANG Xue-cheng,SUN Ping-nan,etal.Construction of a ribosomal DNA multi-copy integration vector forSaccharomycescerevisiaeexpressing salmon calcitonin [J].Periodical of Ocean University of China, 2009,39(3):443-447.(in Chinese)
[11]唐南筠,霍克克,李育阳.乳酸克鲁维酵母高拷贝整合载体的构建及应用[J].生物化学与生物物理学报,1996,28(5):540-546.TANG Nan-jun,HUO Ke-ke,LI Yu-yang.The construction and application of the multi-copy integration vector inK.lactis[J].Acta Biochimica et Biophysica Sinica,1996,28(5):540-546.(in Chinese)
[12]Klabunde J, Kunze G, Gellissen G,etal.Integration of heterologus genes in several yeast species using vectors containing aHansenula polymorpha-derived rDNA-targeting element [J].FEMS Yeast Research,2003,4(4):185-193
[13]李楠楠,袁文杰,王 娜,等.菊粉酶基因在酿酒酵母中的表达及乙醇发酵[J].生物工程学报,2011,27(7):1032-1039.LI Nan-nan,YUAN Wen-jie,WANG Na,etal.Ethanol fermentation fromJerusalemartichoketubers by agenetically-modifiedSaccharomyces cerevisiaestrain capable of secreting inulinase[J].Chinese Journal of Biotechnology,2011,27(7):1032-1039.(in Chinese)
[14]Sambrook J,Fritsch E F,Maniatis T.Molecular Cloning:A Laboratory Manual[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,1989.
[15]ZHANG Ling-hua,WANG Jing,Ohta Y,etal.Expression of the inulinase gene fromAspergillus nigerinPichiapastoris[J].Process Biochemistry,2003,38(8):1209-1212.
[16]ZHANG Ling-hua, ZHAO Chang-xin, WANG Jing,etal.Inhibition of glucose on an exoinulinase fromKluyveromycesmarxianusexpressed inPichia pastoris[J].Process Biochemistry,2005,40(5):1541-1545.
[17]LIU Xiao-yan,CHI Zhen-ming,LIU Guang-lei,etal.Inulin hydrolysis and citric acid production from inulin using the surface-engineeredYarrowia lipolyticadisplaying inulinase [J].Metabolic Engineering,2010,12(5):469-476.
[18]Duvnjak Z,Kosaric N,Hayes R D.Kinetics of ethanol production fromJerusalemartichokejuice with someKluyveromycesspecies[J].Biotechnology Letter,1981,3(10):589-594.
