帕金森病患者尿酸、超氧化物歧化酶和血清营养指标的变化
2013-09-25王引明孔亮胡玲玲
王引明 孔亮 胡玲玲
近几年来,尿酸(uric acid,UA)与帕金森病(parkinson’s disease,PD)之间的关系已成为PD研究的热点之一。研究表明低UA水平人群PD的发病率较高,这与UA的抗氧化作用有关,因此推出UA是治疗PD的新靶点[1-5]。然而研究报告表明营养不良人群PD发病率增高[6]。因此,低UA水平可能为PD患者营养不良的一个指标,但目前的相关报道少见。为此,本文对近1年来无锡市第三人民医院PD患者的UA、抗氧化作用的标志物超氧化物歧化酶(superoxide dismutase,SOD)和营养指标[白蛋白、前白蛋白和视黄醇结合蛋白(retinol-binding protein,RBP)],进行检测,进一步探讨 UA与PD之间的关系。
1 资料与方法
1.1 一般资料 选取2012年4月~2013年4月本院住院和门诊的71例PD患者,所有患者的诊断均符合英国PD协会的诊断标准,排除继发性帕金森病综合征,同时排除并发代谢综合征、肿瘤、严重心脏、肝脏和肾脏疾患的患者。另外选择性别和年龄与PD患者相近的健康体检人员作为对照组。其中①PD组:71例,男39例,女32例;年龄56~90岁,平均(74.44±7.92)岁;病程1~15年;依照Hoehn&Yahr分级H-Y分级,早期1~2级27例,中期3级21例,晚期4~5级23例。②对照组:30例,男19例,女11例;年龄60~85岁,平均(73.23±8.65)岁。
1.2 方法 所有受试对象均采用早晨空腹抽取静脉血5 ml,应用美国Beckman XI800全自动化学发光仪检测测定血UA、SOD、白蛋白、前白蛋白和RBP。
1.3 统计学方法 应用SPSS 11.5软件进行统计学分析;计量资料用均数±标准差±s)表示,两组间比较采用独立t检验;相关性分析采用Spearman相关分析;计数资料采用χ2检验;双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 PD组和对照组血UA、SOD、白蛋白、前白蛋白和RBP的比较 PD组和对照组性别和年龄比较,差异无统计学意义(P>0.05);PD组血UA、SOD、白蛋白、前白蛋白和RBP均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
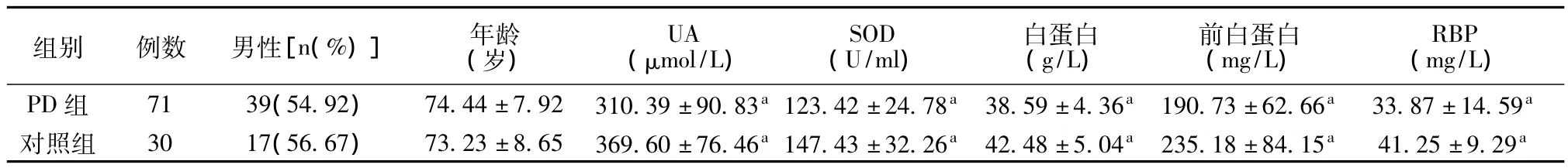
表1 PD组和对照组血UA、SOD、白蛋白、前白蛋白和RBP的比较
2.2 PD患者血UA与年龄、SOD、白蛋白、前白蛋白和RBP的相关性分析 PD患者UA水平与SOD、白蛋白、前白蛋白和RBP正相关(P<0.05),与年龄、H-Y分级和病程负相关(P<0.05),按照相关性绝对值由高到低分别为H-Y分级、病程、前白蛋白、RBP、SOD、白蛋白和年龄。见表2。

表2 PD患者血UA与年龄、SOD、白蛋白、前白蛋白和RBP的相关性分析
2.3 PD患者血SOD与年龄、UA、白蛋白、前白蛋白和RBP的相关性分析 SOD水平UA、白蛋白、前白蛋白和RBP正相关(P<0.05),与年龄和病程负相关(P<0.05),与H-Y评分无明显相关性(P>0.05),按照相关性绝对值由高到低分别为白蛋白、年龄、前白蛋白、UA、RBP和病程。见表3。

表3 PD患者血SOD与年龄、UA、白蛋白、前白蛋白和RBP的相关性分析
3 讨论
目前PD的发病机制尚不明确,主要与年龄因素、遗传因素、基因突变和环境因素变化等有关。新近的研究表明低UA水平为PD的危险因素,提出UA为PD患者治疗的新靶点[5]。但UA增高为心脑血管病的危险因素,目前尚缺乏PD患者心脑血管病的发病率的临床报告,但显然单纯增加UA水平会增加患者心脑血管病的风险。1981年,Ames等研究表明UA作为抗氧化剂可以抑制增年进程和减少肿瘤的发病率,PD患者血清和黑质内的UA水平明显偏低,为低UA增加PD提供了理论依据,为此相关研究论文层出不穷[7]。然而研究表明,PD患者的营养不良发生率亦明显增高[6],因此低UA水平可能为营养不良导致的可能性,但目前相关研究报告少见。
虽然目前有证据表明低UA水平为PD的危险因素,但德国的一项调查研究表明,PD患者食用较多的巧克力、甜食、动物内脏等,因此,进食富含嘌呤的食品不能降低PD的发病率,恰恰相反,少进食引起UA增高的食品如啤酒却降低了PD的发病率[8]。因此,单纯提高UA水平不能降低PD的发病率,低UA水平增加PD的发病率可能与其营养不良或营养不均衡有关。因为食物中其它成分如辅酶Q10、谷胱甘肽可以抑制PD患者的进程和预后。本研究表明,PD患者UA水平低于对照组,与目前多数研究相吻合[4,5];PD 患者UA水平与患者营养指标的标志物白蛋白、前白蛋白和RBP成正相关,推测低UA水平提示PD患者存在营养不良。虽然UA主要为自身合成,但其水平受饮食的影响较大,高嘌呤饮食患者的UA水平明显高于低嘌呤饮食患者。本研究提示前白蛋白与UA的相关性高于白蛋白,由于白蛋白主要反映患者既往的营养状况,而前白蛋白主要反映患者近期的营养状况,支持UA水平受患者近期饮食因素影响较大的观点。因此,低UA人群PD发病率的增加可能与此部分患者存在营养不良有关,这与目前有关的调查研究显示PD营养不良发生率较高相吻合[6]。因此,对PD患者应该予合理膳食和均衡的营养支持如提高患者辅酶Q10、谷胱甘肽等的水平,而非单纯提高患者的UA水平。
自由基尤其是过氧化亚硝酸盐导致蛋白质、核酸和生物膜等损伤是PD的发病机制之一。自由基清除系统主要包括酶促系统和非酶促系统,前者主要是SOD、过氧化物酶及过氧化氢酶,后者如维生素C、维生素E、谷胱甘肽和UA等。高UA水平人群PD的发病率减少推测与其抑制氧化损伤导致线粒体功能衰退有关。其主要机制UA是作为一种天然的抗氧化剂和自由基清除剂,能够阻止SOD的降解,SOD可以清除血液中氧自由基,降低线粒体膜的去极化,减轻了多巴胺神经元的损伤。本研究表明,PD患者SOD水平低于对照组,与目前研究相吻合[5]。SOD水平与患者的年龄和病程负相关,与患者的营养状况和UA正相关。但UA对SOD的影响明显低于患者年龄和营养指标如白蛋白等。因此,虽然多数动物实验表明,UA对PD的发生和发展有重大的影响,但由于物种的不同,人类在进化过程中失去了降解UA的能力,UA抗氧化功能在人类和其他哺乳动物尤其鼠类是不同的,其在人类抗氧化作用可能尚不及维生素C。其主要原因是UA在人体内血浓度虽然明显高于维生素C,但UA的抗氧化作用主要通过与自由基形成UA盐自由基,而后者需要维生素C才能清除。目前尚未见在人类开展增加UA水平与SOD活性的相关性研究,但早期有关补充维生素C对PD患者SOD的研究表明,服药后患者的SOD活性无明显变化[9]。因此,本研究表明,PD患者血尿酸、SOD和营养指标均偏低,低尿酸水平与PD患者营养不良有关;UA对PD患者的SOD的影响较小;对于PD患者单纯增加UA水平需要慎重,合理膳食和确当的营养支持有助于改善PD患者的预后。
[1] Schlesinger L,Schlesinger N.Uric acid in Parkinson’s disease.Mov disord,2008,23(12):1653-1657.
[2] 李丹,王晓君,罗蔚锋,等.尿酸对帕金森病患者不同认知功能域影响分析.中华神经科杂志,2010,43(6):400-402.
[3] 王丽君,罗蔚锋,王恒会,等.尿酸对6-羟基多巴胺致大鼠黑质纹状体系统毒性的影响.中华医学杂志,2010,90(19):1362-1365.
[4] 刘涛,陈峰,文国强,等.老年帕金森病患者血尿酸水平及其与认知功能的关系.中华老年医学杂志,2011,30(8):629-631.
[5] 黄婷婷,罗蔚锋,刘春风.尿酸-帕金森病防治的潜在新靶点.中华神经医学杂志,2012,11(11):1179-1181.
[6] Sheard JM,Ash S,Silburn PA,et al.Prevalence of malnutrition in Parkinson’s disease:a systematic review.Nutr Rev,2011,69(9):520-532.
[7] 李波,刘少波.尿酸水平与帕金森病关系的研究进展.新医学,2012,43(2):129-132.
[8] 潘敬菊,谭晓东,罗韵文,等.帕金森病的营养和环境危险因素调查.环境与职业医学,2008,25(6):553-556.
[9] 许继平,蔺新英,李玉莲.维生素E、C在CVD与PD患者中抗氧化作用的临床研究.中风与神经疾病杂志,2001,18(3):159-161.
