核桃内生菌HT3对番茄和黄瓜的促生作用
2013-09-15王美琴卢海波赵立娟郝晓娟
王美琴,卢海波,赵立娟,郝晓娟
(1.山西农业大学农学院,山西太谷030801;2.祁县峪口乡人民政府,山西祁县030900)
随着社会生产力的发展,人们对生活环境质量愈来愈关注,对绿色食品的要求亦愈迫切,这就不可避免地要求限制化学农药的使用量及应用范围。近年来,应用微生物代替(或部分代替)化肥和农药,越来越受到各国政府及学者的高度重视[1]。植物内生菌与寄主植物在长期共同进化过程中形成了密切的相互关系,且生存微环境稳定,成为化肥、农药和其他微生态制剂的最佳竞争者,其合理应用将减少化学农药造成的环境污染、提高农田生态系统的生物多样性和有利于保持生态平衡[2-4]。据报道,植物内生菌的代谢产物中具有促进植物生长的物质如植物生长素、乙烯、赤霉素和细胞分裂素等,可直接促进植物生长。Sturz等[5]对从马铃薯和红三叶草中分离的内生细菌研究发现,有21%对寄主生长有促进作用,13%对寄主生长表现为抑制作用。Tien等[6]就内生细菌对植物促生作用的机制进行研究,结果表明,内生细菌可以通过生物固氮或产生植物激素直接促进植物生长;Lazarovits等[7]证明,内生细菌可以通过诱导寄主植物产生植物激素;何红等[8]在研究内生枯草芽孢杆菌BS-1,BS-2菌株对辣椒和白菜促生作用机制中也发现,用菌株培养液浸种后,导致植株体内生长素(IAA)、赤霉素( GA3)和玉米素( ZR4)等植物内源激素含量增加,脱落酸(ABA)含量下降。Xu等[9-10]研究表明,内生细菌还可以通过改变寄主植物对霜冻等有害环境条件及有害病原生物的敏感性或防止植物病害的发生等促进植物生长。
为了研究山西农业大学农学院植物病害生防作用课题组分离筛选出的对核桃腐烂病菌具有拮抗作用的内生菌株HT3是否具有促生功能,本试验研究了该菌株代谢产物对番茄、黄瓜种子萌发和幼苗生长的影响。
1 材料和方法
1.1 材料
细菌培养用牛肉膏蛋白胨培养基(NA),即蛋白胨7.5 g,牛肉浸膏3.0 g,葡萄糖2.5 g,琼脂20.0 g,蒸馏水 1 000 mL,pH值7.0~7.2。 不加琼脂为液体培养液(NB)。
内生菌HT3是由山西农业大学植物病理实验室从健康的核桃枝条中分离筛选出的拮抗菌株。供试作物种子为番茄(海红一号)和黄瓜(津研四号)。
1.2 内生菌HT3培养滤液的制备
核桃内生菌HT3在NA斜面培养基上培养24 h后,取两环接种于装液量为100 mL、体积为250 mL的锥形瓶,置于28℃,160 r/min,振荡培养48 h即为菌株培养液,再置于18 000 r/min的离心机上离心15 min,其上清液用直径0.45μm过滤膜过滤后,过滤液在4℃的条件下进行保存备用。
1.3 内生菌株HT3培养滤液对番茄、黄瓜种子萌发的影响
将1.2制备的培养滤液原液用无菌水分别稀释为 1.25,2,5,10,20,100倍。 将黄瓜、番茄种子分别浸泡在不同倍数的稀释滤液中12,24 h后,放在铺有滤纸的无菌培养皿中,每皿放20粒种子,每个处理3次重复,在25℃的恒温箱中培养,每天按时用无菌水补足水分以保持滤纸潮湿。3 d后观察和记录种子的发芽率以及胚芽生长量。以空白培养液的离心上清液作为对照[11-12]。
1.4 内生菌株HT3培养滤液对黄瓜、番茄幼苗生长的影响
分别用稀释10倍的HT3培养滤液、NB培养液和无菌水浸泡黄瓜和番茄种子12 h,然后播种于无菌土花盆中,每盆播种15粒,每处理重复3次,置于人工气候箱中培养(白天25℃,晚上20℃),出苗后调查出苗率。每盆选大小一致的10株苗(其余的剔除),于播种后20 d分别测定其株高、茎粗、根长及植株的鲜质量,植株干质量于80℃烘干3 h后称量[13-14]。
2 结果与分析
2.1 内生菌HT3培养滤液对番茄、黄瓜种子发芽率的影响
试验结果表明,种子的发芽率与培养滤液的稀释倍数、浸泡时间没有相关性,在所测试的稀释倍数范围内,种子的萌发率与对照相比,差异不显著。
2.2 内生菌HT3培养滤液对番茄、黄瓜种子胚芽生长量的影响
由图1可知,用不同稀释倍数的菌株HT3培养滤液处理的番茄、黄瓜种子都能够正常发芽生长,但不同稀释倍数对胚芽的生长量影响不同。HT3培养滤液在稀释5~100倍之间对番茄、黄瓜种子的萌发具有明显地促生作用,在这一稀释倍数范围内胚芽的生长量明显大于对照,当培养滤液稀释10倍时,番茄和黄瓜种子胚芽的生长量分别为对照的215%和142%;当稀释倍数小于5倍时,对胚芽的生长出现了抑制作用,并随着稀释倍数的降低抑制作用愈来愈强。当稀释1.25倍时,种子不萌发。

2.3 番茄种子在内生菌HT3培养滤液中浸泡不同时间后胚芽和胚根的生长量
从图2可以看出,内生菌HT3稀释10倍的培养滤液浸泡番茄种子后,胚根和胚芽的生长量均显著大于对照,种子浸泡12 h后,无论是胚芽的生长量还是胚根的生长量都明显高于浸泡24 h。12 h处理的种子胚芽长度为31.5 mm,24 h处理的种子胚芽长度为29.3 mm。

2.4 内生菌HT3培养滤液对番茄和黄瓜种子幼苗的促生作用
从表1可以看出,稀释10倍的HT3培养滤液浸种处理对幼苗生长有明显的促生作用,与对照相比差异显著,增加了番茄和黄瓜幼苗的平均鲜质量和干质量,且与对照相比,增加均达到130%以上;番茄和黄瓜幼苗的平均株高与对照相比,分别增加31.66%和68.02%,平均茎粗与对照相比,分别增加86.54%和69.35%。结果还表明,空白NB培养液浸种对番茄和黄瓜幼苗的生长虽然与菌株培养滤液相比差距大,但与无菌水相比均有不同程度的促进作用,可见空白NB培养液中的营养成分也可促进种子的萌发。
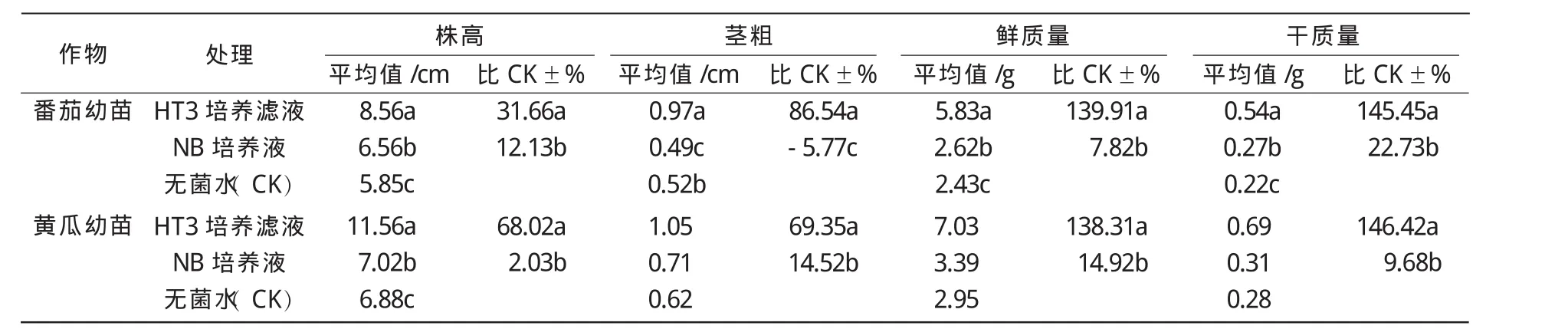
表1 内生菌HT3培养滤液对番茄和黄瓜幼苗的促生作用
3 结论与讨论
关于植物内生菌的促生作用国内已有许多相关的报道,涉及的植物有农作物、蔬菜及水果等各个领域[11-16]。本试验结果表明,核桃内生菌HT3菌株对番茄和黄瓜种子的萌发和幼苗的生长都具有明显促生作用。菌株培养滤液处理的番茄和黄瓜植株苗比清水处理的健壮、叶片大、叶色浓绿、茎秆粗、根毛长。菌液处理的种子萌发后胚芽和胚根的生长量都明显高于对照,但不同稀释倍数的菌株培养滤液对种子的促生作用是不同的。当稀释倍数太低时反而对种子萌发有抑制现象,出现这种现象的原因可能是由于内生菌代谢产物——生长激素类物质高造成的。所以,在利用内生菌作为生物肥料时,应将内生细菌的有效含量控制在一定范围内。同时结果显示,内生菌的培养液对种子浸泡12 h后的促生作用更好。种子的发芽率与是否经过培养液的处理之间没有相关性,本试验中所使用的内生菌在稀释倍数大时,对番茄和黄瓜种子没有明显的毒害作用。关于菌株HT3的生防作用方面还未见报道,山西农业大学农学院核桃内生菌对植物病害生防作用课题组前期研究表明,该菌株对多种病原菌具有抑制作用,有关该菌株的其他方面如生物活性物质的主要成分及分子结构、在田间的生防作用及促生功能受环境因素的影响等还有待于研究。本研究为具有防病、促生、固氮等多功能菌株的开发应用和植物病害的生物防治提供了有用的资源。
[1]孔庆科,丁爱云.内生细菌作为生防因子的研究进展[J].山东农业大学学报,2001,32( 2):256-260.
[2]高俊明,李新凤,马丽娜,等.番茄内生放线菌ts-6及其次生代谢产物对番茄灰霉病的防病效果 [J].山西农业科学,2007,35( 10):31-33.
[3]杨水英,李振轮,青玲,等.产几丁质酶内生细菌的筛选及对烟草赤星病菌的抑制作用 [J].河南农业科学,2007(6):66-69.
[4]孙侨南,李进才.小麦内生细菌对全蚀病发生的影响[J].天津农业科学,2008,14( 5):57-60.
[ 5] Sturz A V,Christie BR,Matheson B G.Associations of bacterial endophytes populations from red clover and potato crops with potential for beneficial allelopathy[J].Microbiol,1998,44:162-167.
[ 6] Tien T M,Gaskins M H,Hubell D H.Plant growth substances produced by Azospirillum brasilense and their effect on the growth of pearl millet( Pennisetum americanum L.) [J].Appl Environ Microbiol,1979,37:1016-1024.
[ 7] Lazarovits G,Nowak J.Rhizobateria fox improvement of plant growth and establishment[J].Hortscience,1997,32:188-192.
[8]何红,蔡学清,兰成忠,等.辣椒内生菌BS-2在白菜体内的定殖、促生和防炭疽病作用[J].植物保护学报,2004,31(4):347-352.
[ 9] Xu H,Griffith M,Patten CL,et al.Isolation of an antifreezeprotein with ice nucleation activity from the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J].Microbiol,1998,44:64-73.
[ 10] Fredrickson J K,Elliott L F.Effects on winter wheat seedling growth by toxin producingrhizobacteria[J].Plant Soil,1985,83:399-409.
[11]王美琴,陈俊美,薛丽,等.内生枯草芽孢杆菌Thhy1的促生和定殖力研究[J].中国农学通报,2011,27( 6):196-199.
[12]邢鲲,韩巨才,刘慧平,等.油菜内生细菌yc8促生作用及其机理研究[J].华北农学报,2007,22( 5):180-183.
[13]沈丽珍,梁峰,王忠,等.马铃薯内生细菌StC01的鉴定与促生作用[J].江苏农业科学,2008( 1):143-146.
[14]易龙,马冠华,肖崇刚.烟草生防益菌对烟草幼苗的促生效应研究[J].中国农学通报,2006,22( 2):331-333.
[15]田宏先,崔林,王秀英,等.马铃薯内生促生菌的促生长作用[J].山西农业科学,2003,31( 1):28-30.
[16]张海燕,张颖,王磊.防治小麦纹枯病有益内生细菌的筛选[J].河南农业科学,2011,40( 6):87-89.
