痰热清注射液中熊胆粉部分指纹图谱和成分测定
2013-09-14简龙海闻宏亮毛秀红
简龙海, 闻宏亮, 毛秀红, 夏 晶, 王 柯, 季 申
(上海市食品药品检验所,上海201203)
痰热清注射液具清热、化痰、解毒之功效,处方由黄芩、熊胆粉等五味药材组成。其中熊胆粉为熊科动物黑熊Selenaretos thibetanus Cuvier经胆囊手术引流胆汁而得的干燥品[1],主要成分为胆汁酸,并主要以牛磺熊去氧胆酸、牛磺鹅去氧胆酸等结合型形式存在[2-3]。在制法中,熊胆粉先经过水解、提取等步骤,制得中间体熊胆粉提取物后再制备注射液。理论上,痰热清注射液中的胆汁酸应以游离型胆汁酸为主。游离型胆汁酸有的活性强、毒性小,如熊去氧胆酸[4],有的活性与毒性并存,如鹅去氧胆酸[5],因此需要严格控制胆汁酸的量。目前痰热清注射液中胆汁酸的测定集中在熊去氧胆酸和鹅去氧胆酸上[6-7],未见其余胆汁酸的测定报道。
关于熊去氧胆酸、鹅去氧胆酸的测定方法,有HPLC-ELSD 法[6-8]、HPLC-UV 法[9-10]、GC 法[11]、TLC法[12]、近红外漫反射光谱法[13]等。GC 法需要先衍生反应后再分析。痰热清注射液成分复杂,TLC法和近红外漫反射光谱法均不能满足测定要求。HPLC-ELSD法虽可测定熊去氧胆酸、鹅去氧胆酸[6-7],但由于熊去氧胆酸的含有量较高,其余胆汁酸的含有量较低,若同时测定指纹图谱,熊去氧胆酸的信号过强,呈平头峰形,故定量测定与指纹图谱在HPLC-ELSD上难以同时兼顾。HPLC-UV法在一定条件下可用于熊去氧胆酸、鹅去氧胆酸的定量测定[9]及熊胆粉的指纹图谱分析[10],但尚未应用于痰热清注射液的测定。
本实验建立了HPLC-UV法同时测定痰热清注射液中熊去氧胆酸和鹅去氧胆酸,并在此基础上,测定痰热清注射液中熊胆粉部分所有主要胆汁酸的指纹图谱,方法简便、可行,可为有效控制产品质量提供依据。
1 仪器与试药
1.1 仪器 Agilent 1100型高效液相色谱仪 (美国Agilent公司);Waters 1525型高效液相色谱仪 (美国Waters公司);BP211D电子天平 (德国Sartorius公司)。
1.2 试药 熊去氧胆酸 (中国药品生物制品检定所提供,批号0755-9003);鹅去氧胆酸 (中国药品生物制品检定所提供,批号110806-200303);乙腈、甲醇 (均为色谱纯,德国Merck公司);水为纯净水;其余试剂均为分析纯 [中国医药 (集团)上海化学试剂公司]。痰热清注射液及熊胆粉提取物由上海凯宝药业有限公司提供。
2 方法与结果
2.1 对照品溶液的制备 取熊去氧胆酸对照品和鹅去氧胆酸对照品适量,精密称定,用甲醇溶解并制成每1 mL中含熊去氧胆酸5.0 mg、鹅去氧胆酸0.8 mg的混合溶液,摇匀,即得。
2.2 痰热清注射液供试品溶液的制备 取痰热清注射液作为供试品溶液A。
2.3 熊胆粉提取物供试品溶液的制备 取熊胆粉0.15 g,精密称定,置10 mL量瓶中,加甲醇振摇使溶解,用甲醇定容至刻度,摇匀,作为供试品溶液B。
2.4 空白溶液 (缺熊胆粉)的制备 取空白样品(缺熊胆粉),按痰热清注射液质量标准中的处方量和制法项下要求制成空白溶液。
2.5 色谱条件 Waters Atlantis C18(4.6 mm×15cm,5μm)色谱柱;乙腈为流动相A相,0.1%磷酸为B相,梯度洗脱程序见表1;柱温30℃;体积流量为1 mL/min;检测波长为203 nm;进样20μL。对照品、空白 (缺熊胆粉)及供试品色谱图见图1~4。

表1 梯度洗脱Tab.1 Gradient elution

图1 对照品图谱Fig.1 HPLC chromatogram of reference substances

图2 空白样品 (缺熊胆粉)Fig.2 HPLC chromatogram of sample w ithout bear bile powder
2.6 指纹图谱
2.6.1 指纹图谱方法学考察
2.6.1.1 相似度计算中共有峰的确立 根据痰热

图3 痰热清注射液样品Fig.3 HPLC chrom atogram of Tanreqing Injection sam ple
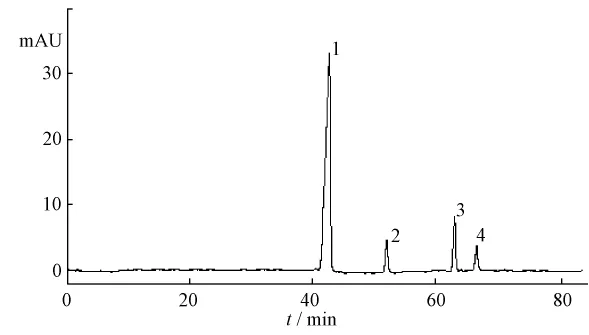
图4 熊胆粉提取物Fig.4 HPLC chromatogram of bear bile powder sam ple
清注射液成品、中间体熊胆粉提取物及空白溶液(缺熊胆粉)的测定结果,痰热清注射液成品中与熊胆粉有关的共有峰主要有4个 (见图1~4),其中峰1(熊去氧胆酸)面积在4个峰总面积中的比例较高 (约为75% ~80%),对相似度计算结果的影响过大,故在相似度计算中对峰1进行屏蔽。
2.6.1.2 精密度试验 取供试品溶液A,连续测定6次,结果峰1~峰4的峰面积RSD分别为1.3%、4.8%、2.0%、5.9%。以熊去氧胆酸为参照物,计算峰2~峰4的相对保留时间和相对峰面积,结果相对保留时间RSD≤0.2%,相对峰面积RSD≤5.4%。以中药色谱指纹图谱相似度评价系统计算相似度,结果相似度≥0.99,表明仪器精密度良好。
2.6.1.3 重复性试验 取供试品溶液A,一式6份,依法测定,同2.6.2方法计算相对保留时间、相对峰面积和相似度,结果相对保留时间RSD≤0.2%,相对峰面积RSD≤4.7%,相似度≥0.99,
表明方法重复性良好。
2.6.1.4 稳定性试验 取供试品溶液A,分别在室温放置0、6、12、18、24 h后测定,结果峰1~峰4的峰面积RSD分别为0.5%、3.5%、0.5%、3.0%。同2.6.1.2项方法计算相对保留时间、相对峰面积和相似度,结果相对保留时间均RSD≤0.2%,相对峰面积均 RSD≤3.8%,相似度≥0.99,表明供试品溶液A在24 h内基本稳定。
2.6.2 痰热清注射液中熊胆粉部分对照指纹图谱的建立及13批成品的测定 取13批成品进行测定,通过相似度软件获得对照指纹图谱,结果见图5、表 2。13批成品的相似度分别为 0.998、0.997、 0.999、 0.989、 0.999、 0.998、 0.999、0.998、0.999、0.999、0.998、0.999、0.989。
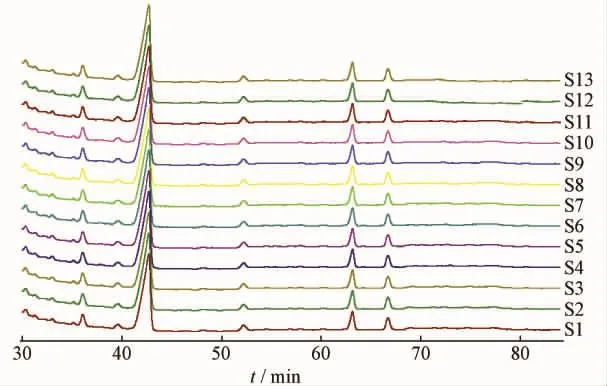
图5 痰热清注射液熊胆粉部分13批次样品HPLC图谱Fig.5 HPLC chromatograms of 13 batches of Tanreqing Injection sample

表2 指纹图谱中共有峰相对保留时间及峰面积Tab.2 Relative retention time and relative peak area of co-possessing peaks and their RSDs
2.7 样品测定
2.7.1 线性关系考察 分别取熊去氧胆酸对照品和鹅去氧胆酸对照品适量,精密称定,分别用甲醇溶解并制成每1 mL中含熊去氧胆酸 13.064 mg、17.14 mg的对照品溶液和每1 mL中含鹅去氧胆酸5.21 mg的对照品溶液。分别精密吸取质量浓度为13.064 mg/mL的熊去氧胆酸对照品溶液0.5、1、2、5、10、20μL,质量浓度为17.14 mg/mL的熊去氧胆酸对照品溶液40μL,质量浓度为5.21 mg/mL的鹅去氧胆酸对照品溶液0.5、1、2、5、10、40μL,注入液相色谱仪,记录色谱图。以峰面积为纵坐标,进样量为横坐标,绘制标准曲线,得熊去氧胆酸回归方程Y=8.688X+8.141(r=0.999 9),鹅去氧胆酸回归方程 Y=8.213X+1.139(r=0.999 9)。结果表明:熊去氧胆酸进样量在6.532μg~685.6μg范围内、鹅去氧胆酸进样量在2.605μg~208.4μg范围内均呈良好的线性关系。
2.7.2 精密度试验、稳定性试验 分别同2.6.1.2、2.6.1.4。
2.7.3 重复性试验 取供试品溶液A 6份,测定,计算,结果熊去氧胆酸、鹅去氧胆酸RSD分别为1.1%、1.5%,表明该方法重复性良好。
2.7.4 回收率试验 取供试品溶液A 9份,每份0.8 mL(分别含熊去氧胆酸4.896 mg、鹅去氧胆酸0.672 mg),分别置2 mL量瓶中,各精密加入熊去氧胆酸对照品溶液 (质量浓度为13.064 mg/mL)0.3、0.4、0.5 mL和鹅去氧胆酸对照品溶液 (质量浓度为5.21 mg/mL)0.1、0.2、0.3 mL,加甲醇至刻度,摇匀,测定,计算加样回收率及其RSD,结果见表3。

表3 加样回收率实验结果(n=9)Tab.3 Results of recovery tests(n=9)
2.7.5 样品测定 取13批痰热清注射液成品,测定,结果见表4。

表4 痰热清注射液样品中熊去氧胆酸和鹅去氧胆酸测定结果Tab.4 Results of ursodesoxycholic acid and chenodeoxycholic acid in Tanreqing Injection
3 讨论
3.1 指纹图谱中各峰的确认 将流动相中磷酸改为甲酸,其余不变,采用LC-DAD-MSn联用仪,对4个共有峰进行确认,结果峰1、峰3分别为熊去氧胆酸、鹅去氧胆酸,峰2、峰4均为胆汁酸,具体结构式将进一步研究。
3.2 色谱柱的考察 分别取3种色谱柱 [Waters Atlantis dC18色谱柱 (5μm,4.6 mm×15 cm);Dikma Kromasil C18色谱柱 (5μm,4.6 mm×15 cm);Dikma Kromasil C18色谱柱 (5μm,4.6 mm×25 cm)]进行分析,结果均无干扰。
3.3 柱温和体积流量的考察 分别在柱温25、30、40℃和体积流量为0.8、1.0、1.2 mL/min时进样测定,结果柱温和体积流量的变化对分离度、峰形均无明显影响;柱温的变化对峰面积和保留时间的影响不大;体积流量对峰面积的影响较大,体积流量越大,峰面积越小,但对指纹图谱、定量测定结果均无明显影响。
[1]卫生部药典委员会.中华人民共和国卫生部药品标准新药转正标准:第十一册[S].1997:44.
[2]徐愚聪,王 野.熊胆粉的研究进展[J].华西药学杂志,2000,15(3):200-202.
[3]连常宝.熊胆粉的药理作用及临床应用研究概述 [J].海峡药学,2008,20(8):71-75.
[4]刘 直,李 瑜.简述熊去氧胆酸的药理作用 [J].中成药,1990,12(1):33-34.
[5]郑 兴.熊去氧胆酸与鹅去氧胆酸的对比研究 [J].内蒙古科技与经济,2008,2(156):28-32.
[6]娄玉霞,聂桂华,刘乃强.HPLC-ELSD法测定痰热清注射液中黄芩苷、熊去氧胆酸、鹅去氧胆酸3种成分的含量[J].中国中药杂志,2009,34(14):1862-1864.
[7]王 珏,瞿海斌,邵 青.HPLC-UV-ELSD法同时测定痰热清注射液中主成分含量 [J].药物分析杂志,2009,29(11):1804-1807.
[8]李丽敏,钱大公,王 柯,等.熊胆粉提取物中熊去氧胆酸和鹅去氧胆酸的HPLC-ELSD测定[J].中国医药工业杂志,2009,40(1):39-40.
[9]朱丽玢,洪筱坤.HPLC法定量分析熊胆中胆酸类化合物[J].中草药,2004,35(11):1255-1257.
[10]沈丽娟,丁桂兰,唐秋竹.注射用熊胆粉及其原料熊胆粉指纹图谱研究 [J].药物研究,2004,13(9):23-24.
[11]Patrick PH,ElliottW H.Analysis ofbile acids seerols by highperformance liquid chromatography with a microbore column[J].JChromatogr,1985,347:155-162.
[12]张志荣,廖工铁,宋雨清,等.中药复方中熊去氧胆酸和鹅去氧胆酸的含量测定[J].中国中药杂志,1995,20(3):162-164.
[13]李文龙,刘绍勇,薛东升,等.近红外漫反射光谱法快速测定熊胆粉提取物中熊去氧胆酸和鹅去氧胆酸的含量 [J].中国药学杂志,2010,45(19):1500-1503.