甘薯病毒病害(SPVD)的多重RT-PCR检测方法及其应用
2013-09-11兰新芝张德胜秦艳红田雨婷张振臣
张 盼, 兰新芝, 乔 奇, 张德胜,秦艳红, 田雨婷, 王 爽, 张振臣*
(1.河南省农业科学院植物保护研究所,郑州 450002;2.河南省农作物病虫害防治重点实验室,郑州 450002;3.河南省新县农业局植保站,新县 465500)
甘 薯 病 毒 病 害 (sweet potato virus diseases,SPVD)是由甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus,SPCSV)和甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)协生共侵染甘薯引起的病毒病害[1]。感染SPVD的甘薯表现植株矮化,叶片褪绿、畸形等症状。SPVD对甘薯产量影响极大,严重时可造成90%以上的产量损失,甚至绝收,是甘薯上的毁灭性病害[2-3]。张振臣等[4]利用血清学、分子生物学和嫁接传染试验等方法首先发现了SPVD在我国的发生,目前主要分布在广东、江苏、四川、安徽和福建等地。为了加强对SPVD的预警和控制,防止该病的进一步蔓延危害,有必要建立快速、高效的检测技术。
用于甘薯病毒检测的常用方法是酶联免疫吸附技术(ELISA)和PCR技术,ELISA检测技术耗时长、灵敏度较低,而且需要分别检测SPCSV和SPFMV才能确定SPVD是否存在。另外,SPCSV在中国存在2个株系(EA和 WA),SPFMV存在4个株系(O、RC、EA和C),其中 O、RC和EA 3个株系的关系相对较近,将它们归为一类,称之为SPFMV CH 株系类型(SPFMV-CH);C株系与其他3个株系的关系较远,称之为SPFMV CH2株系类型(SPFMV-CH2)。目前已有人建议将C株系划分为一个新种[5]。由于SPCSV与SPFMV不同株系的互作可能引起不同的产量损失[6],目前利用ELISA方法还不能有效区分SPFMV的不同株系。而利用单一的RT-PCR进行检测时,需要进行多次PCR反应,工作量大,效率低。多重RT-PCR技术是近年发展起来的一种可用于多种病原体检测的技术,具有特异性强、灵敏性高的特点,能在较短时间内同时完成多种病原的检测,尤其适合于甘薯上一些容易混淆又常常混合侵染的病毒的检测[6-7]。本研究建立了在一次PCR反应中即可检测SPVD是否存在的方法,并且该方法可有效区分SPFMV的两个株系类型,可为SPVD的快速检测以及对该病的监测预警提供技术手段。
1 材料和方法
1.1 病毒材料及质粒
分别在广东惠州、四川南充、江苏徐州等地采集具有典型SPVD症状的甘薯茎蔓栽种于防虫温室中,分别利用血清学方法和普通RT-PCR方法检测SPCSV和SPFMV,以确定感染SPVD的甘薯植株,并通过测定SPFMV外壳蛋白(CP)基因的核苷酸序列来确定SPFMV的株系类型,最后选定若干个SPVD感病植株备用。含SPFMV-CH、SPFMVCH2、甘 薯 潜 隐 病 毒 (Sweet potato latent virus,SPLV)、甘薯脉花叶病毒(Sweet potato vein mosaic virus,SPVMV)CP 基因以及SPCSV Hsp70基因的重组质粒由本实验室构建并保存[8-9]。将经过NCM-ELISA和 RT-PCR检测SPCSV 和SPFMV为阴性的甘薯脱毒试管苗作为阴性对照。从洛阳农林科学院试验田分别采集感染SPVD的甘薯叶片和薯块用于所建立的多重RT-PCR方法的验证。
1.2 酶及试剂(盒)
UNIQ-10柱式总RNA抽提试剂盒为上海生工生物工程公司产品;UNIQ-10柱式DNA胶回收试剂盒购自北京百泰克生物技术公司;RNase抑制剂、AMV反转录酶、Taq DNA聚合酶、pMD19-T载体、T7RNA Polymerase购自TaKaRa公司。其他常用试剂为国产分析纯。
1.3 引物的设计与合成
根据NCBI GenBank中登录的SPCSV Hsp70基因和SPFMVCP基因的核苷酸序列设计了4对特异性引物(表1),引物由上海生工生物工程公司合成。
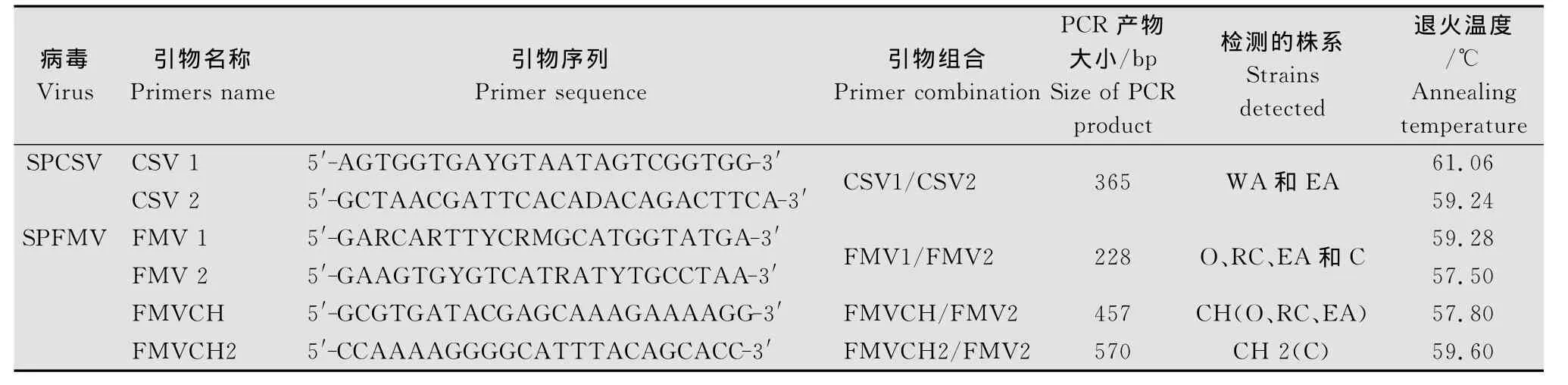
表1 多重RT-PCR扩增的特异性引物Table 1 Specific primers for multiplex RT-PCR amplification
1.4 核酸提取
利用上海生工生物工程公司的Flash UNIQ柱式总RNA抽提试剂盒提取感病甘薯叶片的总RNA。甘薯薯块总RNA的提取参照杨元军等[10]方法进行。
1.5 单一RT-PCR
以提取的感病甘薯叶片总RNA为模板,反转录反应体系为10μL,包括2μL 5×RT buffer,1μL MgCl2(25mmol/L),1 μL dNTP 混 合 物 (各10mmol/L),0.5μL CSV2引物或0.5μL FMV 2引物,0.25μL RNase抑制剂(40U/μL),0.5μL反转录 酶 (AMV Reverse Transcriptase)(5U/μL),4.25μL样品RNA,DEPC-H2O 0.5μL。反应程序为:42℃反转录40min,99℃5min,5℃5min。
PCR反应体系为25μL,包括2.5μL 10×PCR buffer(Mg2+-),0.2μL Taq 酶(5U/μL),0.5μL上游引物(CSV 1、FMV 1、FMVCH 或 FMVCH2)(10 μmol/L),0.5μL下游引物(CSV 2或 FMV 2)(10 μmol/L),1μL dNTP混合物(各10mmol/L),1μL MgCl2(25mmol/L);以2μL反转录产物为模板,用dd H2O补足至25μL。反应程序为:94℃预变性3min;94℃变性30s,56℃退火30s,72℃延伸40s,35个循环;最后72℃延伸10min。扩增产物经1.0%琼脂糖凝胶电泳、UVP凝胶成像系统观察和照相。
1.6 多重RT-PCR反应条件的筛选
以单一RT-PCR反应体系为基础,对影响多重RT-PCR的主要反应条件进行优化,在优化某一条件时,其他条件不变。退火温度分别设50.0、51.9、53.7、55.3、57.6 ℃和60.0 ℃ 6个处理;dNTP 混合物(各2.5mmol/L)分别设0、0.5、1.0、1.5、2.0、2.5μL 6个处理;MgCl2浓度(25mmol/L)分别设0、0.5、1、1.5、2、2.5μL 6个处理,Taq 酶(5U/μL)分别设0、0.1、0.2、0.3、0.4、0.5μL 6个处理;引物浓度(10μmol/L)设4个处理,引物FMV1∶FMVCH∶FMVCH2∶FMV2∶CSV1∶CSV2的加入量分别为(1)0.2μL∶0.2μL∶0.4μL∶0.8μL∶0.4μL∶0.4μL;(2)0.2μL∶0.4μL∶0.4μL∶1.0μL∶0.4μL∶0.4μL;(3)0.2μL∶0.4μL∶0.6μL∶1.2μL∶0.6μL∶0.6μL;(4)0.2μL∶0.3μL∶0.5μL∶1.3μL∶0.5μL∶0.5μL。
1.7 多重RT-PCR的特异性试验
1.7.1 几种甘薯病毒RNA体外转录产物的制备
按照T7RNA Polymerase说明书进行RNA体外转录。在上游引物的5′端引入T7启动子序列,分别以SPFMV-CH、SPFMV-CH2、SPLV、SPVMV的CP基因和SPCSV Hsp70基因的重组质粒为模板,进行PCR扩增,扩增的双链DNA片段在T7 RNA聚合酶的作用下经体外转录形成单链RNA(cRNA),纯化后用核酸测定仪测定cRNA浓度,根据阿伏伽德罗常数将浓度换算为拷贝数。
1.7.2 多重RT-PCR的特异性试验
利用甘薯上常见的两种Potyvirus病毒SPLV和SPVMV测试特异性。分别以浓度为106拷贝/μL的 SPCSV、SPFMV-CH、SPFMV-CH2、SPLV、SPVMV的体外转录RNA为核酸模板,进行多重RT-PCR扩增,检测多重RT-PCR的特异性。
1.8 多重RT-PCR的灵敏性试验
分别将SPCSV、SPFMV-CH、SPFMV-CH2的体外转录RNA,进行10倍梯度稀释,分别取浓度为108~101拷贝/μL的8个浓度梯度的RNA作为核酸模板,进行多重RT-PCR扩增,以检测其灵敏性。
1.9 多重RT-PCR产物的克隆和序列测定
将纯化后的多重RT-PCR产物分别与pMD19-T载体连接,连接产物转化大肠杆菌TG1,经蓝白斑筛选和PCR鉴定后获得阳性克隆。核苷酸序列测定由TaKaRa公司完成。利用DNAMAN和BLAST对所测序列进行比较分析[9]。
1.10 多重RT-PCR的初步应用
从田间分别采集了10份感染SPVD的甘薯叶片样品和7份薯块样品,按照1.4中的方法提取总RNA,利用建立的多重RT-PCR方法对样品进行检测。
2 结果与分析
2.1 多重RT-PCR反应条件的筛选
试验结果表明,退火温度在50~55.3℃之间的扩增效果都比较好;dNTPs加入量在1μL以上时均能很好地扩增出全部目的条带;当Mg2+加入量达到0.5μL时就能够扩增出全部目的条带,并且随浓度的增加条带越来越亮,但当 Mg2+加入量为2.5μL时,各目的条带的亮度反而变弱;Taq DNA聚合酶加入量为0.2μL时,能清晰地扩增出全部目的条带,随着酶量的增加,没有很大的变化;4种引物浓度组合的扩增效果都比较好,不同组合对扩增效果影响不大(图略)。
根据不同条件对试验结果的影响,综合考虑扩增效果和试验成本,最终优化的多重RT-PCR反应体系为:多重RT反应体系为10μL:2μL 5×RT buffer,1μL MgCl2(25mmol/L),1μL dNTP 混合物(各10mmol/L),0.5μL CSV2引物,0.5μL FMV2引物,0.25μL RNase抑制剂(40U/μL),0.5μL 反 转录酶 (AMV Reverse Transcriptase)(5U/μL),4.25μL样品 RNA。反应程序为:42℃反转录40min,99℃5min,5℃5min。多重PCR反应体系为25μL:2.5μL 10×PCR buffer(Mg2+-),0.3μL Taq 酶(5U/μL),1.5μL dNTP Mixture(各2.5mmol/L),1.5μL MgCl2(25mmol/L),0.5μL引物CSV1,0.5μL引物CSV2,0.2μL引物FMV1,1.3μL引物FMV2,0.3μL引物FMVCH,0.5μL引物FMVCH2,2μL反转录产物,ddH2O补足25μL。反应程序为:94℃ 预变性3min;94℃变性30s,53℃退火30s,72℃延伸40s,35个循环;最后72℃ 延伸10min。
2.2 多重 RT-PCR与单一 RT-PCR扩增效果的比较
以同时感染SPCSV以及SPFMV 2个株系类型的SPVD甘薯植株叶片总RNA为模板,利用建立的多重RT-PCR反应体系对样品进行扩增,结果表明,多重RT-PCR扩增结果与单一RT-PCR的扩增结果一致(图1)。

图1 多重和单一RT-PCR检测结果比较Fig.1 Comparison of the test results between multiplex RT-PCR and single RT-PCR
2.3 多重RT-PCR的特异性分析
体外转录的RNA经纯化后测定RNA的浓度,各目的cRNA的浓度与拷贝数见表2。利用建立的多重RT-PCR方法对浓度为106拷贝/μL的SPFMVCH2、SPFMV-CH、SPCSV、SPLV和SPVMV几种病毒的cRNA进行扩增。结果显示,从SPFMV-CH、SPFMV-CH2和SPCSV的cRNA以及两两混合的cRNA和3种混合的cRNA中均能扩增出相应的目的条带,而从SPLV和SPVMV中均未扩增出条带。说明建立的多重RT-PCR特异性较好(图2)。

表2 各目的基因体外转录合成RNA的浓度与拷贝数Table 2 Concentrations and copies of RNA synthesized from the objective gene in vitro

图2 多重RT-PCR的特异性检测Fig.2 Specific detection by multiplex RT-PCR
2.4 多重RT-PCR的灵敏性分析
灵敏性试验结果表明,建立的多重RT-PCR方法对SPFMV-CH2、SPFMV-CH 和SPCSV 的最低检测浓度分别为1.42×104拷贝/μL、1.32×104拷贝/μL和2.47×104拷贝/μL(图3)。说明该方法可实现对2种甘薯病毒RNA104拷贝水平的检测。
2.5 多重RT-PCR扩增产物的鉴定
为了进一步验证多重RT-PCR扩增出的片段为目的病毒的核酸序列,对部分多重RT-PCR的扩增产物进行了克隆和序列测定。结果表明,所扩增出的4个片段的核苷酸序列与GenBank中SPFMV和SPCSV核苷酸序列的一致性最高分别达92%、96%、98%和97%左右,说明扩增出的片段均为目的病毒的特异性片段。
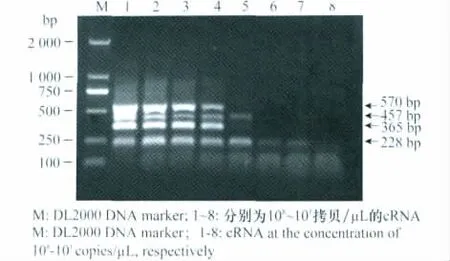
图3 多重RT-PCR的灵敏性Fig.3 Sensitivity of multiplex RT-PCR assay
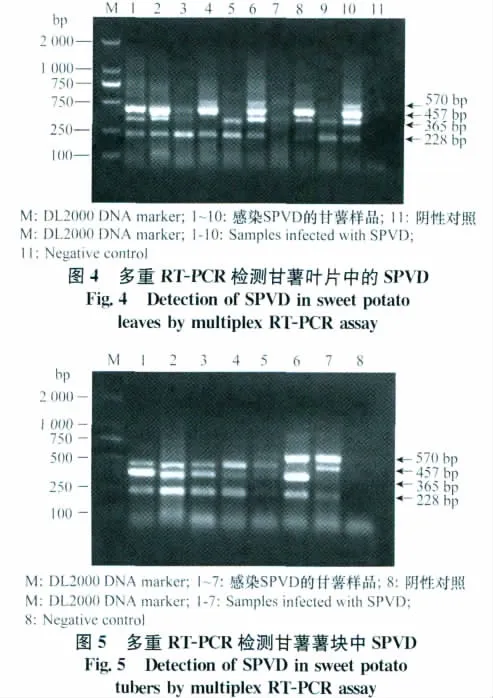
2.6 多重RT-PCR检测方法的初步应用
分别对10份感染SPVD的甘薯叶片样品和7份薯块样品进行了检测,结果表明,本研究所建立的多重RT-PCR方法能从叶片和薯块中检测出SPVD的两种病原,并且能够区分SPFMV的两个主要株系类型。例如,对甘薯叶片的检测中,样品1含有SPFMV-CH株系和SPCSV 2种病毒,样品6含有SPFMV-CH、SPFMV-CH2和SPCSV 3种病毒;对甘薯薯块的检测中,样品2含有SPFMV-CH株系和SPCSV 2种病毒,样品6含有SPFMV-CH2株系和SPCSV 2种病毒(图4、图5)。
3 结论与讨论
本文设计了针对SPFMV和SPCSV所有株系的通用引物,同时还设计了能区分SPFMV 2个主要株系类型(CH和CH2)的特异性引物。通过优化反应条件,初步建立了在一次PCR反应中即可检测SPVD是否存在的方法,该方法可用于甘薯植株和薯块中病毒的检测。SPVD是甘薯上的毁灭性病害,建立SPVD快速高效的检测技术,对于该病的预警和控制具有重要意义。
影响多重RT-PCR扩增效果的因素很多。例如,扩增的目的片段应尽量选择小片段,各片段大小的差距要适中,以减小扩增效率不均衡对扩增效果的影响[11]。本研究设计的扩增片段均小于600bp,有效减小了扩增效率不均衡的影响。在引物设计方面,不同引物之间互补的碱基不能太多,避免引物之间形成二聚体等。Tm值相近的引物更有利于多重RT-PCR扩增[12]。另外,在一个PCR反应体系中同时加入多个引物,引物之间的竞争也会影响扩增效果。由于当SPCSV和SPFMV共同侵染甘薯时,SPCSV的含量变化不明显,而SPFMV的含量会比其单独侵染时增加600倍[13],因此本研究适当提高了SPCSV引物的浓度,达到了比较好的扩增效果。
[1] Gibson R W,Mpembe I,Alicai T,et al.Symptoms,aetiology and serological analysis of sweet potato virus disease in Uganda[J].Plant Pathology,1998,47:95-102.
[2] Gutiérrez D L,Fuentes S,Salazar L F.Sweet potato virus disease(SPVD):distribution,incidence,and effect on sweet potato yield in Peru[J].Plant Disease,2003,87:297-302.
[3] Njeru R W,Mburu M W K,Cheramgoi E,et al.Studies on the physiological effects of viruses on sweet potato yield in Kenya[J].Annals of Applied Biology,2004,145:71-76.
[4] 张振臣,乔奇,秦艳红,等.我国发现由甘薯褪绿矮化病毒和甘薯羽状斑驳病毒协生共侵染引起的甘薯病毒病害[J].植物病理学报,2012,42(3):328-333.
[5] Yamasaki S J,Sakai S,Fuji S,et al.Comparisons among isolates of Sweet potato feathery mottle virus using complete genomic RNA sequences[J].Archives of Virology,2010,155:795-800.
[6] Kokkinos C D,Clark C A.Interactions among Sweet potato chlorotic stunt virus and different potyviruses and potyvirus strains infecting sweet potato in the United States[J].Plant Disease,2006,90:1347-1352.
[7] Mukasa S B,Rubaihayo P R,Valkonen J P T.Interactions between a crinivirus,an ipomovirus and a potyvirus in coinfected sweet potato plants[J].Plant Pathology,2006,55:458-467.
[8] 黄玉娜,张振臣.甘薯潜隐病毒外壳蛋白基因的克隆、表达及其抗血清的制备[J].植物病理学报,2007,37(3):255-259.
[9] 张业辉,秦艳红,乔奇,等.甘薯脉花叶病毒外壳蛋白基因在大肠杆菌中的表达及其抗血清的制备[J].植物病理学报,2011,41(1):57-63.
[10]杨元军,王玉萍,翟红,等.甘薯块根总RNA的高效快速提取方法[J].分子植物育种,2008,6(1):196-197.
[11]张显勇,蔡文伟,杨本鹏,等.甘蔗花叶病和宿根矮化病多重PCR检测方法的建立[J].中国农业科学,2008,41(12):4321-4327.
[12]范旭东,董雅凤,张尊平.3种苹果潜隐病毒多重RT-PCR检测体系的建立[J].园艺学报,2009,36(12):1821-1826.
[13]Karyeija R F,Kreuze J F,Gibson R W,et al.Synergistic interactions of a potyvirus and a phloem-limited crinivirus in sweet potato plants[J].Virology,2000,269:26-36.
