葡多酚对老龄大鼠抗氧化力及细胞增殖活性的影响
2013-09-10邱霞姜永梅
邱霞 姜永梅
葡多酚(grape procyanidins,GPC)是从新鲜葡萄籽中提取的一种天然植物多酚物质[1]。国内外研究证实,GPC具有清除自由基、抗氧化和提高细胞增殖活性等多种生物学功效[2-3]。本实验采用GPC加入饲料喂养大鼠的方法,观察GPC对老龄大鼠抗氧化能力及肝细胞增殖活性的影响。
1 对象与方法
1.1 实验动物与分组 自山东省鲁抗医药实验中心购清洁级健康雄性15月龄Wistar大鼠40只,体质量310~485 g,随机分为空白对照组和GPC低、中、高剂量组,每组10只。于本实验室适应性喂养1周后用于实验。
1.2 饲料配制 葡多酚为本实验室制备,含量>99%,标准品由日本岛田株式会社提供。大鼠饲料购自中科院实验动物研究所。GPC低、中、高剂量组的饲料为每公斤普通饲料中分别加入10、100、200 mg的GPC。以上3组充分混匀后制成饼状。
1.3 试剂与仪器 大鼠超氧化物歧化酶(SOD)、谷胱甘肽过氧物酶(GSH-Px)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所。RPMI-1640培养基、胎牛血清、四甲基偶氮噻唑蓝(MTT)、二甲亚砜(DMSO)购自美国GLBCD BRL公司。自动酶标仪为瑞典产RosysAnthos 2010型。
1.4 实验方法 空白对照组喂饲普通饲料,GPC低、中、高剂量组分别喂饲加入前述不同剂量GPC的普通饲料。各组动物均自由进食,喂养50 d后次日清晨处死大鼠,腹主动脉取血,分离血清备检GSH-Px、SOD和MDA。无菌条件下取出肝脏剪碎,制成单细胞悬液用以检测细胞增殖活性。
1.5 检测指标
1.5.1 抗氧化指标:取血清2 ml按说明书方法采用还原法测定GSH-Px活力,黄嘌呤氧化酶法测定SOD活力,硫代巴比妥酸法测定MDA含量。
1.5.2 细胞增殖活性(MTT法):取制备好的肝细胞悬液,调节细胞密度为1×106/ml,接种于96孔培养板,每孔加0.1 ml细胞悬液,每个样本设3个平行孔,置37℃,5%CO2培养箱内培养48 h,加入5 mg/ml MTT 液,10 μl/孔,继续培养 4 h。每孔加入0.1 ml二甲亚枫(DMSO),吹打溶解,在酶标仪上记录492 nm波长溶液的吸光值(A值)。计算不同剂量的GPC对肝细胞增殖的促进率:促进率(%)=(GPC组 -空白对照组)/空白对照组×100%
1.6 统计方法 所有数据均使用SPSS 16.0统计软件进行统计分析,结果采用±s表示,组间差异采用单因素方差分析,两两比较采用SNK检验。
2 结果
2.1 GSH-Px、SOD和MDA检测结果 GPC中、高剂量组的SOD、GSH-Px和MDA与空白对照组相比差异均有统计学意义(P<0.05),见表1。
表1 各组大鼠GSH-Px、SOD和MDA检测结果±s,n=10)
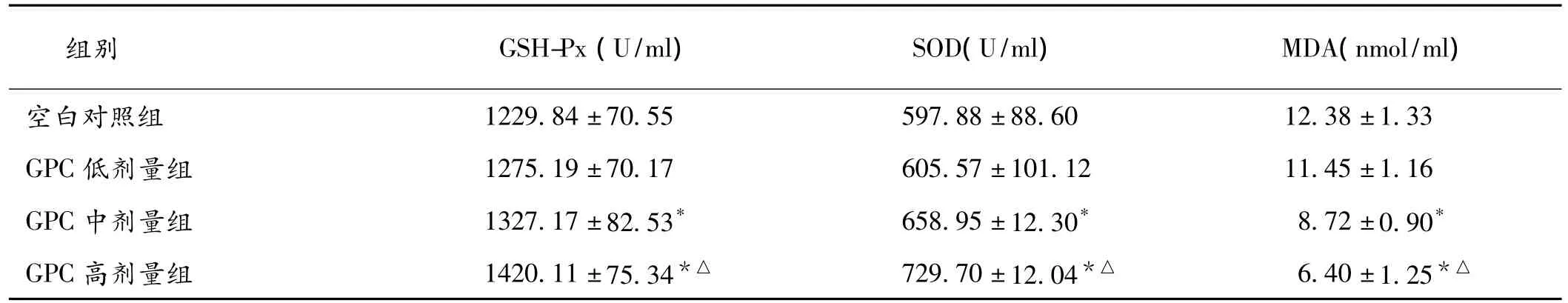
表1 各组大鼠GSH-Px、SOD和MDA检测结果±s,n=10)
注:与空白对照组比较,*P<0.05;与GPC低剂量组比较,△P<0.05
组别 GSH-Px(U/ml) SOD(U/ml) MDA(nmol/ml)空白对照组*△1229.84±70.55 597.88±88.60 12.38±1.33 GPC低剂量组 1275.19±70.17 605.57±101.12 11.45±1.16 GPC中剂量组 1327.17±82.53* 658.95±12.30* 8.72±0.90*GPC高剂量组 1420.11±75.34*△ 729.70±12.04*△ 6.40±1.25
2.2 肝细胞增殖活性检测结果 GPC中、高剂量组的A值分别为1.18±0.13、1.29±0.10,均较空白对照组的增殖活性明显升高(P<0.05);GPC高剂量组细胞增殖促进率高于GPC低剂量组(P<0.05)。见表2。
表2 各组大鼠肝细胞增殖活性检测结果±s,n=10)

表2 各组大鼠肝细胞增殖活性检测结果±s,n=10)
注:与空白对照组比较,*P<0.05;与GPC低剂量组比较,△P<0.05
组别 A值 促进率(%)0.98±0.12 -GPC低剂量组 1.08±0.11 31.91±9.27 GPC中剂量组 1.18±0.13* 46.65±10.34 GPC高剂量组 1.29±0.10*△ 58.49±12.02空白对照组△
3 讨论
氧化应激是反映机体抵抗氧化损伤的一个重要指标,人体内的抗氧化系统对于消除机体高水平的氧化物,维护细胞及神经元的正常生理功能有着重要的作用。随着年龄增长,机体清除氧自由基的酶活性降低,产生氧化应激损伤、神经元DNA损伤和记忆神经质受体的兴奋性神经毒性作用,最终引起老年痴呆症的发生和发展[4]。流行病学资料显示膳食中补充某些植物化学物可增强机体抗氧化水平,降低衰老过程中对氧化应激的易感性,改善运动及认知行为功能,是预防老年痴呆症的一个重要手段[5]。
GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,能催化还原型谷胱甘肽变为氧化型谷胱甘肽,使有毒的过氧化物还原成无毒的羟基化合物,并防止过氧化物水解产生MDA。SOD可催化超氧阴离子(O2-)歧化为H2O2和O2,再经过氧化氢酶催化生成水,从而消除自由基的损害。MDA是脂质过氧化链式反应终止阶段产生的小分子产物,其含量反映了脂质过氧化反应程度的强弱[6]。本实验结果显示,GPC高剂量组的SOD、GSH-Px活力较空白对照组显著性升高,而MDA含量显著性降低,表明GPC可增强老龄大鼠的抗氧化能力,其机制与GPC具有较强的自由基清除活性有关[7]。
细胞增殖活性水平是反映细胞生命力强弱的一个重要指标,当细胞受到生理病理因素损伤时,首先表现出增殖活性的降低[8]。MTT法通过检测吸光度值的变化反映细胞生长及增殖活性。本次动物实验结果显示,GPC中、高剂量组均较空白对照组的增殖活性明显升高,且GPC高剂量组细胞增殖促进率明显高于低剂量GPC组。表明GPC对老龄大鼠肝细胞的增殖活性有促进作用,这与文献报道的结果相一致[3]。
综上研究结果认为,GPC具有增强老龄大鼠清除自由基能力,促进细胞增殖活性,提高机体抗氧化力等功效,在抗衰老和老年痴呆症的预防和治疗方面有较好应用前景。
[1]Puiggros F,Llopiz N,Ardevol A,et al.Grape seed procyanidins prevent oxidative injury by modulating the expression of antioxidant enzyme systems[J].J Agric Food Chem,2005,53(15):6080-6086.
[2]Zhu QY,Schramm DD,Gross HB,et al.Influence of cocoa flavanols and procyanidins on free radical-induced human erythrocyte hemolysis[J].Clin Dev Immunol,2005,12(1):27-34.
[3]钟进义,李杰,刘辉,等.葡多酚对肝细胞内Ca2+浓度和增殖活性的影响[J].卫生研究,2006,35(5):567-572.
[4]王豪,瞿正万,朱莉娜,等.阿尔茨海默病血浆总抗氧化状态与同型半胱氨酸水平的临床研究[J].实用老年医学,2011,25(1):50-55.
[5]杨亚丹,蒋与刚.老年痴呆症营养干预的研究进展[J].实用老年医学,2010,24(3):248-250.
[6]Bagchi D,Ray SD,Bagchi M,et al.Mechanistic pathways of antioxidant cytoprotection by a novel IH636 grape seed proanthocyanidin extract[J].Indian J Exp Biol,2002,40(6):717-726.
[7]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol,2007,39(1):44-84.
[8]Bader N,Bosy-Westphal A,Koch A,et al.Influence of vitamin C and E supplementation on oxidative stress induced by hyperbaric oxygen in healthy men[J].Ann Nutr Metab,2006,50(3):173-176.
