取向蚕丝蛋白支架与间充质干细胞的复合培养
2013-09-04袁翰梁金郑欣郭向可李东亚邱旭升陈一心
袁翰,梁金,郑欣,郭向可,李东亚,邱旭升,陈一心*
(1.南京中医药大学中西医结合鼓楼临床医学院,江苏南京 210008;2.南京大学医学院附属鼓楼医院创伤骨科,江苏南京 210008;3.南京大学化学化工学院,江苏 南京 210093)
大段骨缺损常见于高能损伤导致的骨折、骨肿瘤的广泛切除,骨髓炎的清创手术。随着车祸的增加,大段骨缺损的修复在临床上越来越常见,至今仍是一大难题。临床上,对于大段骨缺损的治疗,单纯植骨往往不能解决问题,植入的骨组织常常被吸收,自体骨移植供骨量有限且存在取骨区感染风险,而同种异体骨移植存在传染疾病的可能[1],这些缺点使得骨移植的应用受到限制。因此,研制新型的骨修复材料,通过引导骨组织再生来修复大段骨缺损是目前的研究热点[2,3]。现阶段,运用于临床的骨组织修复材料存在力学性能不佳、骨诱导能力不足、生物相容性差等诸多缺陷[4,5]。
取向纳米纤维材料能够诱导细胞呈取向排布,并且增加细胞在其表面迁移的速率,甚至诱导间充质干细胞的分化[6]。蚕丝蛋白生物相容性较好,可作为制备纳米纤维的原料。本研究通过制备合适尺度的取向纳米蚕丝纤维,研究其对骨髓间充质干细胞(bone marrow stem cells,BMSCs)的排列、迁移、增殖及成骨分化的影响,为其将来作为大段骨缺损的修复材料应用于临床提供实验支持。
1 资料与方法
1.1 静电纺丝法制备不同取向度蚕丝蛋白纳米纤维支架以热碱法脱去蚕丝丝胶,得到纯蚕丝蛋白纤维。蚕丝蛋白纤维溶解于CaCl2/乙醇/H2O混合溶液(摩尔比1∶2∶8),混合溶液透析后蒸发干燥以取得蚕丝蛋白。空白对照组采用旋涂法施加蚕丝蛋白水溶液后常温真空干燥。蚕丝蛋白取向纳米纤维材料采用2 000 r/min转速下的滚轴(直径6 cm)接收装置取得,无序纳米纤维膜于500 r/min取得。将所得蚕丝蛋白纳米纤维材料包覆于直径14 mm的细胞爬片表面并以75%乙醇溶液处理。
1.2 取向蚕丝蛋白纳米纤维对BMSCs增殖力的影响 人骨髓来自健康献髓者,献髓者事先已签署知情同意书。将采集到的抗凝骨髓用密度梯度离心法分离骨髓中的单个核细胞。运用差速贴壁法纯化细胞,4~5 d传代一次。收集4~6代BMSCs调整浓度2×105/mL,分布接种于铺有实验组和对照组材料的24孔板中,每组复设4孔。分别于24 h、48 h、72 h、96 h、120 h 弃培养液,每孔加入噻唑蓝(MTT)5 mg/mL,孵育4 d后弃上清加入二甲基亚砜200μL,振荡溶解15 min,于酶标仪上测定570 nm处的光密度值,并设参考波长650 nm。细胞数量以吸光度单位来表示。
1.3 复合培养材料的形态学观察 三组细胞以2×105/mL接种后,分布接种于铺有实验组和对照组材料的24孔板中,培养3 d后,将试样切割为4 mm×4 mm后制样,在扫描电子显微镜下观察细胞在纳米纤维支架材料上的生长密度和形态分布。另取三组细胞共培养后材料以4%多聚甲醛(pH 7.4)固定15 min。以Triton X-100通透5 min后。以1μg 4’,6-二脒基 -2- 苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)、5 μg/mL 鬼笔环肽常温染色,抗荧光淬灭封片液封固。各组试样于荧光显微镜下以496 nm和380 nm荧光激发成像,并使用Axio Vision软件对各通道数据叠加处理。
1.4 不同取向度纳米纤维膜力学性能测定 首先游标卡尺测量取向与非取向纳米纤维膜的厚度,然后将其切成宽30 mm×长30 mm的试样,在材料拉伸试验机上测定强力与伸长。其中取向纳米纤维材料测量两次,分别沿取向方向(Y轴)和垂直取向方向(Z轴);无序纳米纤维材料以方向随机且通过试样中心的轴线测量。从而得到强力-伸长曲线及有关力学指标,每种试样测定5次,取其平均值。夹持部分的长度为5 mm每边、拉伸速度5 mm/min,记录被测支架断裂前的受力动态变化,参数主要包括最大力(N)、最大力点的位移(mm)、拉抻强度(MPa)、最大力伸长率(%)、断裂伸长率(%)等,并通过软件计算拉伸强度和杨氏模量。
1.5 数据处理与统计分析 图形化实验数据通过NIH Image J软件处理。实验中其他数据和统计量化图由SPSS计算并绘制。计量资料以(s)表示,三组各项指标的比较采用多组数据方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 取向纳米蚕丝纤维的制备 制备提取得到纯蚕丝蛋白溶液,使蚕丝蛋白纺丝液以约0.5 mL/h稳定连续的流出。调节接收距离及工作电压,纺丝时间180 min。得到半透明膜状取向纳米蚕丝蛋白膜,电镜下观察取向纳米纤维取向度好,非取向蚕丝蛋白纳米纤维支架则呈无序分布。
2.2 取向纳米蚕丝蛋白膜力学性能测定 通过材料拉伸试验机测定取向、非取向纳米蚕丝蛋白力学性能指标,统计结果见表1。取向蚕丝纤维轴向方向的最大力大于径向方向,最大力伸长率小于径向方向及非取向材料。杨氏模量大于径向方向及非取向材料。
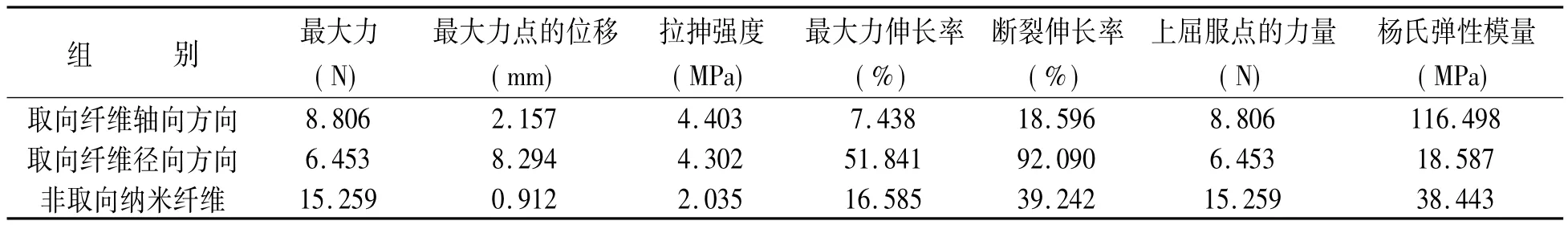
表1 纳米蚕丝蛋白膜力学指标
2.3 BMSCs的体外分离、扩增 用比重1.073 g/mL的淋巴细胞分离液分离骨髓间充质干细胞,培养1 d后,未见明显梭形贴壁细胞,大部分细胞为圆形未贴壁细胞。培养4 d后全量换液,除去未贴壁细胞,在显微镜下观察,能看到散在存在的梭形贴壁细胞。1周后,数量稍微增多。至培养2周,已经能看到明显聚集的梭形BMSCs。
2.4 取向纳米蚕丝蛋白膜对BMSCs形态的影响 在取向纳米蚕丝蛋白膜表面,细胞形态变长,呈梭形,细胞沿蚕丝方向有序排列,而乱序及平滑蚕丝蛋白膜材料表面,细胞在各个方向生长,随机排列(见图1)。扫描电镜观察,细胞黏附于纳米蚕丝蛋白表面,沿蚕丝蛋白取向方向生长,其形态受到取向排列的蚕丝蛋白的影响,在2根蚕丝蛋白之间呈梭形。而在平滑蚕丝蛋白材料表面,细胞长轴在各个方向随机排列。局部观察到黏附于蚕丝表面的细胞伪足(见图2)。FITC标记的鬼笔环肽与细胞内肌动蛋白结合后,显示在各组实验中细胞内肌动蛋白均沿细胞长轴方向。在平滑蚕丝蛋白材料及乱序纳米蚕丝蛋白材料表面生长的BMSCs细胞均表现为梭形或多角形,细胞纵轴在各个方向随机排列,而在取向纳米蚕丝蛋白表面生长的BMSCs形态表现为充分伸长的梭形。细胞内部可见沿细胞长轴方向排列的肌动蛋白(见图3)。
2.5 取向纳米蚕丝蛋白对BMSCs增殖力的影响 MTT法测量细胞的增殖速率的结果示在1 d、2 d、3 d、4 d、5 d各检测时间点,三组材料表面BMSCs细胞均快速增殖。在培养3 d后,取向及乱序纳米蚕丝蛋白组细胞增殖力明显高于普通蚕丝蛋白组(P<0.05)。从第4天开始,取向纳米蚕丝蛋白组细胞增殖力明显高于乱序纳米蚕丝蛋白组(P<0.05,见表2)。
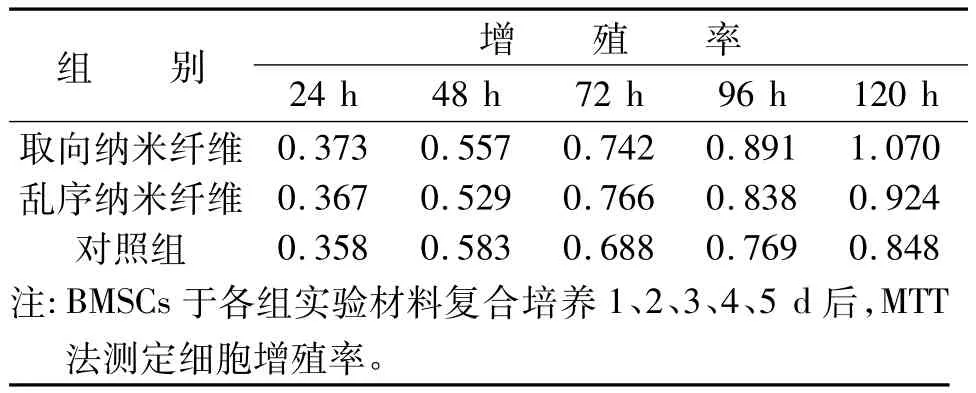
表2 MTT法测定BMSCs增殖力(吸光度OD)
3 讨 论
3.1 取向纳米蚕丝蛋白的制备 静电纺丝技术是用于制备纳米纤维的常用技术,通过改变合成条件,可以制造出不同直径、密度以及排列的纳米纤维。通过近十几年的发展,众多学者已将此项技术应用到对人造血管、创面覆盖及引导组织修复方面的研究[7]。本实验通过改进接收装置滚轮转速及电场强度,分别得到乱序及取向的蚕丝蛋白,直径在500~1 000 nm之间。滚轮转速为2 000 r/min时,电镜显示蚕丝蛋白取向度良好,随着滚轮转速的降低,蚕丝蛋白的取向度逐渐降低。当滚轮转速降低至500 r/min时,蚕丝蛋白呈无序排列。厚度适中的半透明膜用于体外细胞实验既有利于在光镜及显微镜下观察细胞形态,又具备一定的表面纳米结构,适合用于体外细胞实验的研究。通过控制纺丝时间,可以控制蚕丝蛋白的厚度,我们选取180 min的工作周期,最终得到厚度为50~100μm半透明的蚕丝蛋白膜。体外细胞共培养实验证明,此种厚度的蚕丝蛋白纳米纤维膜具有理想的实验效果。
3.2 取向纳米蚕丝蛋白的力学分析 用于骨科的植入材料需要具有一定的刚性及韧性。蚕丝蛋白虽然具有生物相容性好、体内可降解、易塑形等优点,但是其刚性及韧性较差,不能满足骨科植入材料的需要[8]。有研究通过加入聚乳酸等制备成为复合材料,能够增加其韧性,用于神经、血管等组织的修复[9,10]。但是加入的复合材料往往具有一定的生物毒性作用,体内不能降解,有的需要二次手术取出,增加了医疗费用的开支。本实验通过增加蚕丝蛋白的取向度,并且控制其直径为纳米级别(500~1 000 nm),在不添加其余复合原料的情况下增加了蚕丝蛋白的轴向韧性,扩宽了蚕丝蛋白在医学领域的应用范围,使将来取向纳米蚕丝的临床应用成为可能。对于骨科领域,可增加取向纳米蚕丝蛋白膜的厚度及密度,利于骨折断端的辅助固定。
3.3 取向纳米蚕丝蛋白对BMSCs形态的影响 人体骨骼组织中的胶原蛋白呈高度取向的束状分布,是成骨细胞、间充质干细胞等生长所必需的细胞外基质。我们所制备的取向纳米蚕丝纤维材料具有高度取向性,并且具有适当的纤维间隙,能够提供细胞生长所需要的空间。它是一种模仿骨骼组织中细胞外基质成分的良好结构。电镜及细胞骨架蛋白染色显示骨髓间充质干细胞良好地附着于蚕丝蛋白表面,并且在取向蚕丝的诱导下变为梭形,长轴增加,向着蚕丝取向方向更好地迁移排列。肌动蛋白荧光染色更好地显示了细胞形态及细胞有序排列,并且可以观察到细胞内肌动蛋白呈相同方向束状分布,这也初步解释了细胞变长的可能机制。大量研究表明[6,11-19],生长于取向纳米纤维材料表面的细胞不仅表现为黏着蛋白、张力蛋白、肌动蛋白等数量的变化,还检测到细胞内某些信号通路甚至基因表达的改变。
Lu等[16]在高取向度的纳米纤维表面,观察到间充质干细胞可有序排列,并存在67个基因的表达差异,大部分与过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)信号通路有关。因此我们推测,间充质干细胞通过整合素家族信号通路将细胞外的物理刺激转变为能被细胞识别的生物信号并进一步影响细胞命运。我们从电镜下观察到BMSCs沿蚕丝取向方向伸出伪足黏附于蚕丝蛋白表面,这些现象都是细胞膜表面黏附蛋白与蚕丝蛋白相互作用的结果,与之前研究一致[6]。本实验中肌动蛋白荧光染色后可以看到呈束状排列并且有密度更高的肌动蛋白,显示了细胞骨架的改变。
3.4 取向纳米蚕丝蛋白促进BMSCs的增殖 目前对于成骨诱导材料的研究主要集中于两方面,材料对成骨细胞增殖的促进作用,以及材料对骨髓间充质干细胞增殖及成骨分化的促进作用。随着对材料表面物理形貌结构对细胞影响研究的深入,越来越多的学者开始研制具备一定纳米形态的材料,促进成骨细胞增殖或者骨髓间充质干细胞的成骨分化。取向纳米纤维材料是其中的一种,以往研究表明具备一定取向结构的纳米纤维能够促进间充质干细胞的增殖、分化[6,12,14,15]。我们首次选用生物相容性较好的蚕丝蛋白,通过静电纺丝的方法制备取向纳米蚕丝蛋白,研究其对BMSCs的影响,结果示具备一定取向的纳米蚕丝蛋白能够促进BMSCs的增殖活性,有利于骨折的愈合。
综上所述,通过静电纺丝法制备的蚕丝蛋白纳米纤维支架可促进BMSC在其表面的增殖。提高纳米纤维的取向程度后,还可进一步介导细胞的取向分布和成骨分化。材料具有独特的力学特性,是一种极具潜力的骨修复生物材料。然而,取向纳米纤维形貌如何影响BMSC的分化方向,以及取向蚕丝蛋白纳米纤维支架于体内应用的效果,还需进一步研究。
(本文图1~3见后插页)
[1]Giannoudis PV,Dinopoulos H,E.Tsiridis.Bone substitutes:an update[J].Injury,2005,36(Suppl 3):S20-27.
[2]Masquelet AC,Begue T.The concept of induced membrane for reconstruction of long bone defects[J].Orthop Clin North Am,2010,41(1):27-37.
[3]Taylor BC,French BG,Fowler TT,et al.Induced membrane technique for reconstruction to manage bone loss[J].J Am Acad Orthop Surg,2012,20(3):142-150.
[4]Busuttil Naudi K,Ayoub A,McMahon J,et al.Mandibular reconstruction in the rabbit using beta-tricalcium phosphate(beta-TCP)scaffolding and recombinant bone morphogenetic protein 7(rhBMP-7)-histological,radiographic and mechanical evaluations[J].J Craniomaxillofac Surg,2012,40(8):461-469.
[5]Rezwan K,Chen QZ,Blaker JJ,et al.Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bone tissue engineering[J].Biomaterials,2006,27(18):3413-3431.
[6]Teh TK,Toh SL,Goh JG.Aligned Fibrous Scaffolds for Enhanced Mechanoresponse and Tenogenesis of Mesenchymal Stem Cells[J].Tissue Eng Part A,2013,19(11-12):1360-1372.
[7]Bhardwaj N,Kundu SC.Electrospinning:A fascinating fiber fabrication technique[J].Biotechnology Advances,2010,28(3):325-347.
[8]Park SH,Gil ES,Kim HJ,et al.Relationships between degradability of silk scaffolds and osteogenesis[J].Biomaterials,2010,31(24):6162-6172.
[9]Diab T,Pritchard EM,Uhrig BA,et al.A silk hydrogel-based delivery system of bone morphogenetic protein for the treatment of large bone defects[J].J Mech Behav Biomed Mater,2012,11:123-131.
[10]Ak F,Oztoprak Z,Karakutuk I,et al.Macroporous silk fibroin cryogels[J].Biomacromolecules,2013,14(3):719-727.
[11]Yang F,Murugan R,Wang S,et al.Electrospinning of nano/micro scale poly(L-lactic acid)aligned fibers and their potential in neural tissue engineering[J].Biomaterials,2005,26(15):2603-2610.
[12]Baker BM,Nathan AS,Gee AO,et al.The influence of an aligned nanofibrous topography on human mesenchymal stem cell fibrochondrogenesis[J].Biomaterials,2010,31(24):6190-6200.
[13]Sengupta S,Park SH,Seok GE,et al.Quantifying Osteogenic Cell Degradation of Silk Biomaterials[J].Biomacromolecules,2010,11(12):3592-3599.
[14]Peng F,Yu X,Wei X.In vitro cell performance on hydroxyapatite particles/poly(L-lactic acid)nanofibrous scaffolds with an excellent particle along nanofiber orientation[J].Acta Biomater,2011,7(6):2585-2592.
[15]Capkin M,Cakmak S,Kurt FO,et al.Random/aligned electrospun PCL/PCL-collagen nanofibrous membranes:comparison of neural differentiation of rat AdMSCs and BMSCs[J].Biomed Mater,2012,7(4):045013.
[16]Lu LX,Wang XY,Mao X,et al.The effects of PHBV electrospun fibers with different diameters and orientations on growth behavior of bone-marrow-derived mesenchymal stem cells[J].Biomed Mater,2012,7(1):015002.
[17]Parrag IC,Zandstra PW,K.A.Woodhouse.Fiber alignment and coculture with fibroblasts improves the differentiated phenotype of murine embryonic stem cell-derived cardiomyocytes for cardiac tissue engineering[J].Biotechnol Bioeng,2012,109(3):813-822.
[18]Schneider T,Kohl B,Sauter T,et al.Influence of fiber orientation in electrospun polymer scaffolds on viability,adhesion and differentiation of articular chondrocytes[J].Clin Hemorheol Microcirc,2012,52(2-4):325-336.
[19]Wang Y,Gao R,Wang PP,et al.The differential effects of aligned electrospun PHBHHx fibers on adipogenic and osteogenic potential of MSCs through the regulation of PPARgamma signaling[J].Biomaterials,2012,33(2):485-493.
