鸭梨过氧化物酶基因全长克隆与序列分析
2013-08-29闫师杰廉双秋李晓丹朱文嫱
闫师杰 ,廉双秋 ,李晓丹 ,李 玲 ,朱文嫱,赵 越*
(1.天津农学院食品科学系,天津 300384;2.东北农业大学生命科学学院,哈尔滨 150030;3.东北农业大学食品学院,哈尔滨 150030)
鸭梨(Pyrus bretschneideri Rehd cv.Yali)是我国白梨品系的优良主栽品种,果实较耐贮藏,采用冷藏方法可以贮藏到第二年2~3月,鸭梨贮藏的主要问题是近果心部位组织褐变。闫师杰[1]研究认为,鸭梨果心较果肉过氧化氢酶(CAT)、过氧化物酶(POD)活性较低,维生素C及GSH含量下降较快,导致果心较果肉更容易积累自由基,发生脂质过氧化反应,最终导致膜透性升高,果心较早褐变。植物过氧化物酶(EC 1.11.1.7)的诱导蛋白质在植物防御期间发挥关键作用[2-3]。整个植物生命周期POD参与广泛的生理过程,可能是由于存在大量的同工酶和多功能酶催化反应[4]。一方面植物POD参与生长素代谢,木质素和木栓质形成,交联细胞壁成分,植保素的合成,它是一族能催化H2O2、氧化还原无机氢供体的酶[5-6];另一方面与植物逆境胁迫诱导表达有关,例如:POD在病原菌的防御、冷冻、重金属离子、机械损伤等因子作用下诱导表达[7-10],是植物抗氧化保护酶系的重要保护酶,是植物应对环境胁迫的生物标记之一[11]。目前已从数百种物种中克隆到POD基因,在GenBank登录的POD基因序列有1 000多个,而关于梨属的仅有2个片段,且是不完整的POD基因序列,鸭梨完整的POD基因序列及相关信息还未见报道。本研究根据已发表的梨属POD基因片段,利用RACE技术从鸭梨果实中克隆得到1个完整的POD基因cDNA。通过序列分析进一步揭示该酶的基因序列信息及表达特性,为最终调控植物体内过氧化物酶活性,抑制果实酶促褐变奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料、载体和菌株
以采自河北省藁城的套袋鸭梨为试材,于2011年9月16日采摘,运回实验室,经梯度降温后放入冷库贮藏。在贮藏期间将鸭梨果实切成块状于液氮中速冻后-80℃保存备用。克隆载体pMD18-T Vector购于大连宝生物公司,大肠杆菌菌株E.coli DH5α感受态细胞购自北京天根生物技术有限公司。
1.1.2 主要试剂
M-MLV反转录试剂、DNA聚合酶、DNA纯化回收试剂盒(购自索莱宝公司);限制性内切酶、T4DNA连接酶(购自大连宝生物公司);质粒小量提取试剂盒(购自上海生工);SMARTerTMRACE cDNA Amplification Kit(购自Clontech公司);其他常规药品均为进口或国产分析纯试剂。DNA序列测定由上海生工生物工程技术服务有限公司完成。
1.2 方法
1.2.1 引物设计
根据GenBank上FJ478154.1公布的梨属POD基因的mRNA及CDS信息,用软件primer5.0设计引物POD-F、POD-R,经PCR扩增得到该基因的保守片段并测序,根据测序结果设计引物PODF1、PODF2用于cDNA的3'RACE扩增;设计引物PODR1、PODR2用于cDNA的5'RACE扩增;最后根据保守区、3'RACE、5'RACEcDNA序列的拼接结果,设计引物PODF3、PODR3用于POD基因cDNA全长扩增。

表1 PCR反应中使用的引物Table1 Primers in PCR
1.2.2 鸭梨POD基因cDNA全长的获得
鸭梨果实总RNA提取采用CTAB法提取[12],反转录反应参照M-MLV反转录酶说明书,Oligo(dT)为引物合成cDNA第一链,以反转录cDNA为模板用引物对POD-F、POD-R进行扩增,扩增程序为:95℃预变性4 min,94℃变性35 s,60℃退火35 s,72℃延伸45 s,共30个循环;72℃延伸7 min。琼脂糖凝胶回收与预期目的片段大小一致的条带,电泳检测后连接克隆载体(pMD18-T Vector)并转化至大肠杆菌DH5α感受态细胞,通过蓝白斑筛选及质粒酶切鉴定阳性克隆后,送交测序。
根据克隆所得到的cDNA中间序列分别设计特异性引物PODF1、PODF2、PODR1和PODR2,按照RACE试剂盒SMARTerTMRACE cDNA Amplification Kit说明书操作,进行3'RACE和5'RACEcDNA末端快速扩增,将测序所得的中间序列及3'RACE和5'RACE序列进行拼接得到POD cDNA全长序列,再根据克隆所得全长序列设计引物PODF3和PODR3,以5'cDNA为模板,用于扩增POD cDNA全长,将该扩增产物回收并连入克隆载体后进行测序。
2 结果与分析
2.1 鸭梨POD基因的全长的cDNA的获得
根据鸭梨POD基因保守区设计引物POD-F、POD-R,以鸭梨果实cDNA为模板经PCR扩增及测序得到一个长度为445 bp的cDNA片段(见图1A)。依据所得中间序列设计特异性引物PODF1、PODF2、PODR1、PODR2,进行PCR扩增获得鸭梨POD基因的3'(见图1B)和5'(见图1C)cDNA末端序列,将测序后的中间片段及3'和5'末端序列拼接得全长1 487 bp的鸭梨POD基因序列。再根据该序列设计特异性扩增引物,经过PCR扩增后获得基因全长(见图1D)。将该基因提交GenBank,基因登录号为JQ325052。

图1 鸭梨PbPOD基因扩增电泳Fig.1 Electrophoresis pattern of PbPOD for Yalipear
2.2 鸭梨POD基因cDNA核苷酸序列分析
利用NCBI上提供的ORFFinder对该序列进行分析,发现鸭梨POD基因包含一个1 011 bp的编码区(CDS);3'非翻译区长404 bp,含有典型的植物基因加尾信号序列Poly(A);5'非翻译区长72 bp,起始密码子ATG后的第一个核苷酸为鸟苷酸(G),上述信息表明所克隆到的序列符合完整基因的结构特征,是一个完整的基因序列。
2.3 鸭梨过氧化物酶基因编码的蛋白质结构及功能位点分析
2.3.1 过氧化物酶基因编码的蛋白结构
ORFFinder分析表明,该基因的开放阅读框在73~1 083 bp区域,编码一个由336个氨基酸残基组成的多肽,推测分子质量大小为38.4 ku,等电点(pI,Isoelectric point)为8.54,原子总数为5 386,分子式为C1690H2691N487O499S19,不稳定系数为52.67,其为不稳定亲水性蛋白。
蛋白二级结构预测结果表明,PbPOD基因包含8个半胱氨酸形成4个二硫键,二级结构螺旋之间由环区和转角连接为主且占56.6%,α-螺旋占41.3%,β-折叠结构很少占2.1%。PbPOD与第Ⅲ类植物POD蛋白相比具有很强的结构类似性,可以初步判断鸭梨POD属于第Ⅲ类植物过氧化物酶超家族。通过同源建模法获得PbPOD的理论三维结构结果见图2(图2彩版见封二)。POD分子由两个不同的结构域组成,中间黄色部分为包埋着的血红素辅基,血红素平面上方远端的“空穴”是H2O2的作用位点,它还含有两个Ca2+结合区,一个Ca2+结合区位于近端结构域内,另一个位于远端结构域内,这在第III类POD中是高度保守的。
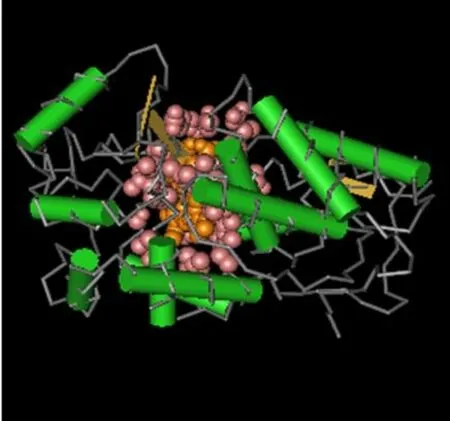
图2 PbPOD蛋白的三级立体结构预测Fig.2 Predicted tertiary structure of the PbPOD
2.3.2 POD蛋白的功能位点分析
通过NCBI(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)的保守域检索及立体结构预测工具Conserved Domain Database(CDD),发现POD蛋白具有两个保守功能域Cd00693(Secretory peroxidase,分泌性过氧化物酶)和Cl00196(Plant-peroxidaselike superfamily,植物过氧化物酶超家族)。进一步证明所获得基因就是鸭梨的过氧化物酶基因(见图3,图3彩版见封二)。
2.3.3 Pb-POD蛋白的分子进化关系分析
通过NCBI的BLAST数据库对PbPOD编码的蛋白序列进行比对,发现该蛋白序列与海榄雌(Avicennia marina)(BAB16317.1)POD有99%的相似性,与陆地棉(Gossypium hirsutum)POD(AAA99868.1)、木榄(Bruguiera gymnorhiza)POD(ADD54644.1)、油茶(Camellia oleifera)POD(ACT21094.1)、长春花(Catharanthus roseus)(AAY26520.1)、莲花(Nelumbo nucifera)(ABN46984.1)、鹰嘴豆(Cicer arietinum)(CAB71128.2)有96%的相似性,与拟南芥(Arabidopsis thaliana)(CAA17163.1)、文心兰(Oncidium Gower Ramsey)(ABC02343.1)有95%的相似性,烟草(Nicotiana tabacum)(AAD33072.1)有93%的相似性,甜瓜(Cucumismelo subsp.Melo)(ADN34050.1)有92%的相似性,与多个物种POD基因所编码的蛋白序列相似性达90%以上,确定克隆得到的基因是与鸭梨褐变相关的POD基因。
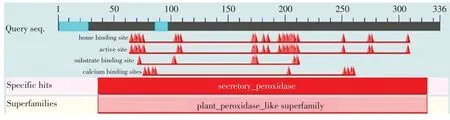
图3 PbPOD基因编码的氨基酸序列的预测Fig.3 Predicted amino acid sequenceof PbPOD
为进一步阐明PbPOD与其他植物中POD蛋白之间的进化关系,使用Clustal X软件分析各POD蛋白序列之间的相似性,对包括PbPOD在内的植物POD蛋白进行聚类分析,使用MEGA5软件构建出一个分子进化树(见图4)。
图4结果显示,PbPOD与拟南芥的POD蛋白在进化关系上距离相对最近,表明它们可能是从同一祖先进化而来。

图4 鸭梨PbPOD与其他植物中POD之间的分子进化关系Fig.4 Phylogenetic evolution analysisbetween PbPOD in Yalipear and other plants
3 讨论与结论
本研究利用RT-PCR和RACE方法,从鸭梨果实中成功克隆出一条完整的过氧化物酶基因,该基因包含全长为1 011 bp的编码区,编码336个氨基酸。二级结构螺旋之间以环区和转角连接为主,其次是α-螺旋,β-折叠结构很少。蛋白质的功能在很大程度上取决于其空间结构。无规则卷曲结构可以决定蛋白质的功能,酶的功能部位常处于这种构象区域;而α-螺旋的主要功能是对蛋白质骨架起到稳定作用。本研究通过序列分析和氨基酸序列比对得到的结果,为进一步研究该酶的结构和生化特性奠定基础。
已有研究表明,POD基因与木栓质和木质素的合成有关,而POD酶被认为是抵抗病原侵入的重要防卫手段[13-15]。同时,研究表明在植物受到重金属、低温等条件的胁迫下,POD蛋白的表达量也随之显著增加[16-17]。但是,基因POD在病原菌防卫反应和植物抗逆反应中的作用还不完全清楚。因此,鸭梨POD基因的克隆为揭示POD结构与功能的关系提供较好的研究材料和基础,最终阐明其作用机理,为鸭梨采后酶促褐变的机理研究奠定重要的分子生物学基础。
[1]闫师杰.鸭梨采后果实褐变的影响因素及发生机理的研究[D].北京:中国农业大学,2005.
[2]Almagro L,Gomez Ros L V,Belchi-Navarro S,et al.Class III peroxidases in plant defence reactions[J].Journal of Experimental Botany,2009,60(2):377-390.
[3]Kumari G J,Reddy A M,Naik ST,et al.Jasmonic acid induced changes in protein pattern,antioxidative enzyme activities and peroxidase isoenzymes in peanut seedlings[J].Biologia Plantarum,2006(50):219-226.
[4]Passardi F,Cosio C,Penel C,et al.Peroxidases have more functions than a Swiss army knife[J].Plant Cell Reports,2005(24):255-265.
[5]Passardi F,Zamocky M,Favet J,et al.Phylogenetic distribution of catalase-peroxidases:Arethese patches of order in chaos[J].Gene,2007(397):101-113.
[6]Bindschedler L V,Dewdney J,Blee K A,et al.Peroxidase dependent apoplastic oxidative burst in Arabidopsis required for pathogen resistance[J].The Plant Journal,2006(47):851-863.
[7]Den H J,Lievens S,Rombauts S,et al.Symbiotic plant peroxidase involved in bacterial invasion of the tropical legume sesbania rostrata[J].Plant Physiology,2007(144):717-727.
[8]Valrio L,DeMeyer M,Pene L C,et al.Expression analysis of the Arabidopsis peroxidasemultigenic family[J].Phytochemistry,2004,65(10):1331-1342.
[9]Bae E K,Lee H,Lee JS,et al.Molecular cloning of a peroxidase gene from poplar and its expression in response to stress[J].Tree Physiology,2006,26(11):1405-1412.
[10]Passardi F,Longet D,Penel C,et al.The class III peroxidase multigenic family in rice and its evolution in landplants[J].Phytochemistry,2004,65(13):1879-1893.
[11]Garcıá-Brugger A,Lamotte O,Vandelle E,et al.Early signaling events induced by elicitors of plant defences[J].Molecular Plant-Microbe Interactions,2006(7):711-724.
[12]李燕强,金志强,徐碧玉.香蕉果实RNA提取方法的改进和比较[J].福建热作科技,2005,50(2):37-43.
[13]Claudia C,Christophe D.Specific functions of individual class III peroxidase genes[J].Journal of Experimental Botany,2009,60(2):391-408.
[14]Choi H W,Kim Y J,Lee SC,et al.Hydrogen peroxide generation by the pepper extracellular peroxidase CaPO2activates local and systemic cell death and defense response to bacterial pathogens[J].Plant Physiology,2007(145):890-904.
[15]Passardi F,Penel C,Dunand C.Performing the paradoxical:How plant peroxidases modify the cell wall[J].Trends in Plant Science,2004(9):534-540.
[16]Iraida A,Miguel A B,Mercedes D C,et al.Improved germination under osmotic stress of tobacco plants overexpressing a cell wall peroxidase[J].FEBSLett,1999(457):80-84.
[17]Chiang H C,Lo JC,Yeh K C.Genes associated with heavy metal tolerance and accumulation in Zn/Cd hyperaccumula tor Arabidopsis halleri:A genomic survey with cDNA microarray[J].Environmental Science and Technology,2006(40):6792-6798.
