酒制瑞香狼毒对荷瘤小鼠抑瘤作用及机制的实验研究
2013-08-28马晓莉刘晋芝曹松云张新颖
马晓莉, 刘晋芝, 曹松云, 王 淼, 张新颖
(河北大学中医学院,河北保定 071000)
瑞香狼毒为瑞香科狼毒属植物Stellera chamaejasmeL.的干燥根,其味苦、辛,性平,有毒,入肝、肺、脾三经,有逐水、祛痰、破积、杀虫之功效[1]。瑞香狼毒用于治疗肿瘤在我国已有悠久的历史。诸多文献报道生药狼毒既有明显的体外抗肿瘤作用[2],又具有非常强的体内抗肿瘤作用[3],其含药血清也有明显的抗肿瘤作用[4]。但瑞香狼毒全草有毒,特别是对胸腺、脾脏等重要器官毒副作用较大。蒙医在防病、治病的实践中,摸索出狼毒的多种炮制方法,以达到减毒增效的目的,其中酒制狼毒有抗肿瘤作用,但炮制机理研究较少。本文通过H22荷瘤小鼠体内抑瘤实验,考察了酒制对瑞香狼毒抑瘤作用的影响,探讨其抑瘤机制,为瑞香狼毒的进一步开发、应用提供实验依据。
1 材料与方法
1.1 药品与试剂 狼毒购自安国市昌达中药材饮片有限公司,留300 g作为生药狼毒组的用药;酒制狼毒的制备:另外取300 g狼毒饮片,制备酒制狼毒,加60°白酒 (红星二锅头,北京红星公司产品)没过狼毒,浸泡6 h后,用文火煮至白酒完全被狼毒吸收,60℃烘干。
1.2 实验动物与瘤株 实验动物为雄性昆明种小鼠,体质量 (20±2)g,购自河北医科大学实验动物中心,实验动物合格证号1112090。瘤株为H22小鼠腹水型肝癌细胞株,由河北大学基础医学院微生物免疫实验室惠赠。
1.3 动物处理与分组 先从80只小鼠中随机取10只不接种肿瘤,作为空白对照组;余下的70只接种肿瘤。取接种6 d肿瘤生长良好的小鼠腹水,用生理盐水稀释成1×106/mL,以每只0.2 mL的量接种于小鼠右侧腋窝皮下,接种后24 h随机分为7组,第一组为肿瘤对照组,其余6组为治疗组,即生药狼毒低、中、高剂量组 (低、中、高剂量分别为5、10、20 g/kg体质量的生药狼毒药液),酒制狼毒低、中、高剂量组 (低、中、高剂量分别为5、10、20 g/kg体质量的酒制狼毒药液),空白对照组和肿瘤对照组给20 g/kg体质量的生理盐水。接种24 h后开始灌胃1 mL,每天1次连续8 d。于停药后次日处死小鼠,称体质量解剖皮下瘤块,取脾脏和胸腺,分别再称定质量,计算肿瘤抑制率和脾、胸腺指数。
1.4 指标测定
1.4.1 体质量增长 将肿瘤对照组、狼毒生药对照组和酒制狼毒低、中、高剂量各组小鼠在接种肿瘤后24 h称取实验动物体质量,并以苦味酸作标记,末次给药后24 h再次称取体质量并减去瘤质量,两次体质量差即为体质量增长指标。
1.4.2 抑瘤率 按1978年全国抗癌药物研究协会制定的《抗肿瘤药物体内筛选规程》判定肿瘤抑制率[5]。将狼毒生药组和酒制狼毒低、中、高剂量各组小鼠末次给药后24 h处死动物,剥离瘤体电子天平称定质量,计算抑瘤率。

1.4.3 脾指数的测定 将所有各组小鼠采用称重法将小鼠称定质量后脱颈处死,剥离脾脏,电子天平称定质量,计算脾指数 (mg/g)。

1.4.4 胸腺指数的测定 将所有各组小鼠采用称重法将小鼠称定质量后脱颈处死,剥离胸腺,电子天平称定质量,计算脾指数 (mg/g)。

1.4.5 Bax、Bcl-2免疫组织化学染色 将生药狼毒组和酒制低、中、高剂量组小鼠脱颈椎处死后很快取出肿瘤,置于4%多聚甲醛溶液中固定,常规脱水、透明、包埋成石蜡切片,每张均切4 μm薄的切片,准备做免疫组化。免疫组化步骤:石蜡切片,60℃烤箱烤片20 min后,二甲苯脱蜡、不同浓度酒精脱水,3%H2O2去离子水孵育30 min,以封闭内源性过氧化物酶;0.1 mol/L枸橼酸缓冲液(pH 6.0)微波修复;自然冷却至室温;分别用兔抗鼠Bax和Bcl-2抗体 (Santa cruz,1∶100)孵育切片 (4℃,过夜);滴加试剂1,37℃恒温水浴锅湿盒内孵育20 min;滴加试剂2,37℃恒温水浴锅湿盒内孵育20 min;DAB避光显色1至2 min。每步骤间用0.01 mol/L PBS充分洗涤,再经过石蜡切片的常规梯度酒精脱水、二甲苯透明、中性树胶封片,显微镜下观察、拍摄照片。对照试验:省去一抗或用PBS代替一抗孵育切片,结果为阴性。
1.5 统计分析
1.5.1 使用医学图像分析仪 (TN-8502),镜下观察狼毒生药组和酒制狼毒低、中、高剂量各组染色结果,并测定细胞灰度值,用该仪器自带分析软件分析相应抗体的表达量。以上四组每组取五张切片,每张切片选五个视野,计算其平均值即为该张切片的灰度值,五张切片的平均值为该组的灰度值。
2 实验结果
2.1 酒制狼毒各组对抑瘤率的影响 生药狼毒对荷瘤小鼠的肿瘤生长有明显的抑制作用,20 g/kg体质量生药狼毒灌胃抑瘤作用最好,抑瘤率为69.45%,5、10 g/kg生药狼毒抑瘤率为46.78%、52.34%。经过用白酒炮制后狼毒对肿瘤的抑制作用明显增强,酒制狼毒低、中剂量组的抑瘤率分别高达98.40%、87.16%,高剂量酒制狼毒对肿瘤的抑制和生药狼毒比有所下降,抑瘤率为50.21%。见表1。
表1 生药狼毒和各组酒制狼毒对H22荷瘤小鼠抑瘤率的影响(±s,n=10)Tab.1 Effect of tumor inhibition of liquor-saturated Stellera chamaejasme and crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)

表1 生药狼毒和各组酒制狼毒对H22荷瘤小鼠抑瘤率的影响(±s,n=10)Tab.1 Effect of tumor inhibition of liquor-saturated Stellera chamaejasme and crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
注:与肿瘤对照组比较,▲P<0.05;与生药狼毒高剂量组比较,■P<0.05。
组 别 瘤质量/g 抑瘤率/%肿瘤对照组0.655 6±0.416 9 -生药狼毒低剂量组 0.545 0±0.396 6▲ 46.78生药狼毒中剂量组 0.418 9±0.527 8▲ 52.34生药狼毒高剂量组 0.200 3±0.176 4▲ 69.45酒制狼毒低剂量组 0.010 5±0.011 2▲■ 98.40酒制狼毒中剂量组 0.084 2±0.101 4▲■ 87.16酒制狼毒高剂量组 0.326 4±0.366 2▲50.21
2.2 酒制狼毒各组对体质量增长、脾脏和胸腺的影响 与空白对照组比较,生药狼毒组和酒制狼毒低、中、高剂量组的体质量增长均P>0.05,无明显变化;与空白对照组比较,酒制狼毒低、中、高剂量各组对脾脏、胸腺的毒副作用小,脾指数、胸腺指数均P>0.05;生药狼毒组对脾脏、胸腺影响较大,与空白对照组比较脾指数、胸腺指数均P<0.05;与生药狼毒组比较,酒制狼毒低、中、高剂量各组的脾指数和胸腺指数均P<0.05。见表2。
2.3 生药狼毒和各组酒制狼毒对Bax及Bcl-2表达的影响 与生药狼毒组比较,酒制狼毒各组明显使Bax表达上调,Bcl-2的表达下调,P<0.05有统计学意义。见表3。
表2 生药狼毒和各组酒制狼毒对H22荷瘤小鼠体质量增长、脾指数、胸腺指数的影响 (±s,n=10)Tab.2 Effect of body weight,thymus index,spleen index in liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
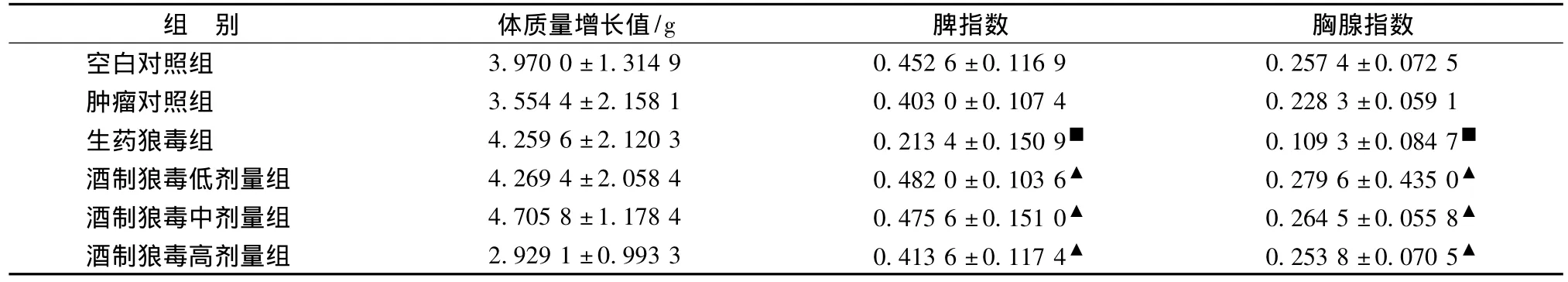
表2 生药狼毒和各组酒制狼毒对H22荷瘤小鼠体质量增长、脾指数、胸腺指数的影响 (±s,n=10)Tab.2 Effect of body weight,thymus index,spleen index in liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme on H22tumor-bearing mice(±s,n=10)
注:与空白对照组比较,■P<0.05,与生药狼毒组比较,▲P<0.05。
脾指数 胸腺指数空白对照组组 别 体质量增长值/g 3.970 0±1.314 9 0.452 6±0.116 9 0.257 4±0.072 5肿瘤对照组 3.554 4±2.158 1 0.403 0±0.107 4 0.228 3±0.059 1生药狼毒组 4.259 6±2.120 3 0.213 4±0.150 9■ 0.109 3±0.084 7■酒制狼毒低剂量组 4.269 4±2.058 4 0.482 0±0.103 6▲ 0.279 6±0.435 0▲酒制狼毒中剂量组 4.705 8±1.178 4 0.475 6±0.151 0▲ 0.264 5±0.055 8▲酒制狼毒高剂量组 2.929 1±0.993 3 0.413 6±0.117 4▲ 0.253 8±0.070 5▲
表3 Bax、Bcl-2在各组酒制法狼毒和生药狼毒组中表达的比较 (±s)Tab.3 Comparison of Bax and Bcl-2 on liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme(±s)
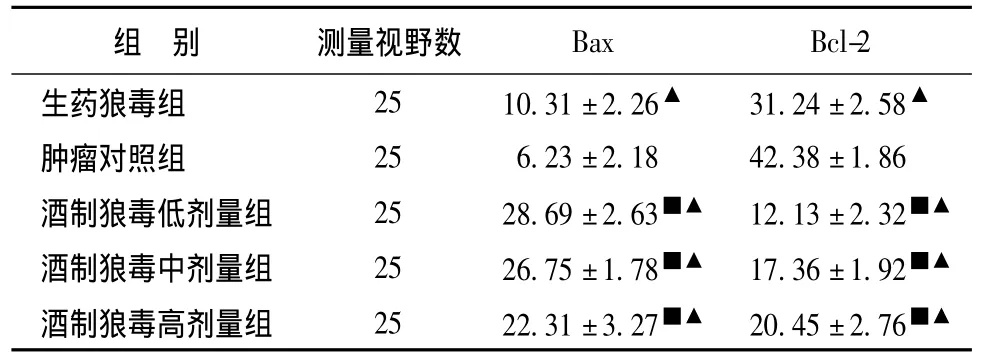
表3 Bax、Bcl-2在各组酒制法狼毒和生药狼毒组中表达的比较 (±s)Tab.3 Comparison of Bax and Bcl-2 on liquor-saturated Stellera chamaejasme and groups of crude Stellera chamaejasme(±s)
注:与生药狼毒组比较,■P<0.05;与肿瘤对照组比较,▲P<0.05。
组 别 测量视野数Bax Bcl-2生药狼毒组 25 10.31±2.26▲ 31.24±2.58▲肿瘤对照组 25 6.23±2.18 42.38±1.86酒制狼毒低剂量组 25 28.69±2.63■▲ 12.13±2.32■▲酒制狼毒中剂量组 25 26.75±1.78■▲ 17.36±1.92■▲酒制狼毒高剂量组 25 22.31±3.27■▲ 20.45±2.76■▲
取生药狼毒组和酒制狼毒低、中、高剂量组的肿瘤,做免疫组化常规DAB显色,Bax表达阳性的为细胞质有棕黄色颗粒,与肿瘤对照组比较,生药狼毒和酒制狼毒棕黄色颗粒都有增加;与生药狼毒组比较,酒制毒低、中剂量棕黄色颗粒增加较多,高剂量增加较少 (见图1)。
取生药狼毒组和酒制狼毒低、中、高剂量组的肿瘤,做免疫组化常规DAB显色,Bcl-2表达阳性的为细胞质有棕黄色颗粒,与肿瘤对照组比较,生药狼毒组和酒制狼毒棕黄色颗粒减少;与生药狼毒组比较,酒制狼毒低、中剂量棕黄色颗粒明显减少,高剂量亦减少,与低、中剂量比稍高 (见图2)。
3 讨论
因昆明种小鼠和裸鼠的荷瘤率均为100%,本实验目的是研究酒制狼毒抗肿瘤的作用及对胸腺、脾脏等重要脏器的影响,所以荷瘤小鼠选的是昆明种小鼠而非裸鼠。

图1 生药狼毒和各组酒制狼毒及肿瘤对照组Bax的表达 (DAB×400)Fig.1 Comparison of the expression of Bax among crude Stellera chamaejasme,groups of liquorsaturated Stellera chamaejasme and tumor contrast(DAB×400)
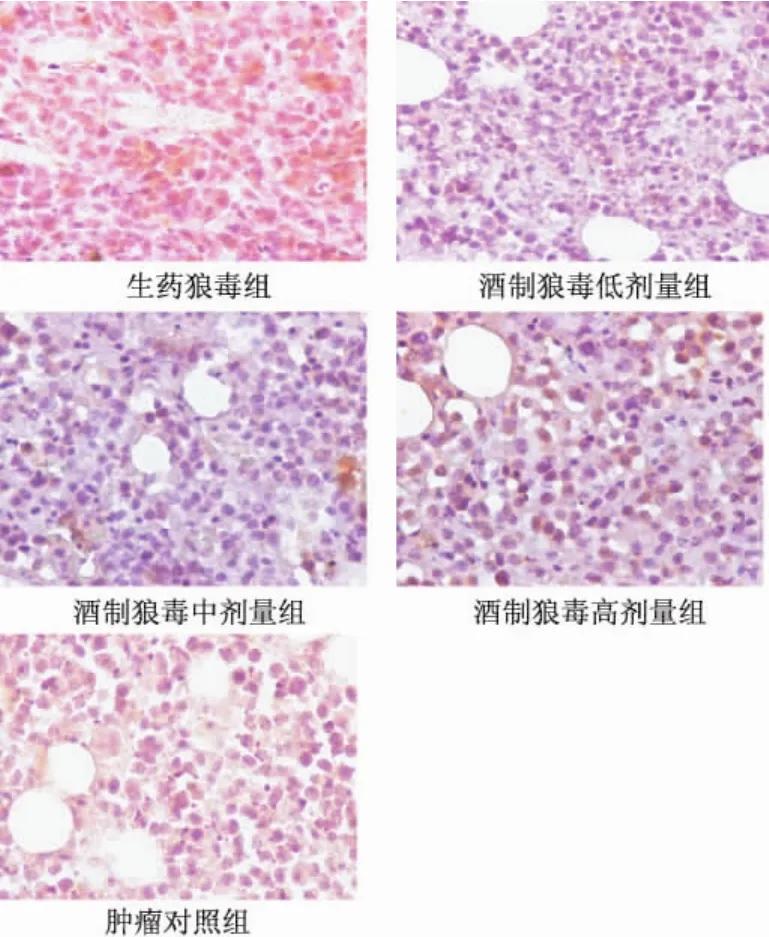
图2 生药狼毒和各组酒制狼毒及肿瘤对照组Bcl-2的表达 (DAB×400)Fig.2 Comparsion of the expression of Bcl-2 among groups of crude Stellera chamaejasme,liquorsaturated Stellera chamaejasme and tumor contrast(DAB×400)
中药狼毒在中国被广泛应用于治疗肿瘤,其中有多种成分被发现有抗肿瘤的功能[6]。本实验通过动物实验证实生药狼毒的抗肿瘤作用明显。在表1中可以看到生药狼毒的最大抑瘤率达到69.45%。炮制后,低、中剂量酒制狼毒抑瘤率大幅提高,尤其低剂量酒制狼毒的抑瘤率高达98.40%,中剂量酒制狼毒也达到87.16%,比同剂量生药狼毒的抑瘤率增加,这说明用白酒炮制后能显著提高生药狼毒的疗效。狼毒又名断肠草[7],对身体的危害较大,用白酒炮制后低剂量就能达到很好的抑瘤作用,这样就可以减少狼毒的用量,从而能减轻狼毒对身体的伤害。至于高剂量酒制狼毒比生药狼毒的抑瘤率降低,需进一步做实验探讨其机理。
经白酒炮制后既提高了狼毒的疗效亦能降低其对脾脏和胸腺的损害,从表2中可以看到,与正常对照组比较,酒制低、中、高剂量组的脾指数和胸腺指数P>0.05,说明没有差异,经白酒炮制后狼毒的毒性明显降低,对脾、胸腺没有明显损害。与正常对照组比较,生药狼毒的脾指数和胸腺指数均P<0.05,说明有显著性差异,生药狼毒对脾和胸腺的损伤较大。从表2数据可以得出,与生药狼毒组比较,酒制低、中、高剂量各组的脾指数和胸腺指数均P<0.05,说明经白酒炮制后确实减轻了狼毒的毒性,明显降低了对这些免疫脏器的损伤。经白酒炮制后用较低剂量的狼毒就能达到很理想的抑瘤作用,对脾、胸腺等重要器官又没有明显的毒副作用,为狼毒用于临床抗肿瘤提供新的思路。
酒制狼毒与生药狼毒比较能显著提高抑瘤率,其作用机制可能是使Bax的表达明显上调,Bcl-2的表达逐渐下调。抗凋亡基因编码的Bcl-2蛋白主要分布在线粒体外膜、细胞膜内表面、内质网膜及核膜等处[8]。它广泛存在于造血细胞、上皮细胞、淋巴细胞、神经细胞及多种肿瘤细胞,体内和体外实验都表明Bcl-2基因可抑制各种刺激下多种细胞的凋亡[9]。Bcl-2抗凋亡的机制目前认为主要有:①拮抗促凋亡基因bax;②抑制促凋亡的蛋白质细胞色素c自线粒体释放到胞质;③ 阻止胞质中的细胞色素c激活caspase;④有抗氧化及维持细胞内钙稳态等作用[10]。Bax基因属于Bcl-2基因家族,编码的Bax蛋白可与Bcl-2形成异二聚体,对Bcl-2产生阻抑作用。研究发现Bax/Bcl-2两蛋白之间的比例关系是决定对细胞凋亡抑制作用强弱的关键因素,因此认为,Bax是极重要的促细胞凋亡基因之一[11]。Bcl-2基因启动子具有NF-κB的结合位点并受其调控,故NF-κB可活化通过诱导Bcl-2及其他抗凋亡基因而阻止细胞凋亡。也可通过刺激IL-1β转化蛋白酶、c-myc和TNF-α基因表达而导致细胞凋亡[12]。
本研究结果显示,与肿瘤对照组比较,生药狼毒组和各组酒制狼毒小鼠肿瘤细胞Bax蛋白表达量高,Bcl-2蛋白表达降低,从而促进了肿瘤细胞凋亡,这与前面生药狼毒和各组酒制狼毒均有明显的抑瘤作用一致;与生药狼毒组比较,酒制狼毒低、中、高剂量各组小鼠肿瘤细胞Bax蛋白表达量高,Bcl-2蛋白有表达降低。表明酒制狼毒比生药狼毒抑瘤作用提高可能是通过调控Bax和Bcl-2的表达,促进了肿瘤细胞的凋亡。
本实验结果显示,生药狼毒经白酒炮制后既大大提高了抑瘤作用,又显著降低了对胸腺、脾脏的毒副作用,临床可考虑用酒制狼毒代替生药狼毒入药,但其药效物质基础需进一步研究。
[1]郑宝江,胡海清.黑龙江省松嫩草地瑞香狼毒总黄酮含量的变化[J].东北林业大学学报,2006,34(4):59-60.
[2]胡蓉蓉,王义善.瑞香狼毒抗肿瘤作用研究进展[J].人民军医,2010,53(2):151-152.
[3]罗慧英,王爱勤.不同极性溶媒瑞香狼毒提取物的抗肿瘤活性比较[J].中国临床药理学与治疗学,2005,10(10):1140-1142.
[4]杨 柯,王义善,王莉平,等.狼毒药理作用研究及临床应用情况概述[J].临床医学,2010,23(7):2496-2498.
[5]曹新伟,冯卫生.狼毒的化学成分研究进展[J].河南中医学院学报,2004,19(6):81-84.
[6]杨 柯,张京玲,黄 谦,等.狼毒水提液对人A549肺癌细胞凋亡的影响[J].实用中西医结合临床,2011,11(5):88.
[7]郭晓庄.有毒中草药大辞典[M].天津:天津科技翻译出版公司,1992.446.
[8]孙晓芳,段 斐,寇素茹,等.低频电磁场对大鼠生精细胞凋亡基因表达影响[J].中国公共卫生,2009,25(8):989-990.
[9]曹志然,戎瑞雪,王 蓓,等.马鞭草水提取物对荷瘤小鼠抑瘤作用的实验研究[J].医学研究与教育,2009,26(5):1-3.
[10]王 敏,贾正平,马 骏,等.瑞香狼毒总黄酮提取物的抗肿瘤作用[J].中国中药杂志,2005,30(8):603-606.
[11]宋·唐慎微.证类本草.四库医学丛书[M].上海:上海古籍出版社,1991:524-740.
[12]江苏新医学院.中药大辞典·下册[M].上海:上海人民出版社,1977:1898.
