oqxAB基因在大肠埃希菌和肺炎克雷伯菌中的流行及传播
2013-08-23李瑞华聂大平
李瑞华,刘 亮,聂大平,曲 杰
细菌质粒介导喹诺酮类耐药基因主要有qnrA、qnrS、qnrB、qnrC、qnrD、aac(6’)-1b-cr、qepA 和oqxAB,其中qepA和oqxAB是近年来新发现的质粒介导耐喹诺酮类药物的外排泵转运蛋白的编码基因[1]。oqxAB 基因是由丹麦科学家Sorensen等[2]在2003年从猪粪中分离的1株含有可接合质粒的pOLA52的大肠埃希菌中发现的,将pOLA52质粒在异源性大肠埃希菌中特异表达,可使其对萘啶酸和环丙沙星的最低抑菌浓度(MIC)分别提高800%和1 600%。现已在动物和人的大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌和沙门菌都检测到oqxAB基因[3-5]。
本研究对临床分离的大肠埃希菌和肺炎克雷伯菌进行oqxAB基因检测,并通过质粒接合试验了解oqxAB基因的传播机制,为临床减少oqxAB基因流行和合理用药提供理论依据。
材料与方法
一、材料
(一)菌株 收集2012年9—11月分离自大连医科大学附属第二医院住院患者血、尿、分泌物、痰标本的121株细菌。均为患者的初次分离菌株,其中大肠埃希菌72株,肺炎克雷伯菌49株。oqxAB基因阳性对照菌为肺炎克雷伯菌ATCC700603、受体菌大肠埃希菌、大肠埃希菌ATCC25922。
(二)主要试剂及仪器 引物合成和Marker DL2000TM购自大连宝生物工程有限公司。PCR Mastermix购自天根生化科技有限公司。西班牙琼脂糖购于北京方宝生物技术公司。LB、MH培养基、胰大豆琼脂为杭州天和微生物试剂有限公司产品。ZF-302型紫外线分析仪为上海梅颖浦仪器仪表公司产品。
(三)细菌鉴定与药敏试验 细菌鉴定及药敏由VITEK2细菌鉴定药敏分析仪完成,大肠埃希菌ATCC25922作为药敏试验质控菌。药敏试验结果按照CLSI 2012年版标准判读。
二、方法
(一)PCR扩增oqxAB基因
1.煮沸法提取细菌DNA:挑取过夜培养纯菌落于1 mL生理盐水调成5麦氏浊度,13 000 r/min离心10 min,弃上清液。加入200μL灭菌蒸馏水,混匀后煮沸10 min,13 000 r/min离心10 min,吸取上清液,-20℃冷冻,备用。
2.PCR引物及反应条件:oqxAB基因引物序列参照文献[4],反应体系为25μL:PCR反应液12.5μL、上下游引物各1μL、细菌 DNA(模板)2.0μL、灭菌蒸馏水补足至25μL。
PCR反应条件 oqxA:94℃3 min,94℃45 s→57℃45 s→68℃ 60 s,34个循环,68 ℃延伸7 min。oqxB:94℃3 min,94℃45 s→64℃45 s→72℃60 s,32个循环,72℃延伸7 min。
3.电泳:取5μL PCR产物,在含有溴乙锭的2%琼脂糖凝胶电泳,紫外线分析仪下观察,拍照。将392 bp(oqxA)、512 bp(oqxB)扩增条带与肺炎克雷伯菌ATCC700603比较,并将PCR产物纯化后送往大连宝生物工程有限公司进行测序,结果在GenBank比对。
(二)质粒接合实验 选oqxA及oqxB基因均阳性的大肠埃希菌、肺炎克雷伯菌为供体菌。受体菌为大肠埃希菌。方法:取培养至对数生长期的供体菌及受体菌各0.5 mL加到4 mL新鲜LB肉汤中过夜培养。接合子分别以原液、10、100、1 000、10 000倍稀释接种于含叠氮钠(100 mg/L)、庆大霉素(10 mg/L)的胰大豆琼脂(TSA)平皿筛选,并将接合子传代3次。
(三)琼脂稀释法测环丙沙星对大肠埃希菌接合子和8株含与不含oqxAB基因环丙沙星敏感肺炎克雷伯菌的MIC及MPC用琼脂稀释法测定环丙沙星对oqxAB基因阳性的供体菌、接合子、大肠埃希菌ATCC 25922、大肠埃希菌J53及肺炎克雷伯菌的MIC。防耐药突变浓度(MPC)是将上述细菌浓度调到10麦氏浓度,0.1 mL涂布含不同浓度环丙沙星平皿,37℃孵育48 h后无菌落生长的平皿所含药物浓度为该菌的MPC。
(四)统计学方法 采用SPSS10.0软件进行统计学处理,采用χ2检验比较oqxAB基因在环丙沙星敏感和耐药菌中检出率。
结 果
一、OqxAB基因阳性菌株
72株大肠埃希菌分别检测出oqxA基因15株(20.8%),oqxB 基因4株(5.6%),oqxAB基因7株(9.7%);49株肺炎克雷伯菌分别检测出oqxA基因4株(8.2%),oqxB 基因1株(2.0%),oqxAB 基因34株(69.4%)。测序结果显示,大肠埃希菌和肺炎克雷伯菌与GenBank登录号为AB601773.1和FJ975561.1的oqxAB基因序列相似度均为99%。
二、oqxAB阳性菌株在环丙沙星敏感和耐药大肠埃希菌和肺炎克雷伯菌中分布
在环丙沙星敏感和耐药的大肠埃希菌中oqx¯AB 基因阳性分别为2株(2/16)和5株(5/56)(χ2=0.003,P>0.90);在环丙沙星敏感和耐药肺炎克雷伯菌中,oqxAB基因阳性分别为8株(8/14)和26株(26/35)(χ2=0.69,P>0.25)。表明,oqxAB 基因在环丙沙星敏感和耐药的大肠埃希菌和肺炎克雷伯菌中的检出率差异无统计学意义。
三、含与不含oqxAB基因大肠埃希菌和肺炎克雷伯菌药敏结果。
含与不含oqxAB基因大肠埃希菌和肺炎克雷伯菌对喹诺酮类药物敏感率差异无统计学意义,但含oqxAB基因的肺炎克雷伯菌对氨基糖苷类抗生素敏感率低于不含oqxAB基因的菌株。见表1。
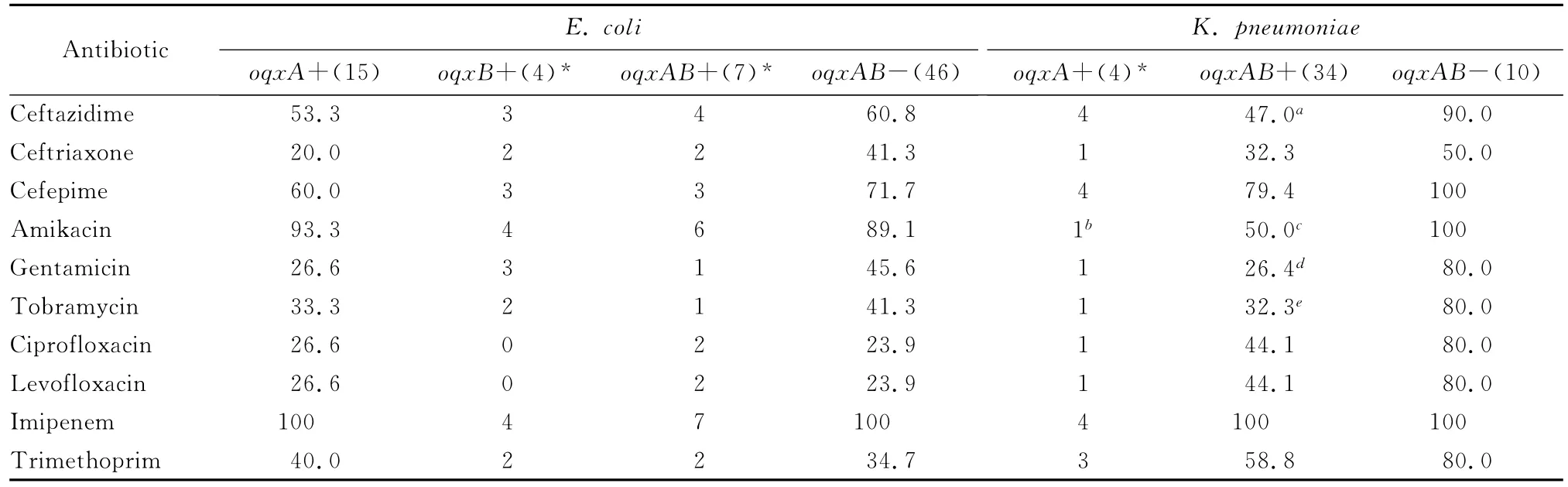
表1 含与不含oqxAB基因大肠埃希菌和肺炎克雷伯菌对抗菌药物的敏感率(%)Table 1 The susceptibilities of E.coli and K.pnuemoniae strains with or without oqxABto antimicrobial agents(%)
四、质粒接合试验及接合子MIC和MPC
将5株含有oqxAB基因的大肠埃希菌进行质粒接合试验,有4株生长,挑选出可能为接合子的单菌落,PCR扩增oqxAB、4株菌均扩增出oqxAB基因,4株接合子环丙沙星的MIC和MPC值较受体菌分别高15~31倍和32倍。见表2。
经3次传代,细菌中仍然能检测出oqxAB基因,说明oqxAB在大肠接合子中的存在比较稳定。
肺炎克雷伯菌未接合成功。环丙沙星MIC在≤0.062 5 mg/L 时,含和不含oqxAB 基因肺炎克雷伯菌各4株的 MPC为0.25~1.0mg/L;环丙沙星 MIC为0.25~0.5 mg/L时,含和不含oqxAB基因肺炎克雷伯菌各4株的MPC为2~16 mg/L。
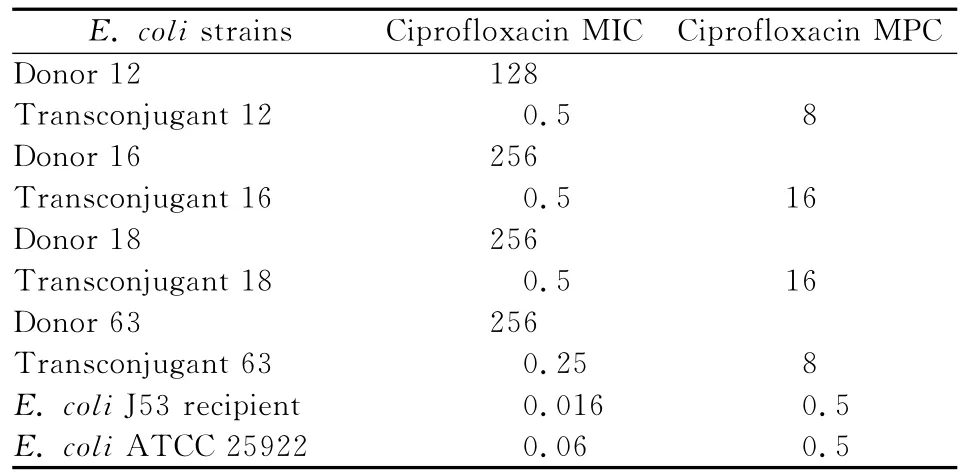
表2 大肠埃希菌oqxAB基因供体菌、受体菌及接合子对环丙沙星的MIC和MPC值(mg/L)Table 2 The MICs and MPCs of ciprofloxacin against donor,recipient and transconjugant of oqxAB-positive E.coli(mg/L)
讨 论
本研究肺炎克雷伯菌oqxAB基因阳性率为69.4%。大肠埃希菌为9.7%、但oqxA基因单独检出率在大肠埃希菌较高。而上海地区肺炎克雷伯菌oqxAB基因阳性率为100%,大肠埃希菌为6.6%[6];韩国来源血培养的261株大肠埃希菌、65株阴沟肠杆菌和135株肺炎克雷伯菌oqxAB基因阳性率分别为0.4%、4.6%和74.1%[4]。检出率不同可能是由于各个国家、地区使用抗菌药物的习惯不同所致。
研究证明大肠埃希菌oqxAB基因存在于质粒中,qnr、qepA和oqxAB基因本身赋予喹诺酮类的耐药是低水平的,即MIC值仍在敏感范围内,但与不含上述基因菌株比较,其MIC值可升高2~256倍[1,3,6],本研究质粒接合试验在大肠埃希菌有4株细菌质粒接合成功,传3代后,PCR可测出oqxAB基因,说明oqxAB性基因可通过质粒进行转移并且比较稳定。比较环丙沙星对接合子、供体菌和大肠埃希菌J53的MIC,供体菌的耐药水平高于其相对应的接合子,4株接合子的MIC较受体菌升高15~31倍,但仍在敏感范围内。另外,研究结果显示,oqxAB阳性基因在环丙沙星敏感和耐药的菌株中分布没有差异,而且含与不含oqxAB基因包括单纯oqxA和oqxB基因的大肠埃希菌对喹诺酮类药物敏感率没有差别。这些都表明oqxAB基因介导喹诺酮耐药是低水平的。我们检测含oqxAB基因接合子的MPC,发现其MPC较受体菌大肠埃希菌J53明显增高,证明含oqxAB基因的细菌在喹诺酮类药物压力选择下也能导致高水平耐药。
本研究中肺炎克雷伯菌质粒接合没有成功,含与不含oqxAB基因的菌株对喹诺酮药物敏感率没有差别,但含oqxAB基因的菌株对氨基糖苷类抗生素敏感率低于不含oqxAB基因的菌株。有研究表明,肺炎克雷伯菌oqxAB基因存在染色体或大质粒上,oqxAB基因在临床分离株中有低表达(MIC≤0.06 mg/L)和高表达(MIC≥0.125 mg/L),RTPCR显示,oqxA高表达时是低表达的4倍;肺炎克雷伯菌ATCC700603中oqxA的表达是肺炎克雷伯菌ATCC27799的18倍[7]。表明肺炎克雷伯菌对喹诺酮类的敏感程度取决于oqxAB的表达水平。Yuan等[6]发现部分含oqxAB基因肺炎克雷伯菌,环丙沙星 MIC≤0.03 mg/L,提示oqxAB基因没有表达。为了解不同MIC值的菌在喹诺酮压力下是否能产生高水平耐药,我们测定环丙沙星 MIC≤0.062 5 mg/L肺炎克雷伯菌的 MPC,发现有或无oqxAB基因,都未产生高水平耐药,而环丙沙星MIC为0.25~0.5 mg/L,有或无oqxAB 基因的肺炎克雷伯菌均产生高水平耐药。表明oqxAB基因没有受到喹诺酮压力选择,高水平耐药仅与其MIC浓度相关,这有待于进一步研究。
综上所述,在大肠埃希菌中oqxAB基因是由质粒介导的,对喹诺酮类抗菌药物产生低水平耐药,含oqxAB基因细菌在环丙沙星压力选择下能产生高水平耐药。oqxAB基因广泛存在于肺炎克雷伯菌中,对环丙沙星敏感的肺炎克雷伯菌,在环丙沙星压力选择下产生高水平耐药似乎与oqxAB基因无关,而与其MIC浓度有关。
[1] Strailevitz J,Jacpby GA,Hooper DC,et al.Plasmid-mediated quinolone resistance:a multifaceted threat[J].Clin Microbiol Rev,2009,22(4):664-689.
[2] Sørensen AH,Hansen LH,Johannesen E,et al.Conjugative plasmid conferring resistance to olaquindox[J].Antimicrob Agents Chemother,2003,47(2):798-799.
[3] Zhao J,Chen Z,Chen S,et al.Prevalence and dissemination of oqxABin Escherichia coli isolates from animals,farmworkers,and the environment[J].Antimicrob Agents Chemother,2010,54(10):4219-4224.
[4] Kim HB,Wang M,Park CH,et al.OqxABencoding a multidrug efflux pump in human clinical isolates of Enterobacteriaceae[J].Antimicrob Agents Chemother,2009,53(8):3582-3584.
[5] 刘继,宋立,魏飞龙,等.食品动物源沙门菌oqxAB基因的检测及水平传播机制研究[J].华南农业大学学报,2011,32(4):105-109.
[6] Yuan J,Xu X,Guo Q,et al.Prevalence of the oqxABgene complex in Klebsiella pneumonia and Escherichia coli clinical isolates[J].J Antimicrob Chemother,2012,67(7):1655-1659.
[7] Rodríguez-Martínez JM,Díaz de Alba P,Briales A,et al.Contribution of OqxABefflux pumps to quinolone resistance in extended-spectrum-β-lactamase-producing Klebsiella pneumonia[J].J Antimicrob Chemother,2013,68(1):68-73.
