抗丙型肝炎药物波普瑞韦临床研究新进展
2013-08-23黄玉仙
周 璞,黄玉仙
丙型肝炎病毒(HCV)感染人体后,病情进展隐匿,可发展成慢性肝炎、肝硬化、肝癌,严重危害人类身体健康。据估计目前全球约有1.6亿人感染HCV[1],给社会和家庭带来了沉重负担。
聚乙二醇化α-干扰素联合利巴韦林是目前HCV感染的标准治疗方案,但该方案用于难治的HCV基因1(GT1)型患者,获得持续病毒学应答效率 (sustained virological response,SVR)仅40%~50%[2]。近年来,基于对HCV结构和复制过程的深入了解,已开发一系列直接作用于HCV复制过程的特异性药物(direct-active antiviral agents,DAAs)。多项临床试验显示,这类药物与标准治疗方案联合应用,能显著提高HCV患者的SVR。其中,NS3/4A蛋白酶抑制剂波普瑞韦(boceprevir)和特拉匹韦(telaprevir)已于2011年5月由美国FDA批准上市,可与聚乙二醇化α-干扰素和利巴韦林联合用于HCVGT1型成人患者的治疗[3]。目前我国HCV抗体阳性率约0.43%,以GT1b多见[4]。因此该类药物的上市,在国内具有较大的应用前景。现就抗HCV GT1型新药波普瑞韦的作用机制、治疗慢性丙型肝炎(CHC)的疗效及其耐药性、不良反应等作一综述。
一、HCV的基因结构及波普瑞韦的作用机制
HCV属黄病毒科丙型肝炎病毒属,为单股正链RNA病毒,其基因组约由9 600个核苷酸组成,由一个开放阅读框编码约含3 010个氨基酸的前体蛋白。这个多蛋白前体,被病毒或宿主蛋白酶切割成10个结构和非结构蛋白。结构蛋白包括核心蛋白和包膜蛋白,分别由结构基因核心区C和包膜区(E1、E2/NS1)编码。非结构蛋白7种,由非结构基因(NS)包括(NS2、NS3、NS4A、NS4B、NS5A、NS5B、P7)编码[5]。其中NS3基因位于HCV全基因序列的3420-5312nt位点,编码约631氨基酸的NS3,其相对分子质量约70 000,近C端三分之二具有三磷酸核苷酶和螺旋酶(helicase)活性,近N端三分之一具有丝氨酸蛋白酶活性。丝氨酸蛋白酶主要与NS4A蛋白协同发挥蛋白酶水解作用,将多聚蛋白前体切割成成熟的非结构蛋白。而三磷酸核苷酶和螺旋酶主要参与的是HCV病毒的复制[5]。波普瑞韦是一种拟肽类蛋白酶抑制剂,通过分子结构中的酮酰胺基团与NS3蛋白活性位点的丝氨酸可逆性的共价结合,从而抑制HCV病毒在感染宿主细胞内的复制[6]。
二、波普瑞韦的药动学
波普瑞韦口服吸收后约2 h达到血药高峰,血半衰期约3.4 h,与食物同服时,药物暴露量可提高65%,因此建议进餐时同服波普瑞韦800 mg,每天3次。体外试验显示,波普瑞韦主要经醛酮还原酶(AKR)代谢,小部分经细胞色素酶CYP3A4/5代谢,同时又是细胞色素酶CYP3A4抑制剂,故当波普瑞韦与高度依赖CYP3A4/5清除的药物如地高辛、他汀类药物同时给药时,可造成血药浓度升高,甚至引起严重危及生命的后果,因此需密切监测这类药物的血药浓度。当波普瑞韦与CYP450抑制剂(如抗真菌唑类药物)同用时,可能造成波普瑞韦在体内蓄积[7]。波普瑞韦主要通过肝脏排泄,在肝功能异常患者中,药物高峰血浓度和药时下曲线面积均有所上升,但药物消除半衰期与健康人无差异。在肾功能不全终末期患者中,波普瑞韦各项药物代谢动力指标与健康人无明显差异,本品不能经血液透析清除。因此,肝肾功能不全患者使用波普瑞韦时,不需减量[8]。
三、波普瑞韦的临床研究
波普瑞韦已完成2项全球Ⅲ期临床试验,给药方案是波普瑞韦(口服800 mg每天3次,在进餐或吃点心时服用)联合聚乙二醇α-干扰素-2b皮下注射1.5μg/kg,每周1次、利巴韦林(根据体质量差异口服600~1 400 mg,每天1次)[9-10]。
(一)波普瑞韦对初治HCVGT1型患者的疗效
SPRINT-2[9]临床研究主要观察 HCVGT1型初治患者在标准治疗方案基础上加用波普瑞韦的疗效和安全性。该试验共入选患者1 099例,血清HCV RNA均≥104u/L,入选患者按1∶1∶1分为3组,均采用治疗导入期干扰素联合利巴韦林4周,随后患者继续按(1)安慰剂+干扰素联合利巴韦林44周。(2)波普瑞韦应答指导治疗24周治疗,若治疗8~24周后HCV RNA检测阴性则结束治疗;若阳性则再继续20周波普瑞韦治疗。(3)波普瑞韦44周方案治疗,见图1。治疗结束后,3组总体持续的毒应答率(SVR)分别为38%、63%、66%。鉴于种族对HCV抗病毒治疗应答的差异较大,按黑人和非黑人进行分层分析,发现非黑人组SVR分别为40%、67%、68%;而黑人组分别为23%、42%、53%。随访治疗结束后复发率(定义为治疗结束时HCV RNA检测阴性,随访24周过程中HCV RNA转为阳性)总体为22%、9%、9%,非黑人组为23%、9%、8%,黑人组因复发患者数较少,数据无统计学意义。在波普瑞韦应答指导治疗组,44%患者只需28周疗程,即可获得97%的SVR,而在波普瑞韦44周组,满足8~24周HCV RNA检测阴性的患者,完成治疗后,SVR达96%,两组SVR差异无统计学意义。该研究结果表明,HCV GT1型患者接受含有波普瑞韦的三联治疗方案能获得更高的SVR和较低的复发率,尤其在非黑人人群中。另外,通过波普瑞韦应答指导治疗优化治疗方案,可使部分患者疗程缩短至28周,减少药物的不良反应。
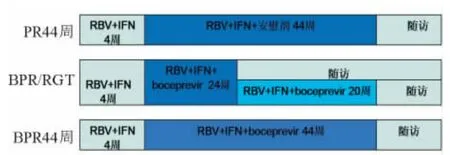
图1 SPRINT-2临床试验Figure 1 SPRINT-2 clinical trial
(二)波普瑞韦对经治HCVGT1型患者的疗效
RESPOND-2[10]临床研究主要观察在标准治疗方案基础上加用波普瑞韦对HCVGT1型经治疗失败患者的疗效和安全性。该研究入选403例经干扰素联合利巴韦林治疗至少12周后复发(治疗结束时HCV RNA阴性,但无SVR)或无应答(干扰素联合利巴韦林治疗12周时HCV RNA下降至少2 log10IU,但整个治疗过程HCV RNA持续阳性)的HCV GT1型患者,按照1∶2∶2分为3组,均引入了干扰素联合利巴韦林4周治疗导入期,随后患者分别按干扰素联合利巴韦林44周安慰剂组、波普瑞韦应答指导治疗组(若8周和12周时HCV RNA检测阴性,则进行波普瑞韦32周的治疗;若在8周时HCV RNA仍可测出,而12周时 HCV RNA转阴则再增加12周的波普瑞韦治疗)或波普瑞韦44周组方案治疗,见图2。最终各组整体SVR分别为21%、59%和66%,说明波普瑞韦三联治疗方案可提高经治复发和无应答HCV GT1型患者的SVR。按复发和无应答组分层分析发现,经治疗复发患者的SVR分别为29%、69%和75%,而无应答经治患者SVR分别为7%、40%和52%,两组的SVR差异有统计学意义,提示与无应答患者比较,波普瑞韦三联治疗后可显著提高经干扰素联合利巴韦林治疗后复发的HCV患者的SVR。此外,在波普瑞韦应答指导治疗组和波普瑞韦44周组第8周时,HCV RNA检测阴性患者比率分别为46%和52%,这部分患者最终获得SVR的比率分别为86%和88%,差异无统计学意义,说明通过应答指导治疗方案,部分经治患者的治疗时间可缩短至36周,亦可获得满意疗效。
近期美国西北大学也进行了聚乙二醇α-干扰素-2a与波普瑞韦、利巴韦林联合用于经治失败HCVGT1型患者的临床试验。导入期结束后对照组给予干扰素联合利巴韦林44周治疗,试验组给予波普瑞韦44周治疗,结果SVR分别为21%和64%,进一步说明波普瑞韦三联治疗,可以明显提高经治失败患者的SVR[11]。
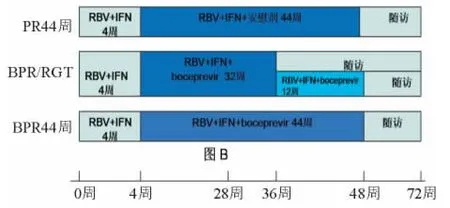
图2 RESPOND-2临床试验Figure 2 RESPOND-2 clinical trial
在波普瑞韦所有Ⅱ和Ⅲ期临床试验均有4周导入期。在波普瑞韦Ⅱ期临床试验SPRINT-1中已证明导入期不增高患者的SVR,但在RESPOND-2研究中,发现4周导入期治疗结束后,HCV RNA下降大于1 log10IU(定义为good response),这部分患者最终SVR分别为25%、73%和79%。而4周导入期治疗结束后,若 HCV RNA下降小于等于1 log10IU(定义为bad response),这部分患者SVR仅为15%、28%和27%,两者差异有统计学意义,表明导入期的设置对治疗结果有一定的预测价值。但是否需要设置导入期,目前尚有争议,有学者认为患者在进行波普瑞韦治疗前,血清中的HCV RNA即已降到一定水平,可避免过早暴露于蛋白酶抑制剂,造成耐药。也有认为对于基线病毒高载量的患者,导入期的设置使HCV病毒下降速度减慢,再加用波普瑞韦反而更易出现耐药[12],这有待于更多的临床研究进一步确证。
(三)波普瑞韦对HCVGT1型代偿性肝硬化患者的疗效 除HCV基因型及病毒载量与SVR相关外,肝硬化的程度也是影响SVR高低因素之一。波普瑞韦SPRINT-2试验发现,在使用含波普瑞韦的三联治疗组中,轻度和重度肝纤维化患者SVR分别为30%和19%,高于安慰剂组,提示三联治疗可提高HCVGT1型肝纤维化患者的SVR,其中肝纤维化较轻的患者SVR获益更多。在波普瑞韦应答指导治疗组,尽管部分严重肝纤维化或者肝硬化的患者,疗程可以缩短至28周,但这部分患者最终SVR的比率为75%,明显低于波普瑞韦44周组的92%。在轻度肝纤维化患者中,未见此差异,提示严重肝纤维化和肝硬化患者,为了获得更高的SVR,不宜采用缩短疗程的应答指导治疗方案,仍需采用全程治疗策略[13]。
四、不良反应
在波普瑞韦使用过程中,对药物的不良反应进行有效的控制和管理,也是治疗成功的关键。
波普瑞韦的主要不良反应是引起患者贫血和味觉障碍。在SPRINT-2研究中发现,波普瑞韦组与利巴韦林组相比,贫血发生率分别为49%和29%,利巴韦林需减量患者所占比率分别为21%和13%,需使用红细胞生成素(EPO)的患者比率分别为43%和24%,但因贫血需终止治疗者,干扰素联合利巴韦林组仅4例[9]。在RESPOND-2研究中,波普瑞韦组与干扰素联合利巴韦林组相比,贫血发生率分别为43%~46%和20%,需使用EPO患者分别为41%~46%和21%,因贫血需终止治疗者比率分别为0和3%[10]。这些结果表明,尽管波普瑞韦治疗可增加贫血的发生,但大部分患者通过利巴韦林的减量和EPO的使用,可纠正贫血。肝硬化与非肝硬化患者的贫血发生率分别为80%和73%,但出现Hb<85 g/L的情况分别为22%和11%,提示肝硬化患者更易发生严重的贫血,可能与肝硬化患者Hb基线值较低有关[14]。
另外,波普瑞韦引起味觉障碍可能降低患者对药物使用的依从性,但在全球Ⅲ期临床试验中,无患者因此终止治疗,表明多数患者尚可耐受此不良反应[9-10]。
五、波普瑞韦的耐药性
由于HCV RNA的高复制率及聚合酶缺乏校正作用,在HCV的感染者中存在大量异质性序列,即准种[15]。在波普瑞韦Ⅰ期临床试验中,对单剂治疗14 d后,NS3区出现HCV病毒耐药变异患者的血清进行病毒耐药表型分析,发现出现病毒耐药变异序列的克隆株占14.1%,变异主要集中在V36、T54、R155、A156、V170、V55等位点上。治疗结束后2周,含病毒耐药变异序列的克隆株下降至4.5%,提示在药物选择压力作用下,耐药病毒株成为优势株,从而引起继发性耐药[16]。有研究对507例HCV初治患者的基线血清进行波普瑞韦耐药位点的分析,发现在HCV GT1a型患者中,天然存在R155K和T54S耐药位点者分别占0.8%和1.9%,存在V36L和V36M耐药位点者分别占1.7%和0.6%,未发现 A156位点天然耐药。而在HCVGT1b型的患者中,仅发现T54S天然耐药突变,占1.4%[17]。近期有研究通过高通量测序的方法另外发现了患者天然存在A87T、R177H及S174F波普瑞韦的天然耐药位点,但此类患者的比例甚低,说明使用该药后不易出现原发性耐药变异。对波普瑞韦临床Ⅲ期试验患者血清中的HCV氨基酸耐药变异(RAVs)进行分析,发现获得SVR和未获得SVR患者基线存在RAVs比率分别为8%和6%,而在治疗后未获得SVR患者RAVs比率上升至55%,提示耐药突变可能在治疗过程中发生,与治疗失败有一定关系。
六、IL-28B基因多态性对波普瑞韦抗HCV疗效的预测价值
业已证明,宿主IL-28B基因多态性与HCV感染者病毒自发清除和标准治疗方案获得SVR相关。其中位于IL-28B基因上游的3 kb单核苷酸位点rs12979860多态性与治疗应答结果的相关性最强[18]。在SPRINT-2试验中,多元回归分析rs12979860基因的多态性预测波普瑞韦三联治疗的SVR,OR值(CC VS TT 和 CT)分别为2.6和2.1,提示有一定预测价值但不明显[19]。需注意的是,通过分层分析携带CC基因型的患者在波普瑞韦44周、波普瑞韦应答指导治疗和干扰素联合利巴韦林44周组治疗的SVR分别为80%、82%和78%,差异无统计学意义;而携带非CC基因型患者治疗组和对照组的SVR分别为59%~71%和27%~28%,差异有统计学意义。提示在初治患者中,波普瑞韦不能明显提高携带CC基因型患者的SVR,或许这部分患者仅用标准治疗方案即可获得满意疗效[20]。在 RESPOND-2试验中,rs12979860基因的多态性对波普瑞韦三联治疗的SVR预测无价值[19]。同时,在SPRINT-2和RESPOND-2临床试验的应答指导治疗组中,发现携带CC基因型的患者在第8周HCV RNA检测阴性(这部分患者治疗时间仅需28周和36周)比率分别为89%和76%,明显高于携带非CC基因型患者(CT53%和46%;TT42%和63%),提示IL-28B基因多态性可预测应答指导治疗组哪些患者可给予较短疗程[21]。
七、波普瑞韦临床使用指南
2011年,美国肝脏病协会针对药物波普瑞韦和特拉匹韦上市,对慢性HCV GT1型患者治疗指南做了更新,其中与波普瑞韦临床使用相关的有以下几条[22]:(1)感染 HCVGT1型的患者,目前最佳的治疗方案是特拉匹韦或波普瑞韦联合干扰素和利巴韦林的三联治疗。(2)波普瑞韦不可单独使用,必须与干扰素和利巴韦林联合,用药方法为800 mg每天3次,进餐时用。(3)在干扰素和利巴韦林为期4周导入治疗后,进行波普瑞韦和干扰素、利巴韦林行24~44周三联治疗。(4)波普瑞韦用于无肝硬化的初治患者,给予4周的干扰素联合利巴韦林导入治疗后开始加用波普瑞韦,若HCV RNA在8~24周期间检测阴性,整体治疗时间可缩短至28周。(5)波普瑞韦用于肝硬化初治患者,必须与干扰素和利巴韦林联用,疗程持续48周。(6)波普瑞韦三联治疗过程中,若HCV RNA在4~12周期间检测>1 000 u/mL或在24周时 HCV RNA 仍可测出,必须停用所有正在使用的抗HCV药物。(7)干扰素和利巴韦林联合治疗复发和部分应答的患者,推荐使用波普瑞韦联合干扰素、利巴韦林治疗。(8)通过应答指导方案,缩短治疗时间,可用于复发和部分应答的患者。但对于原始无应答的患者,使用波普瑞韦、干扰素和利巴韦林三联治疗,建议疗程48周。(9)经治患者使用波普瑞韦时,若HCV RNA在第12周时仍>100 u/mL,立刻停止所有抗 HCV治疗,避免产生耐药。(10)使用蛋白酶抑制剂类药物的患者,必须密切观测血清HCV RNA的水平,一旦出现病毒反弹(高于病毒最低点水平一个数量级)时,应立即停止治疗。(11)经蛋白酶抑制剂治疗后出现无应答、复发和病毒学突破的患者,不可再使用蛋白酶抑制剂治疗。
八、结语
HCV感染作为全球性健康问题,亟待解决,小分子药物的出现给其治疗带来了新希望。FDA新批准上市的蛋白酶抑制剂波普瑞韦,对HCV GT1初治和经治患者,临床疗效都优于标准治疗方案。而对该药物使用时出现病毒耐药变异和药物不良反应,以及该药与其他药物之间的相互作用的管理,也需要注意,且波普瑞韦临床使用人群尚有一定的局限性。令人欣慰的是,目前尚有很多新型的小分子抗HCV药物在开发和临床试验中,希望能找到最优化的治疗方案,以期达到更好的治疗效果。
[1] Negro F,Alberti A.The global health burden of hepatitis C virus infection[J].Liver Int,2011,31 Suppl 2:1-3.
[2] European Association for the Study of the Liver.EASL Clinical Practice Guidelines:management of hepatitis C virus infection[J].J Hepatol,2011,55(2):245-264.
[3] Ghany MG,Nelson DR,Strader DB,et al.An update on treatment of genotype 1 chronic hepatitis C virus infection:2011 practice guideline by the American Association for the Study of Liver Diseases[J].Hepatology,2011,54(4):1433-1444.
[4] 陈园生,李黎,崔富强,等.中国丙型肝炎血清流行病学研究[J].中华流行病学杂志,2011,32(9):888-891.
[5] Reed KE,Rice CM.Overview of hepatitis C virus genome structure,polyprotein processing,and protein[J].Curr Top Microbiol Immunol,2000,242:55-84.
[6] Rai R,Deval J.New opportunities in anti-hepatitis C virus drug discovery:targeting NS4B[J].Antiviral Res,2011,90(2):93-101.
[7] Kiser JJ,Burton JR,Anderson PL,et al.Review and management of drug interactions with boceprevir and telaprevir[J].Hepatology,2012,55(5):1620-1628.
[8] Treitel M,Marbury T,Preston RA,et al.Single-dose pharmacokinetics of boceprevir in subjects with impaired hepatic or renal function[J].Clin Pharmacokinet,2012,51(9):619-628.
[9] Poordad F,McCone J Jr,Bacon BR,et al.Boceprevir for untreated chronic HCV genotype 1infection[J].N Engl J Med,2011,364(13):1195-1206.
[10] Bacon BR,Gordon SC,Lawitz E,et al.Boceprevir for previously treated chronic HCV genotype 1infection[J].N Engl J Med,2011,364(13):1207-1217.
[11] Flamm SL,Lawitz E,Jacobson I,et al.Boceprevir with peginterferon alfa-2a-ribavirin is effective for previously treated chronic hepatitis C genotype 1 infection[J].Clin Gastroenterol Hepatol,2013,11(1):81-87.
[12] Foster GR,Serfaty LD.Triple combination treatment for chronic hepatitis C with protease inhibitors,pegylated interferon andribavirin:′lead-in or no lead-in′?[J].Liver Int,2012,32 Suppl 1:61-63.
[13] Bourliere M,Khaloun A,Wartelle-Bladou C,et al.Future treatment of patients with HCV cirrhosis[J].Liver Int,2012,32 Suppl 1:113-119.
[14] Sulkowski MS,Poordad F,Manns MP,et al.Anemia during treatment with peginterferon Alfa-2b/ribavirin and boceprevir:Analysis from the Serine protease inhibitor therapy 2(SPRINT-2)trial[J].Hepatology,2013,57(3):974-984.
[15] Neumann AU,Lam NP,Dahari H,et al.Hepatitis C viral dynamics in vivo and the antiviral efficacy of interferon alpha therapy[J].Science,1998,282(5386):103-107.
[16] Susser S,Welsch C,Wang Y,et al.Characterization of resistance to the protease inhibitor boceprevir in hepatitis C virus-infected patients[J].Hepatology,2009,50(6):1709-1718.
[17] Kuntzen T,Timm J,Berical A,et al.Naturally occurring dominant resistance mutations to hepatitis C virus protease and polymerase inhibitors in treatment-naive patients[J].Hepatology,2008,48(6):1769-1778.
[18] Pawlotsky JM.Treatment failure and resistance with directacting antiviral drugs against hepatitis C virus[J].Hepatology,2011,53(5):1742-1751.
[19] Poordad F,Bronowicki JP,Gordon SC,et al.Factors that predict response of patients with hepatitis C virus infection to boceprevir[J].Gastroenterology,2012,143(3):608-618.
[20] Berger CT,Kim AY.IL28B polymorphisms as a pretreatment predictor of response to HCV treatment[J].Infect Dis Clin North Am,2012,26(4):863-877.
[21] Thompson AJ,McHutchison JG.Will IL28B polymorphism remain relevant in the era of direct-acting antiviral agents for hepatitis C virus?[J].Hepatology,2012,56(1):373-381.
[22] Ghany MG,Nelson DR,Strader DB,et al.An update on treatment of genotype 1 chronic hepatitis C virus infection:2011 practice guideline by the American Association for the Study of Liver Diseases[J].Hepatology,2011,54(4):1433-1444.
