山葡萄转色期果皮转录因子MYB基因的克隆与分析
2013-08-22杨天天王晓平杨成君尉建平
杨天天,王晓平,杨成君,尉建平,李 波,王 军
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.中国农业大学食品学院,北京 1000085)
山葡萄是中国重要的野生果树资源,具有极强的抗寒性,是东北地区酿造葡萄酒的主要原料[1]。果实色泽是评价果实品质的重要指标之一,尤其对于红色酿酒葡萄品种。果实的颜色决定了葡萄酒的色泽和品质,而花色苷又是决定果实着色的主要物质,分布于果皮、果肉和葡萄籽等处,其中,果皮含量最高[2]。转色期作为非跃变型果实特有的一个生长阶段,是浆果在大小、硬度、色泽以及内部生理特点发生剧烈变化的时期[3]。转录因子(Transcription factor,TF)也称反式作用因子,是指能与真核基因启动子区域中的顺式作用原件发生特异性结合,通过它们之间以及与其他相关蛋白质元件的相互作用,激活或抑制转录,从而保证目的基因以特定的强度在特定的时间与空间下表达蛋白质分子。在植物生长发育及其对外界环境的反应中起着重要的调控作用[4]。在葡萄中,对MYB基因功能的研究主要集中在通过控制类黄酮糖基转移酶基因的表达调控花青素的生物合成,MYB5a、MYB5b、MYBPA1 和MYBPA2都参与了类黄酮的代谢[5-10],葡萄全基因组108个R2R3 MYB基因已公开发表[11]。
本研究拟从山葡萄转色期果皮cDNA文库中分离得到一段与转录因子MYB相关的基因片段,并进行生物信息学分析,旨在为阐明山葡萄花色苷的生物合成及调控奠定基础。
1 材料与方法
1.1 材料
山葡萄品种双丰(Vitis amurensis cv.Shuang Feng)采自中国农业科学院特产研究所国家山葡萄种质资源圃。在果实转色期(50%着色)采摘,采后洗净擦干,立即置于液氮中冷冻,于-80℃冰箱保存,取果皮作为供试材料。
大肠杆菌(E.coli)DH5α、pMD18-T 载体、胶回收试剂盒、Ex Taq聚合酶、PrimeScriptTMRT REAGENT Kit均购自TaKaRa,其他试剂为国产分析纯。DNA测序由北京华大生物公司完成。
1.2 方法
1.2.1 总RNA提取、纯化和cDNA合成 采用改良的 CTAB法[5]提取总 RNA,并进行纯化,按照TaKaRa PrimeScriptTMRT reagent试剂盒说明书合成cDNA,保持环境低温。
1.2.2 RT-PCR合成目的基因片段 首先构建山葡萄转色期果皮cDNA文库,并进行EST测序和生物信息学分析。从中选取一条与转录因子相关的基因片段(02_H07),使用BlastN程序将其在NCBI上进行同源基因比对,发现该序列与葡萄杂交种Colobel、Vintinto的转录因子 MYBA3基因相似性达到98%,与欧亚种葡萄VvmybA1相似性达97%,与欧亚种和美洲种的杂交品种的VlmybA1-1和VlmybA1-2的相似性分别为97%和96%。由搜索结果可以看出,MYB类基因保守区和两端非编码区的序列相似性极高,因此可以选取一个相似性最高的品种,根据其全长序列在两端分别设计特异引物。本研究利用Primer 5.0设计了3对特异引物,相关引物名称、引物序列和退火温度等信息见表1。

表1 合成目的基因片段的引物序列Table 1 Primer used for amplifying target gene fragments
3个PCR管分别标记为A、B、C。将已获得cDNA作为模板,利用特异引物进行PCR反应。PCR反应体系及条件:10× Ex Taq Buffer 2.0 μl,引物(10 μmol/L)各 1.0 μl,dNTP Mixture(2.5 mmol/L)1.6 μl,MgCl2(2.5 mmol/L)1.2 μl,TaKaRa Ex Taq酶(5 U/μl)0.5 μl,模板 cDNA(20 ng/μl)2.0 μl,ddH2O 10.7 μl。94℃预变性5 min;94℃变性30 s,退火30 s(温度见表1),72℃延伸X,35个循环;72℃延伸7 min。延伸时间X根据预期PCR片段确定,1000 bp以内为90 s,每超过500 bp延长30 s。PCR产物用1%琼脂糖凝胶电泳进行检测,于凝胶成像系统下成像观测。
1.2.3 PCR产物的DNA片段回收和连接 按照胶回收试剂盒说明书(购自上海宝生物公司)对PCR产物的DNA片段进行回收、连接与转化。对片段进行切割时,要尽可能减少DNA片段的损失,也要尽可能避免在紫外灯下照射过长时间。将回收的DNA片段与载体pMD-18连接,16℃连接过夜。反应体系为 10.0 μl,其中 DNA 片段 4.5 μl、pMD-18载体 0.5 μl、Ligation Mix 5.0 μl。
1.2.4 转化 将50 μl DH5α感受态细胞在冰上解冻后加入5 μl连接产物,加入预热的LB培养基,取适量菌液,涂布于含有50 μg/μl的氨苄青霉素(Amp)的LB固体培养基平板上,过夜。次日,挑菌并置于37℃培养箱中振荡培养6~8 h。随后进行菌液PCR,反应体系和程序同前。反应结束后取5 μl PCR产物进行1%琼脂糖凝胶电泳,以检测是否有相应大小的条带,随后将菌液送往北京六合华大基因科技股份有限公司进行测序,剩余菌液加入适量甘油置于-80℃保存。
1.2.5 目的基因的序列分析 对测序后的目的基因片段应用Vector NTI Suite 9.0软件去除载体序列后拼接获得cDNA全长,应用DNAStar软件对获得的目的基因全长cDNA序列进行开放阅读框分析,并推导出相应的氨基酸序列。利用BLASTP(http://www.ncbi.nlm.nih.gov/blastp)程序在 NCBI上进行氨基酸相似性比对分析,应用pfam24.0(http://pfam.sanger.ac.uk/search/sequence)对该基因进行家族预测。运用Protparam软件(http://au.expasy.org/tools/protparam.html)预测蛋白质的分子质量、等电点及基本性质。信号肽分析利用Signalp 3.0 Server程序(http://www.cbs.dtu.dk/services/Signalp)。跨膜区预测利用TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)。疏水性分析和二级结构预测分别在http://us.expasy.org/cgi-bin/protscale.pl和http://npsa-pbil.ibcp.fr/cgibin/npsa_automat.pl?page=/NPS/npsa_hnn.html网站进行。应用ClustalX 2.1对不同植物相关基因氨基酸进行多重比对,利用MEGA 4软件绘制系统发育树。
2 结果
2.1 总RNA的提取
采用改良CTAB法提取山葡萄转色期果皮总RNA,28S rRNA和18S rRNA条带清晰,点样孔处没有亮带,且条带两侧没有明显的弥散,亮度接近于2∶1,表明总RNA没有降解,较完整。总RNA的纯度使用核酸测定仪测定,紫外吸收值OD260/OD280为1.99,OD260/OD230为2.14,表明 RNA均一性较好,1%琼脂糖凝胶电泳结果如图1所示。
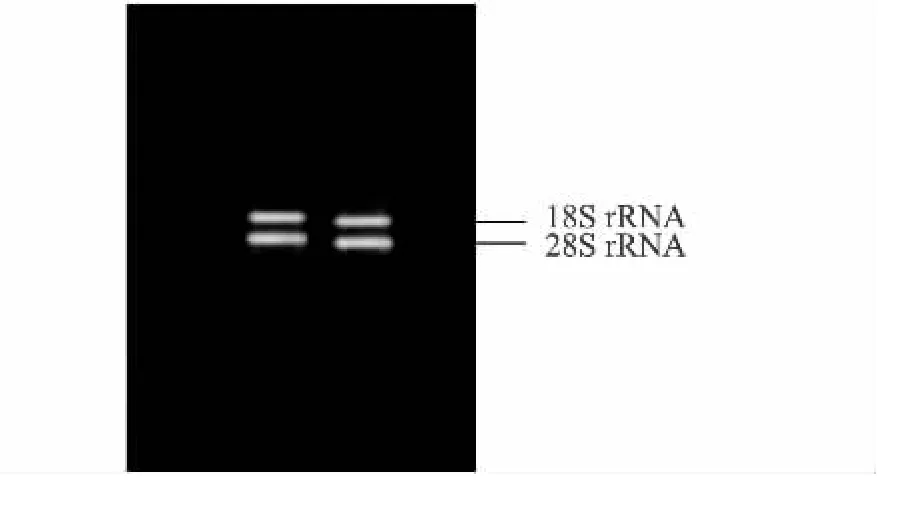
图1 山葡萄总RNA的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of total RNA from Vitis amuerensis
2.2 全长序列克隆
以提取总RNA反转录合成的cDNA为模板,用3对特异引物AF/AR、BF/BR、CF/CR进行PCR扩增,只有特异引物BF/BR获得了目的基因特异条带,电泳结果如图2所示,对750 bp左右的目的片段,进行回收、连接、转化。在目的片段转化平板后,随机挑取单克隆,加入含有氨苄青霉素(Amp)50 μg/μl的液体培养基中,37℃培养后,进行菌液PCR检测,电泳结果如图3所示,获得长约750 bp的基因片段。

图2 山葡萄MYBA3基因cDNA片段电泳检测Fig.2 Agarose gel electrophoresis of cDNA fragment of Vitis amuerensis MYBA3 gene
2.3 全长序列分析
菌液测序委托北京六合华大基因科技股份有限公司。将获得的测序结果应用Vector NTI Suite 9.0软件去除载体序列,然后拼接获得一段目的基因片段,通过BLAST程序在NCBI上进行同源搜索比对,结果显示该片段为山葡萄MYBA3的全长片段。应用DNAStar软件进行cDNA序列开放阅读框的分析并推导出相应的氨基酸序列。结果显示,该基因全长764 bp,包括开放阅读框753 bp和11 bp的3'-非翻译区(3'-UTR)。推测基因的开放阅读框编码250个氨基酸,分子量为 28680,等电点为7.49。负电荷残基(Arg+Lys)数为35个,正电荷(Asp+Glu)数为35个,不稳定系数为37.69,系稳定蛋白质。开放阅读框推导的相应氨基酸序列如图4所示。

图3 山葡萄MYBA3基因插入片段的PCR检测Fig.3 PCR detection of MYBA3 inserts of Vitis amuerensis

图4 山葡萄MYBA3基因序列及由此推导的氨基酸序列Fig.4 Nucleotide and deduced amino acid sequences of MYBA3 gene from Vitis amuerensis
利用NCBI的BlastP在线比对软件,在蛋白保守区数据库(Conserved domin database,CDD),对山葡萄基因 MYBA3推导的氨基酸序列进行蛋白质保守区预测。结果(图5)表明,该基因具有两个保守区,属于SANT超基因家族,从第8个氨基酸到第55个氨基酸和从第61个氨基酸到第106个氨基酸,分别匹配48个和46个氨基酸长度。
应用ProScale在线软件,以默认算法(Hphob.Kyte&Doolittle)对该基因推导的氨基酸序列进行蛋白质疏水性预测,结果(图6)显示,蛋白质疏水性最大值为1.367,最小值为-3.100,疏水平均值为-0.867,具有一定的亲水性。用TMHMM-2.0进行蛋白质序列的跨膜区分析,结果如图7所示,推测该蛋白质可能不具有跨膜区,主要是在膜外进行作用。信号肽分析表明该蛋白不具有信号肽。二级结构则主要是以α-螺旋和不规则盘绕为蛋白质最大量的结构原件。

图5 推导的氨基酸序列的保守区预测Fig.5 Search for conserved domains in deduced sequence of amino acid
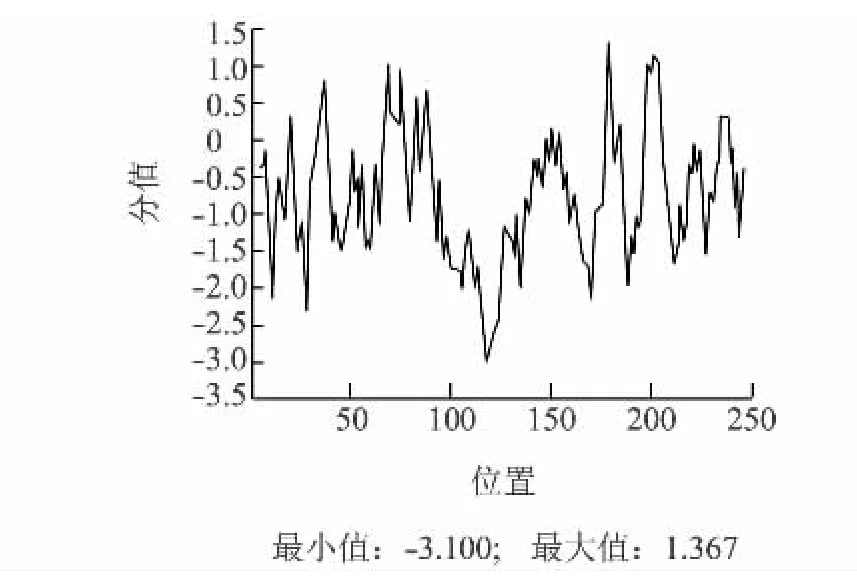
图6 蛋白疏水性分析Fig.6 Hydrophobicity profiles of the protein
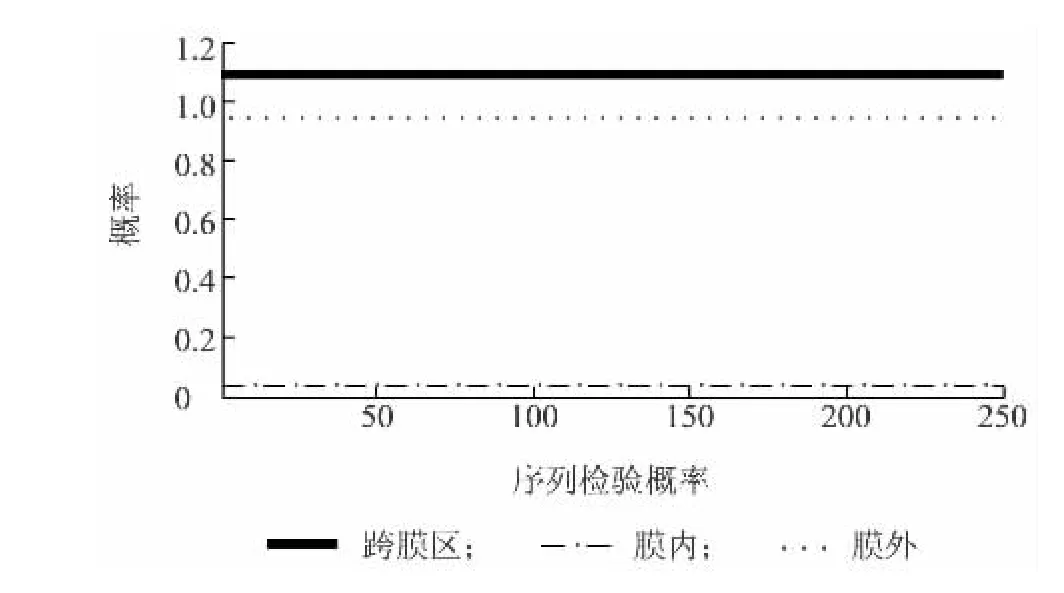
图7 跨膜区预测Fig.7 Prediction of transmembrane domain
用推导的氨基酸序列与蛋白质数据库中的调节基因的编码氨基酸序列进行同源性比较,结果见图8。其中,山葡萄氨基酸序列与欧亚种葡萄、葡萄杂交种、烟草、牵牛花、酸樱桃、杨梅、朝天椒和甜杏仁的氨基酸序列相似系数分别为97%、98%、55%、55%、53%、51%、45%和49%。
用MEGA 4软件对该基因及其他植物调节基因的氨基酸序列进行多序列比对,绘制分子进化树(图9)。结果表明,山葡萄转录因子MYBA3基因与同种属的欧亚种葡萄(V.vinifera)、葡萄杂交种(V.hybrida cultivar)转录因子的亲缘关系最近,与其他物种如杨梅(M.rubra)、朝天椒(C.annuum)、酸樱桃(P.cerasus)、烟草(N.tabacum)、甜杏仁(P.dulcis)的调节基因的亲缘关系很远。
3 讨论
以cDNA文库为信息来源,从中分离并克隆到山葡萄花色苷生物合成途径中的转录因子MYBA3基因,并对该基因的结构、蛋白质结构等进行了分析,结果表明,该基因cDNA全长序列为764 bp,编码250个氨基酸,与欧亚种葡萄(V.vinifera)相关基因的序列相似性达到了97%,与葡萄杂交种(V.hybrida)相似性达到了98%。氨基酸序列比对与进化树分析说明,MYBA3基因与欧亚种葡萄和葡萄杂交种MYBA3基因同源性较高。该基因不具有信号肽结构,而具有一定的亲水性,二级结构以α-螺旋和无规则卷曲为蛋白质最大量的结构元件。转录因子调节基因控制花色苷生物合成过程中相关结构基因的时空表达,影响花色苷生物合成的强度和模式[12]。MYB类转录因子是植物体内调节各种生理代谢反应的关键因子,具有高度保守的DNA结合区和MYB区,它们高度保守的DNA结合域使得利用PCR方法分离克隆MYB基因家族成员成为可能。MYB基因的分离克隆可以为研究者提供这类转录因子在转录水平对植物某些生理过程调控机制的相关信息[13]。MYB蛋白家族功能复杂多样,对MYB转录因子在植物生长发育及生理代谢中的调控机理的深入研究和解析,尚有赖于大量MYB转录因子基因及相关基因的克隆和表达分析的验证。

图8 MYBA3基因推导的氨基酸序列的多重比对Fig.8 Multiple alignment of the deduced amino acid sequences of MYBA3 gene

图9 由MYBA3基因推导的氨基酸构建的分子进化树Fig.9 Molecular phylogenetic tree of the deduced amino acid sequences of MYBA3 gene
[1]沈育杰,赵淑兰,杨义明,等.我国山葡萄种质资源研究与利用现状[J].特产研究,2006(3):53-57.
[2]刘闯萍,王 军.葡萄花色苷的生物合成[J].植物生理学通讯,2008,44(2):363-377.
[3]曹 鹏.转色期前后葡萄果实糖代谢相关酶的特性研究[D].杨凌:西北农林科技大学,2006.
[4]陈 俊,王宗阳.植物MYB类转录因子研究进展[J].植物生理与分子生物学学报,2002,28(2):81-88.
[5]KOBAYASHI S,GOTO-YAMAMOTO N,HIROCHIKA H.Retrotransposon-induced mutations in grape skin color[J].Science,2004,304:982.
[6]LIJAVETZKY D,RUIZ-GARCI'A L,CABEZAS J A.Molecular genetics of berry colour variation in table grape[J].Molecular Genetics and Genomics,2006,276:427-435.
[7]DELUC L,BARRIEU F,MARCHIVE C,et al.Characterization of a grapevine R2R3-MYB transcription factor that regulates the phenylpropanoid pathway[J].Plant Physiology,2006,140:499-511.
[8]DELUC L,BOGS J,WALKER A R,et al.The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries[J].Plant Physiology,2008,147:2041-2053.
[9]BOGS J,JAFFE'F W,TAKOS A M.The grapevine transcription factor VvMYBPA1 regulatesproanthocyanidin-proanthocyanidin synthesis during fruit development[J].Plant Physiol,2007,143:1347-1361.
[10]TERRIER N,TORREGROSA L,AGEORGES A.Ectopic expression of VvMybPA2 promotes proanthocyanidin biosynthesis in Vitis vinifera L.and suggests additional targets in the pathway[J].Plant Physiology,2009,149:1028-1041.
[11]MATUS J T,AQUEA F,ARCE-JOHNSON P.Analysis of the grape MYB R2R3 subfamily reveals expanded wine quality-related clades and conserved gene structure organization across Vitis and Arabidopsis genomes[J].BMC Plant Biology,2008,8:83-98.
[12]刘海峰.山葡萄花色苷生物合成相关结构基因克隆与表达[D].哈尔滨:东北林业大学,2010.
[13]王延玲,张艳敏,冯守迁,等.新疆红肉苹果转录因子MsMYB10基因的克隆、序列分析及原核表达[J].中国农业科学,2010,43(13):2735-2743.
