外源脯氨酸对盐胁迫下甜瓜幼苗生长、光合作用和光合荧光参数的影响
2013-08-22颜志明郭世荣
颜志明,孙 锦,郭世荣
(1.南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室,江苏 南京 210095;2.江苏农林职业技术学院,江苏 句容 212400)
世界约20%的耕地和50%左右的灌溉耕作土地受到了盐分的影响[1],所以盐分是影响作物产量的最重要的非生物因素[2]。盐分胁迫条件下,植物体内发生一系列生理生化反应,包括离子平衡、水势、矿质营养、气孔状况和光合效率等,这些反应导致植物生长速度减慢[3]。而盐分影响植物生长最重要的过程是影响植物的光合作用,在盐胁迫条件下,植物气孔关闭,胞间CO2浓度降低,光合作用下降[4]。
利用外源物质提高幼苗的抗盐性和改善植物的光合效率已经在许多植物上得到应用。外源一氧化氮(NO)可以提高盐胁迫条件下黄瓜[5]、黑麦草[6]、玉米[7]等植物叶片的净光合速率(Pn)。外源甜菜碱可以提高枸杞[8]和水稻[9]叶绿素荧光动力学参数Fv/Fm、Fv/Fo等指标。但国内外在外源脯氨酸对盐胁迫下植株光合作用影响方面的研究报道较少。本研究采用营养液栽培,通过外源脯氨酸处理盐胁迫下甜瓜(Cucumis melo L.)幼苗,研究外源脯氨酸对盐胁迫下2个耐盐性不同的甜瓜品种生长、光合作用和叶绿素荧光参数的影响,探讨外源脯氨酸缓解盐胁迫对植物伤害的生理机制。
1 材料与方法
1.1 材料培育与处理
以2个耐盐性不同的甜瓜品种玉皇(耐盐性强)和雪美(耐盐性弱)为材料。种子先用自来水冲洗3次,再用蒸馏水清洗3次,用蒸馏水浸泡10 h后,播种于双层滤纸铺设的培养皿内,置于28℃的恒温箱中催芽。取发芽一致的种子播种于72穴的穴盘中,蛭石作为播种基质。幼苗2片真叶时定植于装有25 L营养液的培养箱中进行培养,营养液采用霍格兰配方[pH 6.5±0.2,电导率(EC)(2.1±0.1)ds/m]。利用通气泵进行间歇通气,保持营养液中溶解氧含量为(8.0±0.2)mg/L。温室内空气最高温度为32℃,最低温度为17℃,相对湿度在70%左右。幼苗预培养5 d后,进行试验处理。设4个处理:(a)正常营养液培养(对照),1倍霍格兰营养液;(b)NaCl胁迫(NaCl),1倍霍格兰营养液+100 mmol/L氯化钠;(c)脯氨酸处理(脯氨酸),1倍霍格兰营养液+0.2 mmol/L脯氨酸;(d)NaCl胁迫+脯氨酸处理(NaCl+脯氨酸),1倍霍格兰营养液+0.2 mmol/L脯氨酸+100 mmol/L氯化钠。每个处理18株苗,3次重复,营养液每2 d更换1次。处理5 d后测定各指标。试验结果均采用SAS软件Duncan’s多重比较法进行统计分析。
1.2 测定方法
1.2.1 鲜质量和干质量测定 植株先用自来水冲洗2~3次,再用蒸馏水冲洗2次。用吸水纸吸干后称鲜质量,然后105℃杀青15 min,75℃烘干至恒重,称干质量。
1.2.2 叶绿素含量的测定 参照Strain等[10]的方法并加以改进。取甜瓜植物生长点下第2片展开真叶,用剪刀剪碎,混合取样1 g,用90%丙酮提取。提取液在663 nm和645 nm下测定吸光值,计算叶绿素含量,叶绿素a含量(mg/ml)=11.64×A663-2.16×A645,叶绿素b含量(mg/ml)=20.97×A645-3.94×A663。
1.2.3 光合参数的测定 光合参数测定使用便携式光合分析系统(Li-6400,Li-Cor Inc,USA)于9∶00~11∶00进行。测定时叶室温度控制在(25±1)℃,光照度控制在 800 μmol/(m2·s),参比室CO2浓度为(380±10)μmol/L,相对湿度(RH)为60%~70%。测量净光合速率(Pn)、气孔导度(Gs)、胞间 CO2浓度(Ci),利用公式 WUE=Pn/Tr计算得水分利用率(WUE),蒸腾速率(Tr)由光合分析系统测得。
1.2.4 荧光参数的测定 荧光参数采用PAM-2100型脉冲调制式荧光仪(德国WALZ公司产品)进行测定。叶片经过30 min暗适应后,照射测量光,得到原初荧光(Fo),随后给一个饱和脉冲光[8000 μmol/(m2·s)]后关闭,得到暗适应最大荧光(Fm)。打开作用光,待叶片光合作用达到稳态后得到光合稳态荧光(Fs)并记录;打开饱和脉冲光[8000 μmol/(m2·s),0.8 s]得到光化学作用下最大荧光Fm',然后关闭作用光,立即打开远红光,约3 s后关闭,得到光适应叶片的最小荧光Fo'[11-12]。测量光化学淬灭系数(qP)、非光化学淬灭(qN)和初始荧光(Fo);利用张守仁[13]的方法计算光系统II(PSⅡ)最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)。
2 结果与分析
2.1 外源脯氨酸对盐胁迫下甜瓜幼苗生长的影响
处理5 d后,两个品种甜瓜的生长均受到了显著的抑制,与对照相比,玉皇和雪美的鲜重分别下降了26.8%和38.1%,干重分别下降了21.3%和34.5%(图1),表明100 mmol/L NaCl处理对甜瓜雪美的生长抑制程度大于玉皇。NaCl胁迫下添加脯氨酸,均提高了两个品种甜瓜的鲜重和干重,其中雪美甜瓜增加效果较玉皇显著(P<0.05)。

图1 外源脯氨酸对氯化钠胁迫下甜瓜幼苗鲜质量和干质量的影响Fig.1 Effects of exogenous proline on fresh weight and dry weight of melon seedlings under salt stress
2.2 外源脯氨酸对盐胁迫甜瓜幼苗叶片光合色素含量的影响
由表1可知,处理5 d后,玉皇甜瓜叶片叶绿素a、b和总叶绿素含量与对照相比分别下降了11.9%、12.5%和12.1%;雪美甜瓜叶片叶绿素a、b和总叶绿素含量与对照相比分别下降了31.4%、20.8%和27.6%,下降幅度均达到显著水平。由此可以看出,100 mmol/L NaCl胁迫显著降低了甜瓜幼苗叶片的叶绿素含量,且对雪美的降低幅度大于玉皇。盐胁迫下添加脯氨酸,玉皇甜瓜幼苗叶片叶绿素a和总叶绿素含量较盐胁迫下增加不显著,而叶绿素b显著增加;雪美甜瓜幼苗叶片叶绿素a、b和总叶绿素含量较盐胁迫处理显著增加,并且增加的幅度大于玉皇。上述结果表明,外源脯氨酸可抑制盐胁迫下甜瓜幼苗叶片叶绿素含量的下降,并且对雪美的抑制效果大于玉皇。
2.3 外源脯氨酸对盐胁迫甜瓜幼苗叶片光合参数的影响
盐胁迫降低了玉皇甜瓜的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)(图2),对水分利用率(WUE)利用率影响不大;盐胁迫降低了雪美甜瓜的 Pn、Gs和 WUE,提高了 Ci。盐胁迫下施用外源脯氨酸处理显著提高了2个甜瓜品种叶片Pn,提高了雪美甜瓜叶片内的 Gs和 WUE,降低了Ci,而对玉皇甜瓜的 Gs、Ci和 WUE影响效果不显著(P>0.05)。
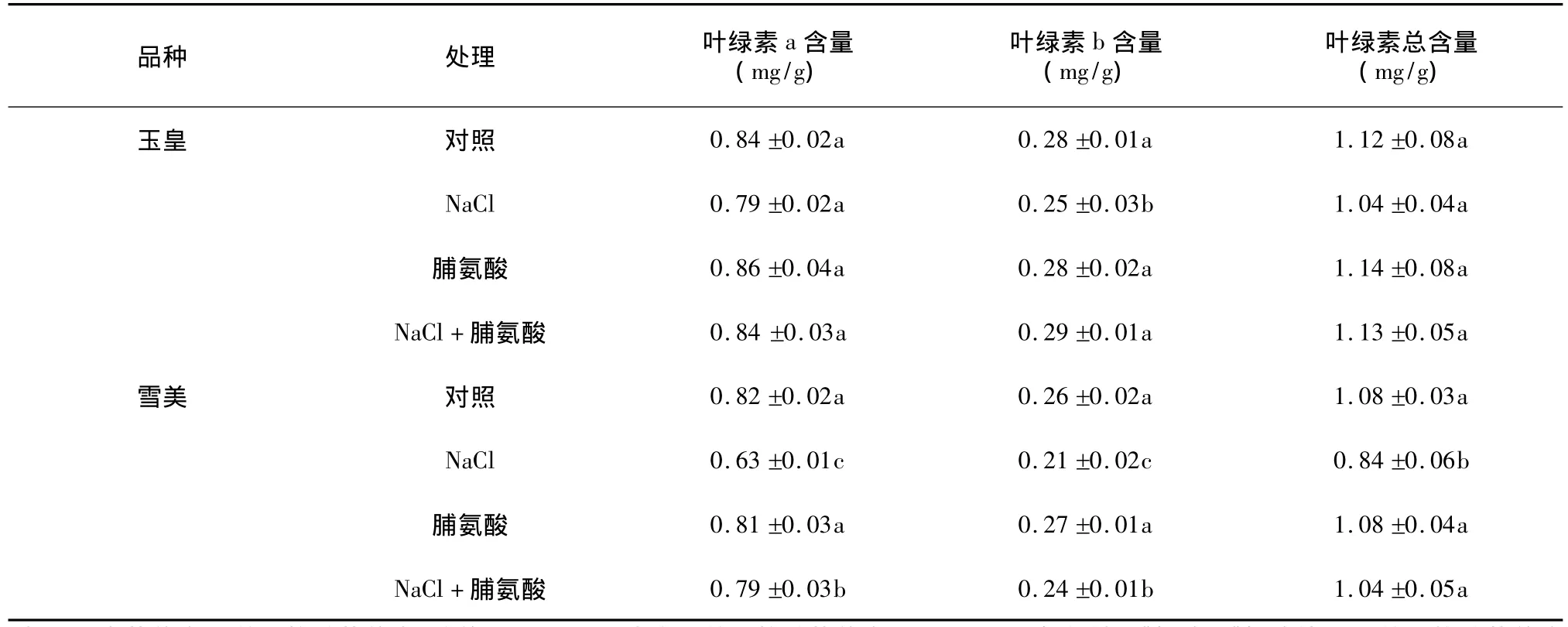
表1 外源脯氨酸对盐胁迫下甜瓜幼苗叶片叶绿素含量的影响Table 1 Effects of exogenous proline on content of chlorophyll in melon seedlings under salt stress

图2 外源脯氨酸对盐胁迫下甜瓜幼苗叶片光合气体交换参数的影响Fig.2 Effect of proline on photosynthetic gas exchange in the leaves of melon seedlings under salt stress
2.4 外源脯氨酸对盐胁迫甜瓜幼苗叶片叶绿素荧光参数的影响
由表2可知,盐胁迫显著降低了雪美PSⅡ实际效率(ΦPSⅡ)和光化学淬灭系数(qP),提高了初始荧光(Fo);外源施用脯氨酸提高了ΦPSⅡ和 qP,降低了 Fo。盐胁迫下玉皇的ΦPSⅡ、qN、qP 和 Fo没有发生显著变化,盐胁迫下外源施用脯氨酸提高了 ΦPSⅡ。从表2还可知,盐胁迫下2个甜瓜品种的PSⅡ最大潜在光化学效率(Fv/Fm)都没有发生显著变化,盐胁迫下外源施用脯氨酸后2个品种的Fv/Fm也没有发生显著变化。
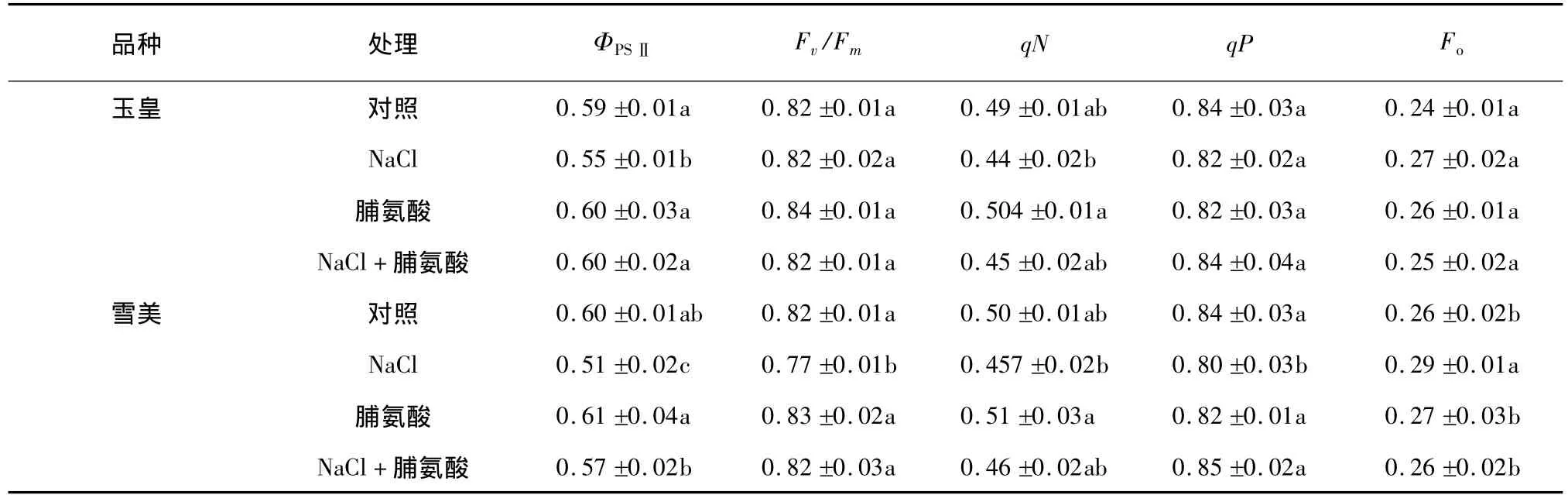
表2 外源脯氨酸对盐胁迫下甜瓜幼苗叶片叶绿素荧光参数的影响Table 2 Effects of exogenous proline on chlorophyll fluorescence parameters in melon seedlings under salt stress
3 讨论
叶片中光合色素参与光合作用过程中光能的吸收、传递和转化,植物光能利用的能力和效率直接受光合色素含量的影响[14],而光合性能的好坏最终将影响植物的生长[15]。在自然界中,许多逆境条件(如高温、干旱、盐分胁迫等)可以引发植物体内各种生理生化反应,直接或间接地影响着植物的叶绿素含量和植物的光合能力。许多研究结果表明,盐胁迫降低了葡萄[16]、番茄[17]、水稻[18]、黄瓜[19]等多种植物的叶绿素含量和净光合速率(Pn)。王清等[20]的研究结果表明,外源脯氨酸提高了盐胁迫下马铃薯试管苗的叶绿素含量,缓解了盐胁迫伤害;刘书仁等[21]利用外源脯氨酸提高了高温胁迫下黄瓜幼苗的Pn,缓解了高温胁迫对黄瓜幼苗的伤害。在本试验中,100 mmol/L NaCl胁迫显著降低了2个品种甜瓜幼苗叶片叶绿素a、叶绿素b和总叶绿素含量,但是下降的程度不同,耐盐性强的甜瓜品种下降的幅度要小。这可能是由于盐胁迫下植物体中叶绿素酶的活性增强,促进了叶绿素的降解而导致植物叶片叶绿素含量降低[22-23],也可能与盐胁迫抑制了植物体对营养的吸收,破坏了植物体正常的生理代谢,降低了植物光合能力有关。盐胁迫下添加0.2 mmol/L脯氨酸显著地提高了2个甜瓜品种的总叶绿素含量,提高了品种雪美的Pn,而在正常营养液条件下添加脯氨酸对甜瓜幼苗叶片叶绿素a、叶绿素b、总叶绿素含量和Pn没有显著影响,因此,可以推断,外源脯氨酸具备保护逆境条件下植株叶片叶绿素的功能,抑制甜瓜幼苗光合作用的下降,缓解盐胁迫对甜瓜幼苗生长的抑制作用。但是,脯氨酸应用效果会因植物的基因型不同而有差异。
一般认为,逆境条件引起植物光合速率的改变主要是由气孔因素和非气孔因素两个条件所决定的,其判定主要依据是胞间CO2浓度(Ci)和气孔导度(Gs)的变化。Farquhar等[24]认为,在 Ci和 Gs同时下降的情况下,才能证明气孔因素是引起光合速率下降的主要原因;如果Gs下降,而Ci维持不变甚至上升,则说明叶肉细胞同化能力降低等非气孔因素是引起光合速率下降的主要原因。本试验中,盐胁迫显著降低了甜瓜幼苗的气孔导度(Gs)和胞间CO2浓度(Ci),这表明盐胁迫下甜瓜光合速率的下降是由于气孔因素引起的,这与试验中观察到盐胁迫显著降低了甜瓜幼苗叶片净光合速率相一致;外源脯氨酸显著增加了盐胁迫下甜瓜幼苗的气孔导度、胞间CO2浓度和水分利用率,提高了植株的净光合速率。
叶绿素荧光动力学技术是探测逆境对植物光合作用影响的理想方法,PSⅠⅠ的最大光化学效率(Fv/Fm)是暗适应样品光系统的最大量子产量,反映PSⅠⅠ反应中心光能转化效率;ΦPSⅡ反映PSⅠⅠ反应中心在部分关闭情况下的实际原初光化学效率[21]。本试验结果表明,盐胁迫下,雪美甜瓜ΦPSⅡ和qP均下降,这表明盐胁迫使甜瓜同化CO2能力下降,盐胁迫下外源施用脯氨酸处理则有效地提高了雪美甜瓜的ΦPSⅡ和qP。说明脯氨酸可以增加PSⅡ反应中心的开放比例、氧化态QA比例和光下光能最大捕获效率[13],增加光合电子传递效率,增强盐胁迫下甜瓜幼苗的Pn,表明外源施加脯氨酸可以通过改变PSⅡ的运转效率来提高植物的光合作用。但外源脯氨酸对玉皇甜瓜的作用不明显,这可能是由于两个甜瓜品种耐盐性不同造成的。
综上所述,外源脯氨酸可以抑制盐胁迫下甜瓜幼苗叶绿素含量的下降,改善盐胁迫下甜瓜的光合作用,缓解盐胁迫对甜瓜幼苗的伤害。
[1]ZHU J K.Plant salt tolerance[J].Trends Plant Sci,2001,2:66-71.
[2]MUNNS R.Comparative physiology of salt and water stress[J].Plant Cell Environ,2002,25:239-250.
[3]MUNNS R.Physiological processes limiting plant growth in saline soils:some dogmas and hypotheses[J].Plant Cell Environ,1993,16:15-24.
[4]MISRA A N,SAHU S M,MISRA M,et al.Sodium chloride induced changes in leaf growth,and pigment and protein contents in two rice cultivars[J].Biol Plant,1997,39:257-262.
[5]樊怀福,郭世荣,焦彦生,等.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J].生态学报,2007,27(2):546-553.
[6]刘建新,胡浩斌,王 鑫.外源对盐胁迫下黑麦草幼苗活性氧代谢、多胺含量和光合作用的影响[J].植物研究,2009,29(3):313-315.
[7]车永梅,唐 静,陈 康,等.一氧化氮对盐胁迫下玉米幼苗叶绿素荧光参数和光合特性的影响[J].玉米科学,2009,17(3):91-94.
[8]惠红霞,许 兴,李前荣.外源甜菜碱对盐胁迫下枸杞光合功能的改善[J].西北植物学报,2003,23(12):2137-2142.
[9]赵 华,曹云英,周 蓉,等.外源甜菜碱对盐胁迫下水稻幼苗光合功能的改善[J].华北农学报,2006,21(6):72-74.
[10]STRAIN H H,SVEC W A.Extraction,separation,estimation and isolation of chlorophylls[M]//Vernon L P,Seely G R.The chlorophylls.NY:Academic Press,1966:21-66.
[11]YANG X H,LU C M.Photosynthesis is improved by exogenous glycine betaine in salt-stressed maize plants[J].Physiologia Plantarum,2005,124:343-352.
[12]李 军,高新昊,郭世荣,等.外源亚精胺对盐胁迫下黄瓜幼苗光合作用的影响[J].生态学杂志,2007,26(10):1595-1598.
[13]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
[14]姜卫兵,高光林,俞开锦,等.水分胁迫对果树光合作用及同化代谢的影响研究进展[J].果树学报,2002,19(6):416-420.
[15]CHEESEMAN J M.Mechanism of salinity tolerance in plants[J].Plant Physiology,1988,87:547-550.
[16]房玉林,惠竹梅,高邦牢,等.盐胁迫下葡萄光合特性的研究[J].土壤通报,2006,37(5):881-884.
[17]吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl胁迫下番茄幼苗生长和光合作用的影响[J].西北植物学报,2006,26(6):1206-1211.
[18]朱晓军,杨劲松,梁永超,等.盐胁迫下钙对水稻幼苗光合作用及相关生理特性的影响[J].中国农业科学,2004,37(10):1497-1503.
[19]张润花,郭世荣,段增强.外源腐胺对盐胁迫黄瓜幼苗生长、光合及膜脂过氧化的影响[J].江苏农业学报,2011,27(4):836-841.
[20]王 清,黄惠英,张 金,等.外源硅及脯氨酸对盐胁迫下马铃薯试管苗的影响[J].中国蔬菜,2005(9):16-18.
[21]刘书仁,郭世荣,孙 锦,等.脯氨酸对高温胁迫下黄瓜幼苗活性氧代谢和渗调物质含量的影响[J].西北农业学报,2010,19(4):127-131.
[22]YEO A.Molecular biology of salt tolerance in the context of wholeplant physiology[J].Journal of Experimental Botany,1998,49:915-929.
[23]张其德.盐胁迫对植物及其光合作用的影响[J].植物杂志,2000(1):28-29.
[24]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
