辣椒花药培养影响因素的研究
2013-08-09龚明霞何铁光董文斌赵坤王益奎王日升康德贤
龚明霞 ,何铁光 ,2,董文斌 ,赵坤 ,王益奎 ,王日升 ,康德贤
(1.广西农业科学院蔬菜研究所,南宁,530007;2.广西农业科学院农业资源与环境研究所)
辣椒(Capsicum annuum L.)是一种重要的蔬菜作物和调味品,在中国种植面积已超过130万hm2,位列世界之首。花药培养是人工产生单倍体的关键技术,通过花药培养单倍体途径加速亲本纯系的选育,提高亲本优异基因的聚合是目前辣椒育种的重要途径之一。辣椒花药培养研究开始较早[1,2],国内外学者从培养基[3]、小孢子发育时期[5]、活性炭[6]、温光培养条件[7]等方面做过研究。花药培养技术虽有许多优势,但目前辣椒花药培养还有大量的具体问题需要探索,如辣椒花药培养胚状体的诱导效果随基因型的不同而存在很大差异,在实际应用中,需要对有价值的不同基因型的辣椒材料进行研究,以提高辣椒单倍体的诱导效率。本研究以不同果型和不同基因型的优良辣椒杂交F1代、优良辣椒品系花药为材料,研究其胚状体和愈伤组织诱导及继代生长的影响因素,以提高不同果型辣椒花药培养的出胚率、出愈率和愈伤组织的质量,推动这几个优良辣椒品系的花药培养在辣椒育种方面的应用。
1 材料与方法
1.1 试验材料
供试材料有杂交种F1代植株花药,分别为Fk(M)×Fk(F)、Fk(F)×Fk(M)、1-8-3×1-8-8、HX-1×TW-1,另外2个基因型材料为1个不育系A和1个保持系B(A、B均由中国热带农业科学院热带作物品种资源研究所提供)。
1.2 试验方法
①材料种植和采样方法 2010年8月中旬浸种催芽,在塑料育苗盘中育苗,9月中旬移栽辣椒苗定植于大棚中,11月下旬开始采样。采集萼瓣一致,长约3 mm的幼蕾,每株选取2~3个,采下后装入自封口塑料袋,随即放入装有冰块的泡沫箱中,然后带回实验室,放入4℃的冰箱进行低温预处理7 d。
②接种方法 接种当天,从冰箱中拿出花蕾材料,在室温中放置约1 h。然后于超净工作台上,先用75%酒精浸泡消毒约30 s后,用无菌水清洗1次,再用加有2~3滴吐温-80的0.1%HgCl2溶液浸泡消毒8~9 min,每2 min晃动一次使之与消毒液充分接触,最后用无菌水浸洗4~5次,倾倒无菌水,用镊子夹出,放在无菌滤纸上吸干水分后,剥出花药,接种至培养基上。
③培养方法 接种完毕后,将培养瓶放置培养箱中进行黑暗培养10 d,培养温度为30℃,再从培养箱中取出置光暗交替条件下培养,16 h光照/8 h黑暗,温度为(28±1)℃。
1.3 数据分析
接种 15 d后统计并剔除有污染的花药培养瓶,期间观察和记录愈伤组织诱导和生长状况,接种40 d后统计辣椒花药褐化数、胚状体和愈伤组织诱导情况,并计算花药污染率、褐化率及愈伤组织诱导率。
计算公式如下:污染率(%)=(污染花药数/接种花药总数)×100%;褐化率(%)=(花药褐化数/无污染花药总数)×100%;出胚率(%)=(诱导出胚状体的花药数/无污染花数总数)×100%;愈伤组织诱导率 (%)=(愈伤组织发生数/无污染花药总数)×100%。
2 结果与分析
2.1 不同基因型辣椒花蕾的消毒效果比较
将不同基因型的辣椒花蕾用同一种方法进行消毒处理,接种后的部分花药在2~3 d后污染,但因基因型的不同受污染的情况有差异(表1)。6个辣椒品种中有一半未受污染,其中2个品种的污染率较低,最高的污染率为23.08%,这说明采用此消毒方法效果较好。另外说明在秋冬季采取辣椒的花蕾比较容易消毒。
2.2 基因型对辣椒花药愈伤组织和胚状体诱导的影响
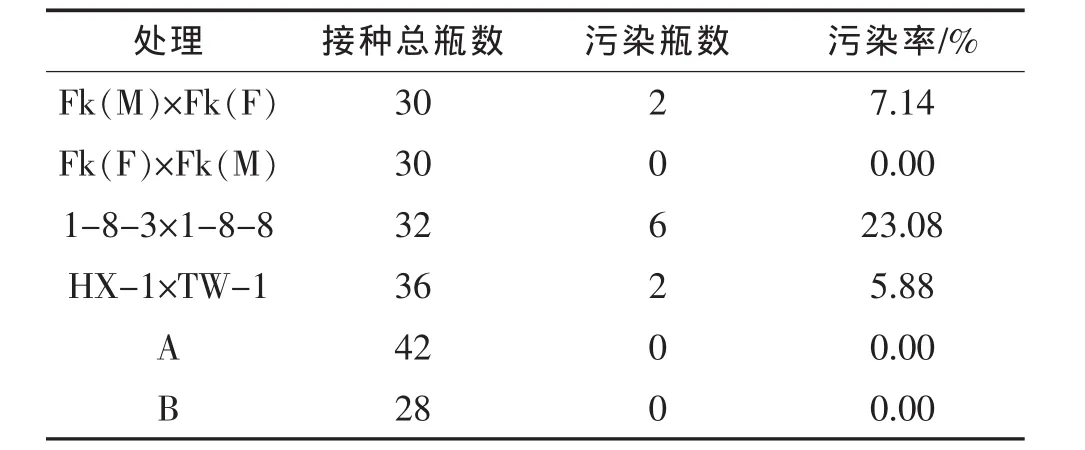
表1 不同基因型辣椒花药消毒效果比较
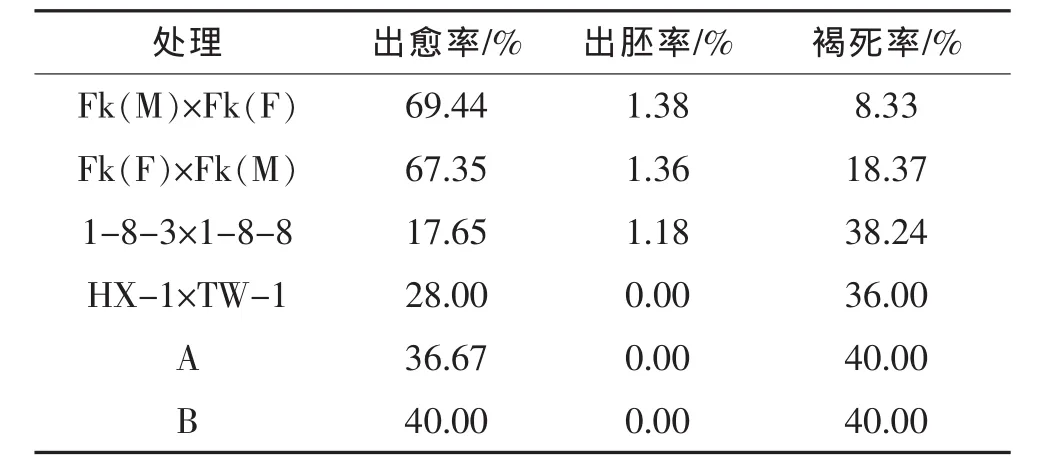
表2 基因型对辣椒花药愈伤组织和胚状体诱导的影响
将辣椒的花药接种至培养基10 d后,大部分花药在培养基上呈黄白色或黄绿色,没有发生褐变,且能够膨大生长,只有少数花药完全变成黑褐色死亡状;接种35 d后有些品种有很少量的胚状体形成;接种40 d后,大部分膨大生长的花药都能够形成白色愈伤组织,大部分的愈伤组织质地致密,表面有毛状物,少数较疏松,个别松散为颗粒透明状,而有些花药既没有形成愈伤组织,也不分化出胚状体,只是膨大生长,花药表面呈绿色。从表2中可以看出,不同果型的辣椒花药培养时胚状体的诱导率不同,大果型的 Fk(M)×Fk(F)和 Fk(F)×Fk(M)杂交的F1代植株花药胚状体诱导率最高,为1.38%,小果型的HX-1×TW-1杂交的F1代植株花药不能诱导出胚状体;辣椒花药出愈率因基因型不同而有差异,Fk(M)×Fk(F)的 F1代植株花药出愈率最高,比最低的高51.79个百分点;不同基因型辣椒花药的死亡率不同,最高的死亡率为40.00%,比最低的高31.67个百分点。
2.3 接种量对辣椒花药出胚率和出愈率的影响
研究了每瓶接种的花药数量对胚状体和愈伤组织形成的影响。结果表明(表3),培养瓶中花药接种量越大,出愈率越高,死亡率越低,但出胚率差异不明显。如对于HX-1×TW-1的F1代植株花药,每瓶接种2个花蕾的花药比1个的出愈率高13.24个百分点,但对于其他4个品种来说,接种量导致的出愈率变幅为0.77~24.19个百分点,可见接种量对辣椒花药愈伤形成的影响因品种而异。另一方面,接种量不同所引起的花药死亡率变幅为2.79~13.32个百分点,这种差异因品种而异,如对于HX-1×TW-1的F1代植株花药来说,接种量增大后死亡率降低了13.32个百分点。
2.4 基因型和接种量对愈伤组织继代培养的影响
为了探明辣椒花药愈伤组织在继代培养过程中能否继续分化出胚状体,研究了基因型和接种量对愈伤组织继代培养的影响。转接40 d后统计结果发现,辣椒花药愈伤组织在继代培养中容易变褐并逐渐死亡。从表4可知,每瓶接种量对辣椒花药愈伤组织继代培养的影响因品种而异,有的表现出接种量多成活率高,如 Fk(F)×Fk(M)的 F1代植株的花药愈伤,接种量为每瓶10块的比6块的成活率高20.91个百分点;有些表现出接种量少成活率高,如不育系A植株的花药愈伤,每瓶接种6块的比10块的成活率高26.28个百分点。但所有成活的愈伤组织继代培养1次,均不能够分化出胚状体,说明从愈伤组织中分化出胚状体比较困难。
3 小结与讨论
辣椒花药培养首先要对花蕾表面进行消毒,试验中由于消毒不严格,有时材料会全部受到污染,所以材料消毒是关系到花药培养成败的第一个关键技术问题。本试验所采用的辣椒花蕾消毒方法效果较好,一半材料未受到污染。这不仅与材料的预处理有关,还与材料的选择及消毒技术有关。
供体植株基因型是影响花药培养的关键因素。本研究表明,辣椒花药胚状体诱导受基因型和果型的影响较大,这与前人的研究结果一致[8,9]。陈晓等[6]的研究中,43个辣椒供体基因型中胚状体诱导率为0~18%。Mitykó等[10]报道,辣椒基因型不同诱导率不同,最高可达到178.2%,最低只有1.0%,小果和和中果基因型的花粉植株诱导率较低或为0。Dolcet-Sanjuan等[11]的研究结果表明,随辣椒果型逐渐变小,孤雄生殖的诱导能力逐渐降低。
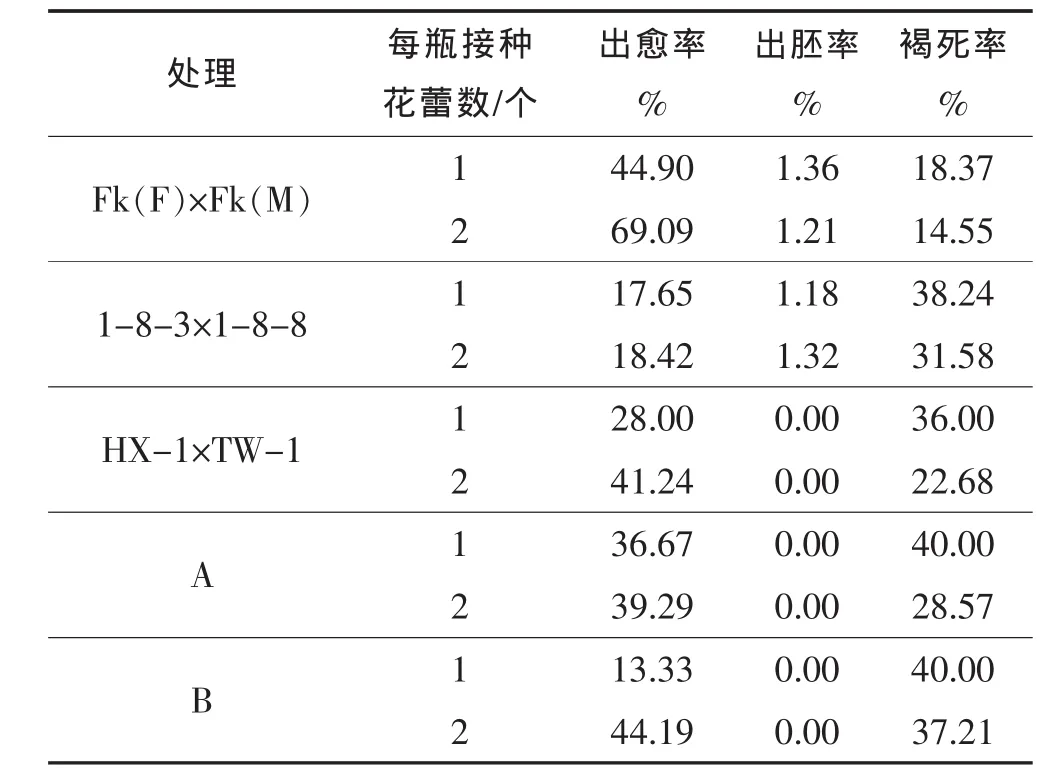
表3 接种量对辣椒花药出愈率和出胚率的影响

表4 基因型和接种量对愈伤组织继代培养的影响
辣椒花药培养的胚状体诱导率差异大。本研究从6份基因型中筛选出3份适合花药培养的基因型;但胚状体诱导率均较低,与所报道的较高的诱导率悬殊很大[10],后继工作中尚需从培养基、激素、培养条件等方面进行优化,以提高出胚率。有学者认为辣椒植株小孢子雄核发生能力依赖于不同基因型的遗传特异性可能与B型花粉粒的比例有关,B型花粉粒是具有雄性发育潜力的花粉,活体内B型花粉粒的频率在不同品种的不同花药间有差异,与花药愈伤组织的诱导和植株的再生密切相关[12],因此,需从分子生物学角度深入探讨辣椒花药培养中雄核发育和胚状体形成的发育机理。
关于花药接种密度的问题研究较少,本研究结果表明,接种密度影响辣椒花药出愈率,但对出胚率几乎无影响。这一结果与李春玲等[13]的研究结果不同,即增加花药在培养基上的接种密度,能明显提高甜椒胚状体的诱导频率。另外,本试验中辣椒花药培养易形成愈伤组织,但这些初代形成的愈伤组织在继代培养中易褐化死亡,而且均不能在继续培养的第一代中分化出胚状体,对其是否在以后的多代培养中分化出胚状体或不定芽还有待进一步研究。
[1]郭仲琛,李春玲,蒋中仁.甜椒花药培养的初步研究[J].园艺学报,1980,7(1):34-38.
[2]George L,Narayanaswamy S.HaploidCapsicumthrough experimental androgenesis[J].Protoplasma,1973,78:467-470.
[3]Yoon Y J,Lee K S,Chang S K.Plant induction by anther culture of hot pepper(Capsicum annuumL.)[J].Journal of the Korean Society for Horticultural Science,1991,32:8-16.
[4]赵激,邹学校,张竹青,等.不同培养基对辣椒花药培养的影响 [J].湖南农业大学学报:自然科学版,2010,36(2):181-185.
[5]Mitykó J,Fári M.Problems and results of doubled haploid plant production in pepper (Capsicum annuumL.)via anther and microspore culture[J].Acta Hort,2001,122:281-287.
[6]陈晓,詹玉丝,徐小利,等.花药培养建立辣椒 DH纯系的初步研究[J].河南农业科学,2003(9):52-55.
[7]刘广霞,张晓伟,蒋武生,等.温度及培养基中添加物对辣椒花药培养胚状体诱导的影响 [J].河南农业科学,2009(5):97-100.
[8]张馨宇,王永成,刘爱群,等.辣椒花药培养研究新进展[J].中国农学通报,2007,23(8):331-334.
[9]杨博智,周书栋,张竹青,等.不同培养基和激素对辣椒花药培养的影响[J].湖南农业大学学报:自然科学版,2009,35(1):61-64.
[10]Mitykó J,Andrásfalvy A,Csilléry G,et al.Anther culture response in different genotypes and F1hybrids of pepper(Capsicum annuumL.)[J].Plant Breeding,1995,114:78-80.
[11]Dolcet-Sanjuan R,Claveria E,Huerta A.Androgenesis in Capsicum annuumL.——Effects of carbohydrate and carbon dioxide enrichment[J].J Amer Soc Hort Sci,1997,122(4):468-475.
[12]黄璐,卫志明.不同基因型玉米的再生能力和胚性与非胚性愈伤组织 DNA的差异[J].植物生理学报,1999,25(4):333-338.
[13]李春玲,蒋仲仁.对甜椒花药培养中一些影响因素的研究[J].中国蔬菜,1983(2):35-37.
