不同质量浓度磁性c-erbB-2反义探针对SK-Br-3肿瘤细胞株形态及表达的影响
2013-08-09刘海燕温志鹏贺海容谭书德李少林
刘海燕,温志鹏,文 明,贺海容,谭书德,李少林
重庆医科大学附属第一医院放射科,重庆 400016
恶性肿瘤是导致人类死亡的主要疾病,在许多国家位列居民死因的第一或第二位,这是由于目前仍然缺乏针对肿瘤的早期特异性诊断、转移预警、疗效预测及有效治疗的临床方法。分子影像学能够在解剖形态基础上更为深入地揭示组织的生物特点,发现早期的分子变异及病理改变过程,无创、可重复地提供组织定量、定时、可视化的分子及基因信息,因此可望实现肿瘤基因水平的特异性诊断[1-2]。在分子影像学研究中,制备特异性高、亲和力好的探针,是实现活体成像的关键因素[3]。借鉴分子生物学中的反义基因技术,本课题组在成功制备超顺磁性氧化铁 (superparamagnetic iron oxide,SPIO)标记的c-erbB-2癌基因反义寡脱氧核苷酸 (anti-senseoligodeoxynucleotides,ASODN)探针基础上 (即磁性c-erbB-2反义探针)[4-5],将该探针用于体外转染高表达c-erbB-2癌基因的SK-Br-3肿瘤细胞株,初步发现其同时具有诊断与治疗的功能[6]。为了进一步验证该探针的特性,本研究通过采用不同质量浓度探针转染SK-Br-3细胞株,观察其对细胞形态及表达的影响,以期寻找出最佳的探针转染浓度。
材料和方法
主要材料及仪器 磁性c-erbB-2反义探针系本课题组制备[4-5]并获得国家发明专利授权 (专利号ZL 200710092512.5),SK-Br-3肿瘤细胞株 (中国科学院上海细胞库),细胞培养基RPMI-1640、胰蛋白酶、胎牛血清 (美国 Hyclone公司),亚铁氰化钾(上海生物工程有限公司),核固红 (武汉博士德公司),CCK-8试剂盒 (凯基生物),鼠抗人c-erbB-2抗体(Invitogen公司),Actin抗体、辣根标记的抗鼠二抗、细胞裂解液、PVDF膜、聚丙烯酰胺等Western blot相关试剂 (碧云天生物技术研究所),透射电镜 (HITACHI7500型,日立公司),原子吸收光谱仪 (Z-5000型,日立公司),1.5T超导型MR成像仪 (美国GE公司)。
细胞转染条件 SK-Br-3肿瘤细胞株于含10%(体积分数)胎牛血清的RPMI-1640培养液中常规培养,选择处于对数生长期的细胞用于转染实验。根据预实验,将反义探针用含10%胎牛血清的RPMI-1640培养液稀释,制成含铁终质量浓度分别为5、10、25、50、100 mg/L的标记培养液,室温下标记SK-Br-3肿瘤细胞,置于5%(体积分数)CO2培养箱中孵育24 h。
反义探针转染效率检测
普鲁士蓝染色:取1块15孔板预先放有细胞爬片的24孔板,每孔加入1 ml细胞悬液 (细胞数目1×104/ml),将培养板放入5%CO2培养箱中培养12 h后,弃去原培养液,各孔依次加入1 ml标记培养液,共5个质量浓度组,每个组做3个复孔,培养板放入5%CO2培养箱孵育24 h后取出。各组采用4%(体积分数)多聚甲醛固定40 min,PBS液洗涤5 min×3次,在2%(质量分数)亚铁氰化钾+等量2%(体积分数)盐酸水溶液中孵育30 min,PBS液洗涤5 min×3次,核固红复染5 min,PBS液洗涤5 min×3次,晾干,二甲苯透明处理10 min后封片,光镜下随机对各个样本分别选取3个高倍视野照相。
细胞铁含量测定:采用原子吸收光谱法。取各组细胞重悬于1 ml培养基中 (细胞数目为1×103/ml),用2 ml/L的酸液 (高氯酸与硝酸按体积比3∶1混合)消化,去离子水溶解,60℃加热3 h,弃上清液后每组取3个样品放置于原子吸收光谱仪自动吸管内,在建立各种质量浓度的铁标准校对曲线后,测定并分析各组细胞的平均铁含量。
透射电镜检测:各组细胞(2×106/ml)用0.25%(质量分数)胰蛋白酶消化制成细胞悬液,800 r/min离心5 min后转入1.5 ml EP管中,1200 r/min离心10 min,吸净上清液,沿管壁缓慢加入2.5%(体积分数)戊二醛溶液,4℃固定1 h,1000 r/min离心5 min,弃固定液,1%(体积分数)锇酸固定1 h,梯度丙酮脱水,环氧树脂包埋,切片,透射电镜下观察。
细胞活性检测
台盼蓝排除实验:取各组对数生长期的细胞 (1×105/ml)悬液5 μl,与5 μl 0.4%(质量分数)台盼蓝溶液混合1 min,之后滴入细胞计数板,显微镜下计数100个细胞。细胞活力 (台盼蓝拒染率)=染色阴性细胞数/100个细胞×100%,每组测定3个样品。
CCK-8实验:取96孔板1块,加入细胞100 μl/孔(约1.5×103个),置37℃、5%CO2细胞培养箱中培养12 h,加入不同质量浓度的5组反义探针,每组设3个复孔,将96孔板在37℃、含5%CO2及100%湿度的细胞培养箱中孵育24 h后,向每孔中加入10 μl的CCK-8试剂,37℃下孵育2 h后,在酶标仪上450 nm波长处读取每孔的光密度值 (D)。各组分别设立各自的空白对照 (完全培养基、无细胞)及细胞对照 (无探针转染的细胞),计算各重复孔的D值(均数±标准差),细胞存活率%= [(加药细胞D-空白对照D)/(对照细胞D-空白对照D)]×100%。
c-erbB-2蛋白表达检测:分别收集各组细胞 (1×106/ml),0.01 mol/L PBS洗2次,加入细胞裂解液,冰上提取胞浆蛋白,用酶标仪检测蛋白质浓度,100℃煮样10 min,SDS-PAGE凝胶电泳,用6%浓缩胶、10%分离胶100 V、30 min,再130 V、90 min,然后350 mA、150 min恒流转膜至PVDF膜上,以Actin蛋白作为内参蛋白,将膜移至含有5% (质量分数)脱脂牛奶封闭液中室温摇动4 h,1×TBST洗涤,加抗人c-erbB-2蛋白抗体 (体积比1∶200)、Actin(体积比1∶1000)抗体,4℃孵育过夜,1×TBST洗涤3次,5 min/次,加入辣根过氧化物酶标记的二抗(体积比 1∶5000、1∶1500),37℃ 孵育 1 h,1 × TBST洗涤3次,5 min/次,用化学增强发光剂ECL显影、定影、晾干后扫描,图像处理系统分析目标带。
细胞MR成像:设未加探针的SK-Br-3细胞组为对照组,将各组细胞 (5×105/ml)分别包埋于0.5 ml 0.3%琼脂糖的EP管中,冷却凝胶形成后,固定EP管,采用1.5T超导型MR成像仪 (美国GE公司)横断位扫描。扫描参数为:GRE T2*WI序列,腕关节线圈,翻转角30°,TR/TE 225/5.3 ms,视野16.0 mm,层厚1.8 cm,矩阵256×128。T2*值为画定每个试管图像中央T2*值3次的平均值。
统计学处理 采用SPSS 18.0统计软件,细胞内平均铁含量、细胞存活率及T2*值以均数±标准差表示,组间比较采用t检验及单因素方差分析,组间多重比较采用LSD法,P<0.05为差异有统计学意义。
结 果
细胞转染效率
普鲁士蓝染色结果:随着磁性c-erbB-2反义探针质量浓度的增加,细胞内蓝色颗粒相应增加,当反义探针质量浓度增加到25 mg/L时,细胞蓝染率达100%,而50、100 mg/L组可见较多蓝染铁颗粒黏附于细胞表面甚至游离于细胞外 (图1)。
细胞铁含量:SK-Br-3细胞在本实验规定的范围内,按浓度依赖式摄取反义探针。5、10、25、50、100mg/L组的细胞内平均铁含量分别为 (8.82±0.41)、(11.02±0.31)、(18.38±0.28)、(20.27±0.34)、(21.15±0.29)pg,其中,25mg/L组与5和10 mg/L组相比,差异有统计学意义 (P均<0.05);与50和100 mg/L组相比,差异无统计学意义 (P均>0.05)。
透射电镜观察结果:各组均可见斑片状或点状分布的高密度氧化铁颗粒 (图2A),随着磁性c-erbB-2反义探针质量浓度的增加,细胞内氧化铁颗粒相应增加。在25、50、100 mg/L组,还可以观察到胞膜出现空泡化、细胞固缩、核固缩以及向外突出的凋亡小体 (图2B)。
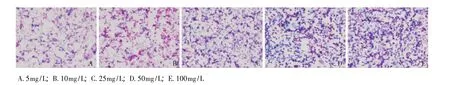
图1 普鲁士蓝染色结果 (×200)Fig 1 Results of Prussian blue staining(×200)
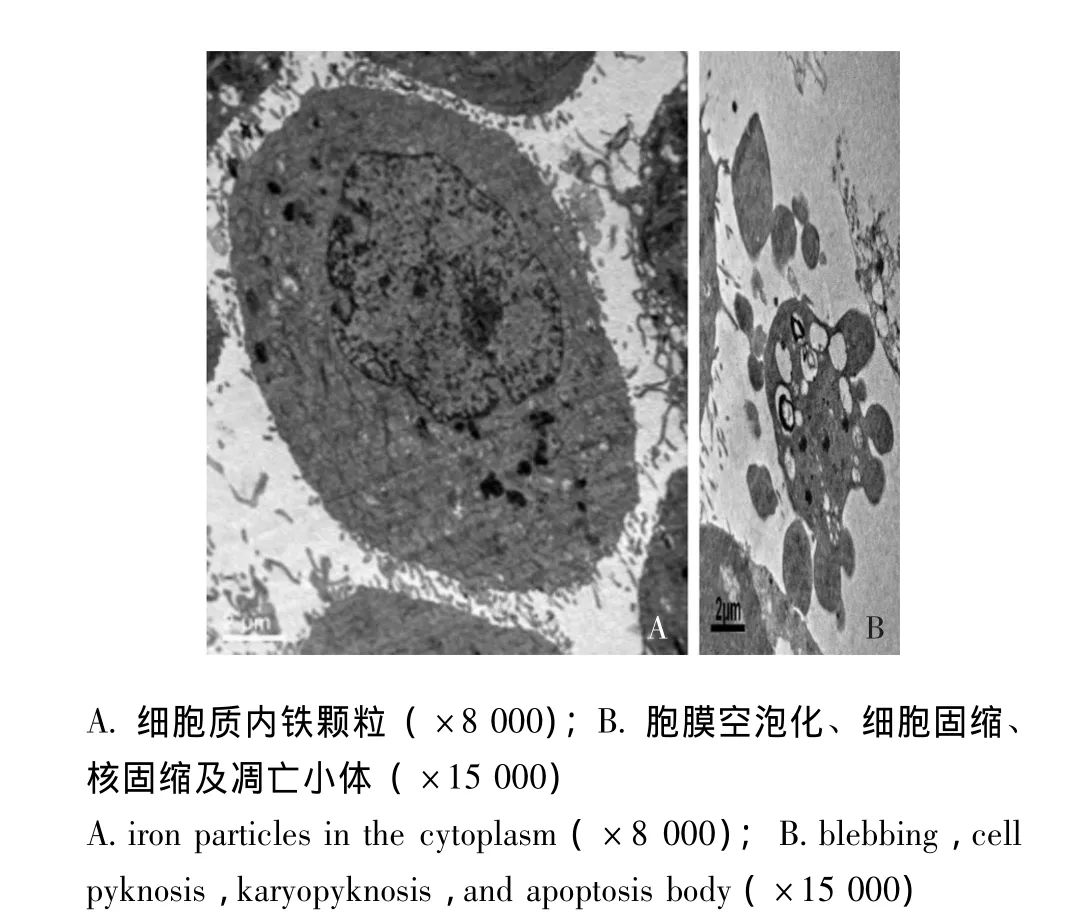
图2 探针铁质量浓度25 mg/L组电镜观察结果Fig 2 Electron microscopy of the 25 mg/L group
细胞活性检测结果
台盼蓝拒染率:5、10、25、50、100 mg/L组台盼蓝拒染率分别为 (98.99±1.67)%、(97.82±1.21)%、(80.13±1.24)%、(77.25±1.43)%、(71.32±1.54)%,其中,25 mg/L组与5和10 mg/L组相比,差异有统计学意义 (P均<0.05);与50和100 mg/L组相比,差异无统计学意义 (P均>0.05)。
细胞存活率:5、10、25、50、100 mg/L组细胞存活率分别为95.88%、91.39%、79.94%、71.81%、69.53%,其中,25 mg/L以下各质量浓度组细胞存活率差异无统计学意义 (P>0.05);≥25 mg/L的各组细胞存活率显著下降 (P<0.05),但50和100 mg/L组与25 mg/L组相比,差异无统计学意义 (P>0.05)。
c-erbB-2蛋白表达变化:质量浓度≥25 mg/L组对SK-Br-3细胞c-erbB-2蛋白的表达抑制率明显高于低质量浓度组,差异有统计学意义 (P<0.05),但50和100 mg/L组表达抑制率与25 mg/L组比较差异无统计学意义 (P>0.05,图3)。
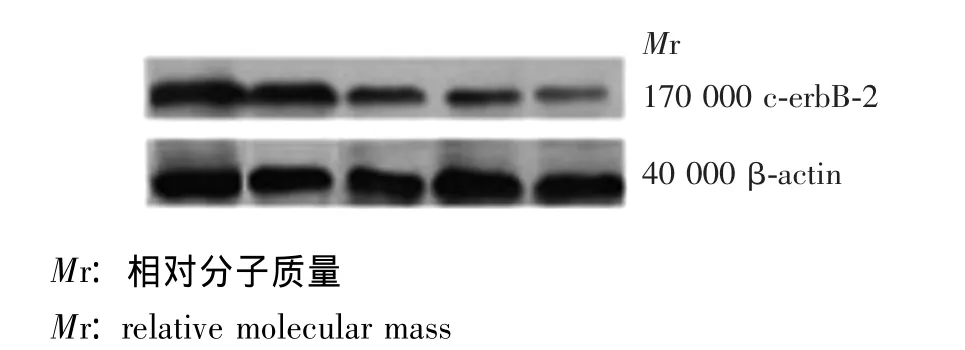
图3 Western blot条带图Fig 3 Western blot band diagram
磁共振成像结果:磁共振扫描下T2*WI信号随反义探针质量浓度的增加而降低,当质量浓度为25 mg/L时,T2*值明显降低,为134.728±0.647,对照组为306.263±0.878,两组相比差异有统计学意义 (P<0.05);而质量浓度为50、100 mg/L时,T2*WI信号降低程度与25 mg/L组相比,差异无统计学意义 (P>0.05)(图4)。
讨 论
本课题组制备的磁性c-erbB-2反义探针结构主要包括信号组件和亲和组件两个部分,信号组件为SPIO,亲和组件是针对c-erbB-2癌基因的ASODN。按照设计理念,根据反义基因理论[7],将c-erbB-2癌基因mRNA的特异序列作为研究的靶点,制备与其序列互补的ASODN片段,在引入细胞后,就能够按碱基互补原则与该癌基因的mRNA序列互补结合,封闭它们的转录、翻译,沉默基因表达,起到治疗肿瘤的目的。此外,探针中的SPIO能增加SK-Br-3细胞内的铁浓度,被MR扫描所检测,能达到特异性诊断的目的。本课题组的前期研究表明,探针在特定浓度 (铁质量浓度25 mg/L)及特定时间 (转染24 h)下,能顺利进入细胞内,具有对SK-Br-3肿瘤细胞诊断及治疗的双功能[5-6]。

图4 各质量浓度组磁共振结果Fig 4 MRI findings in each concentration group
在前期研究的基础上,本研究通过用不同质量浓度的磁性c-erbB-2反义探针进一步探索其转染SKBr-3肿瘤细胞的最佳浓度与变化规律,选择的观察指标结合形态与功能同步进行。普鲁士蓝染色及细胞铁含量结果均显示:SK-Br-3细胞在一定范围内按质量浓度大小呈依赖式摄取探针,当探针的铁质量浓度大于25 mg/L时,细胞摄取达到饱和,这与蔡金华等[8]、Yu等[9]的研究结果一致;随着反义探针质量浓度的增大,SK-Br-3细胞内的ASODN增多,细胞活性下降,当质量浓度为25 mg/L时,细胞活力及存活率显著降低,并出现凋亡小体。同时Western blot检测结果也显示,25 mg/L组c-erbB-2蛋白表达量明显低于5、10 mg/L组,当质量浓度继续升高到50 mg/L或100 mg/L时,c-erbB-2蛋白表达量与25 mg/L组比较差异无统计学意义,细胞活性检测(台盼蓝拒染率及CCK-8实验)也有同样的发现。磁共振扫描下T2*值随反义探针质量浓度的增加而降低,当质量浓度为25 mg/L时,T2*值明显降低,先前的文献也有类似报道[10]。本研究结果表明:(1)25 mg/L是磁性c-erbB-2反义探针转染SK-Br-3细胞的有效质量浓度,转染率达100%;(2)25 mg/L是磁性c-erbB-2反义探针中的ASODN进入细胞的最佳质量浓度,对细胞的生长、c-erbB-2癌蛋白的表达产生了明显的、特异性的抑制作用;(3)在磁共振扫描T2*序列,25 mg/L组呈明显低信号,可有效并特异性地显示SK-Br-3肿瘤细胞。
根据文献报道,当SPIO质量浓度不大于25 mg/L时,对正常细胞生长没有影响,而超过25 mg/L时,则会有一定程度的抑制作用[11-12]。本研究中ASODN是针对特定的靶mRNA序列设计,具有极高的特异性,由此推断,当反义探针的质量浓度为25 mg/L时,对细胞表达影响是反义效应所致。
综上,磁性c-erbB-2反义探针质量浓度为25 mg/L时,可以有效转染并特异地诊断及治疗乳腺癌SKBr-3细胞。不同孵育时间对细胞的转染率及细胞活力的影响将在后续实验中验证,这将有望为进一步活体肿瘤磁共振成像研究提供详细的数据支持。
[1]乔瑞瑞,曾剑峰,贾巧娟,等.磁性氧化铁纳米颗粒—通向肿瘤磁共振分子影像的重要基石[J].物理化学学报,2012,28(5):993-1011.
[2]Rudin M,Rausch M,stoeckli M.Molecular imaging in drug discovery and development:potential and limitations of nonnuclear methods[J].Mol Imaging Biol,2005,7(1):5-13.
[3]Cherry SR.In vivo molecular and genomic imaging:new challenges for imaging physics[J].Phys Med Biol,2004,49(1):13-48.
[4]Wen M,Li B,Ouyang Y,et al.Preparation and quality test of superparamagnetic iron oxide labeled antisense oligodeoxynucleotide probe:a preliminary study[J].Ann Biomed Eng,2009,37(6):1240-1250.
[5]Wen M,Li B,Bai W,et al.Application of atomic force microscopy in morphological observation of antisense probe labeled with magnetism [J].Mol Vis,2008,14(1):114-117.
[6]贺海容,谭书德,文明,等.磁性c-erbB2反义探针对SK-Br-3肿瘤细胞株形态及表达的影响 [J].吉林大学学报:医学版,2012,38(1):6-10.
[7]Wiechen K,Zimmer C,Dietel M.Selection of a high activity c-erbB-2 ribozyme using a fusion gene of c-erbB-2 and the enhanced green fluorescent protein [J].Cancer Gene Ther,1998,5(1):45-51.
[8]蔡金华,冯敢生,刘官信,等.不同浓度菲立磁对大鼠间充质干细胞标记效率和细胞活力的影响[J].临床放射学杂志,2007,26(2):190-193.
[9]Yu MX,Chen WL,Zhou Q,et al.Study on ASTC-a-1 cells labeled with superparamagnetic iron oxide and its magnetic resonance imaging[J].Exp Biol Med,2010,235(9):1053-1061.
[10]李绪斌,杜湘珂,霍天龙,等.乳腺癌特异性磁共振分子探针的制备及体外实验 [J].北京大学学报:医学版,2009,41(2):179-183.
[11]谭延斌,武新英,张景峰,等.超顺磁性氧化铁对血管内皮细胞的生物学影响及其磁共振成像效应[J].浙江大学学报:医学版,2010,39(2):118-124.
[12]Arbab AS,Bashaw LA,Miller BR,et al.Intracytoplasmic tagging of cells with ferumoxides and transfection agent for cellular magnetic resonance imaging after cell transplantation:methods and techniques[J].Transplantation,2003,76(7):1123-1130.
