地西他滨联合丙戊酸钠诱导的骨髓瘤细胞凋亡及其机制研究
2013-08-08马泳泳周淑娟陈枫煜蔡芳芳俞康
马泳泳,周淑娟,陈枫煜,蔡芳芳,俞康
地西他滨联合丙戊酸钠诱导的骨髓瘤细胞凋亡及其机制研究
马泳泳,周淑娟,陈枫煜,蔡芳芳,俞康
目的探讨地西他滨(DCA)联合丙戊酸钠(VPA)体外诱导骨髓瘤细胞株RPMI 8226凋亡及对死亡相关蛋白激酶(DAPK)基因去甲基化的作用。方法体外培养多发性骨髓瘤RPMI 8226细胞,实验分为5组:DCA组(选取1.5、3μmol/L 2个浓度),VPA组(选取1、2μmol/L 2个浓度),DCA+VPA组(DCA 3μmol/L+VPA 2μmol/L),PBS组,阴性对照组。上述细胞分别培养24、72h后,MTT法检测细胞存活情况。培养72h后,透射电镜观察DCA+VPA组细胞凋亡形态;流式细胞仪Annexin V法检测上述5组细胞凋亡率;MSP法检测上述5组细胞(DCA组取3μmol/L浓度,VPA组取2μmol/L浓度)处理前后DAPK基因甲基化状态,半定量RT-PCR方法检测DAPK基因表达情况。结果处理72h后,DCA+VPA组MTT值下降最明显,细胞存活率降低,与PBS组及阴性对照组比较差异有统计学意义(P<0.05);VPA组及DCA组MTT值均下降,DCA 3μmol/L组与PBS组及阴性对照组比较差异有统计学意义(P<0.05)。处理72h后,DCA+VPA、VPA、DCA组G1/G0期细胞增多,S期细胞减少,细胞凋亡率增加,DCA+VPA组凋亡率高于DCA组及VPA组(P<0.05),与PBS组及阴性对照组比较差异亦有统计学意义(P<0.05)。透射电镜下可观察到DCA+VPA组细胞出现核染色质凝聚、固缩、边集、核碎裂等典型的细胞凋亡形态学改变。处理72h后,DCA+VPA、VPA、DCA组细胞DAPK启动子均有去甲基化表现,以DCA+VPA组去甲基化程度为最大,与PBS组及阴性对照组相比差异均有统计学意义(P<0.05)。DCA+VPA、VPA、DCA组DAPK基因mRNA表达量均增加,且DCA+VPA组的相对mRNA比值高于其余4组(P<0.05)。结论DCA联合VPA可诱导骨髓瘤细胞株RPMI 8226凋亡及DAPK基因启动子去甲基化,使DAPK基因表达恢复。
地西他滨;丙戊酸钠;多发性骨髓瘤;死亡相关蛋白激酶
骨髓瘤的发生与抑癌基因高甲基化密切相关[1-6]。地西他滨(decitabine,DCA)是经典的去甲基化药物,可使高甲基化的抑癌基因去甲基化后恢复功能,从而逆转肿瘤细胞的生物学活性;DNA甲基化调节基因表达与组蛋白去乙酰化的作用密切相关,丙戊酸钠(valproic acid sodium,VPA)是组蛋白去乙酰化酶抑制剂,有文献显示组蛋白去乙酰化酶抑制剂可降低基因甲基化水平,开启基因表达[7]。死亡相关蛋白激酶(death-associated protein kinase,DAPK)是位于染色体9p34.1的抑癌基因,66.7%的多发性骨髓瘤DAPK的CpG岛发生超甲基化[8]。本研究选取DAPK基因为靶点,观察DCA联合VPA是否可以使DAPK启动子区去甲基化而恢复基因表达,从而发挥抑制肿瘤增殖的作用,以期为临床DCA联合VPA治疗多发性骨髓瘤提供理论依据。
1 材料与方法
1.1 主要药品及试剂 VPA购自杭州赛诺菲安万特公司,DCA(5-杂氮-2'-脱氧胞苷)、MTT购自美国Sigma公司,胎牛血清(fetal calf serum,FCS)购自杭州四季青生物公司,Trizol购自美国Invitrogen公司,反转录试剂盒购自Fermentas公司。其他生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成。
1.2 细胞培养 多发性骨髓瘤细胞株RPMI 8226由温州医学院内科实验室长期保存,实验前复苏,用含10% FCS的培养液重悬后,置于37℃、5%CO2、饱和湿度培养箱中培养,每2~3d换液1次。选择对数生长期细胞进行实验。以每孔2×105/ml的细胞密度接种于96孔板,每孔200μl。
1.3 MTT增殖抑制实验 细胞培养过夜后分为5组:①DCA组(选取1.5、3μmol/L 2个浓度);②VPA组(选取1、2μmol/L 2个浓度);③DCA+VPA组(DCA 3μmol/L+VPA 2μmol/L);④PBS组;⑤阴性对照组。5组细胞分别培养24、72h后每孔加入MTT (5mg/ml) 20μl,37℃放置4h;离心,弃上清,每孔加入二甲亚砜(DMSO) 150μl,混匀吹打,使沉淀充分溶解;酶联免疫分析仪读取490nm处的光密度(A)值,并用以下公式计算各组细胞增殖抑制率:增殖抑制率(%)=(1-药物组A值/对照组A值)×100%。实验设4个平行孔,重复3次。
1.4 电镜观察细胞凋亡形态 将生长状况良好的RPMI 8226细胞100μl接种于96孔培养板,细胞密度为1×106/ml。将细胞分为DCA+VPA组(DCA 3μmol/L+VPA 2μmol/L)、PBS组和阴性对照组,37℃、5%CO2连续培养72h,光镜观察并另取样进行透射电镜(温州医学院电镜室处理样品)观察。
1.5 流式细胞仪检测细胞周期及凋亡率 细胞分组同MTT实验,细胞处理72h后,将细胞吹打均匀,制成单细胞悬液,转移至5ml离心管,1000r/ min离心5min。PBS洗2次,用PBS重悬细胞,计数,调整细胞密度至1×106/ml。沿管壁缓慢加入-20℃预冷的95%乙醇,使其终浓度为70%,冰浴30min,4℃放置。用PBS洗涤,调节细胞密度至1×106/ml,加入等体积的PI染液1ml,4℃放置30min。以300目尼龙膜过滤,流式细胞仪测定每组细胞的荧光强度。
1.6 MSP法检测各组细胞处理前后DAPK基因甲基化状态 将细胞分为DCA组(浓度3μmol/L)、VPA组(浓度2μmol/L)、DCA+VPA组(DCA 3μmol/L+VPA 2μmol/L)、PBS组及阴性对照组。5组细胞处理72h后,抽提细胞基因组DNA。参照文献进行甲基化特异性PCR(MSP)[9]。PCR反应条件:95℃预变性5min,冰浴冷却后,加入Taq聚合酶2U。DAPK-M(甲基化DAPK),DAPK-U(非甲基化DAPK)扩增条件:95℃45s、62℃45s、72℃45s,35个循环;72℃延伸7min。取扩增产物行2.5%琼脂糖凝胶电泳,凝胶图像成像系统拍摄保存实验结果。
1.7 RT-PCR检测DAPK基因表达 细胞分组同MSP检测,5组细胞处理72h后,Trizol法常规抽提细胞总RNA,M-MLV反转录酶进行反转录,实时荧光定量PCR仪进行实时PCR扩增,以DAPK基因Ct值与相应内参基因β-actin Ct值的比值表示DAPK基因的相对表达量。引物序列见表1。扩增条件:94℃30s、58℃30s、72℃5min,30个循环;72℃6min。

表1 引物序列Tab.1 Sequences of primers
1.8 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以表示,组间比较采用单因素方差分析(ANOVA),进一步两两比较采用最小显著性差异法(LSD法)。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT检测结果 细胞处理72h后,DCA+VPA组增殖抑制率下降最为明显,与PBS组及阴性对照组比较差异有统计学意义(P<0.05),VPA组及DCA组增殖抑制率均有下降,DCA 3μmol/L组与PBS组及阴性对照组比较差异有统计学意义(P<0.05,表2)。
表2 各组MTT检测结果 (%,±s,n=12)Tab.2 Findings of MTT detection in each group (%,±s,n=12)
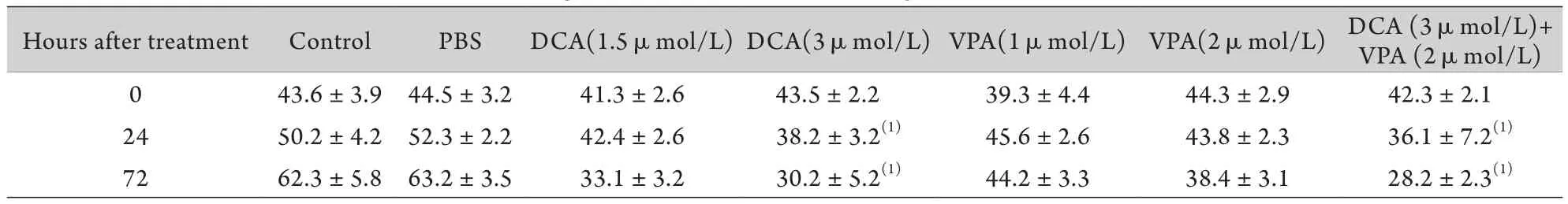
表2 各组MTT检测结果 (%,±s,n=12)Tab.2 Findings of MTT detection in each group (%,±s,n=12)
(1)P<0.05 compared with PBS and control group
Hours after treatment ControlPBSDCA(1.5μmol/L)DCA(3μmol/L)VPA(1μmol/L)VPA(2μmol/L)DCA (3μmol/L)+ VPA (2μmol/L) 0 43.6±3.944.5±3.241.3±2.643.5±2.239.3±4.444.3±2.942.3±2.1 2450.2±4.252.3±2.242.4±2.638.2±3.2(1)45.6±2.643.8±2.336.1±7.2(1)7262.3±5.863.2±3.533.1±3.230.2±5.2(1)44.2±3.338.4±3.128.2±2.3(1)
2.2 细胞凋亡形态 透射电镜结果显示,DCA+VPA组处理72h后可观察到核染色质凝聚、固缩、边集、核碎裂等典型的细胞凋亡形态学改变(图1)。
2.3 流式细胞仪检测细胞周期及凋亡率DCA+VPA、VPA、DCA组处理72h的RPMI 8226细胞,G1/G0期细胞增多,S期细胞减少,细胞凋亡率增加。DCA+VPA组细胞凋亡率高于DCA组及VPA组(P<0.05),与PBS组及阴性对照组比较差异亦有统计学意义(P<0.05,表3、图2)。
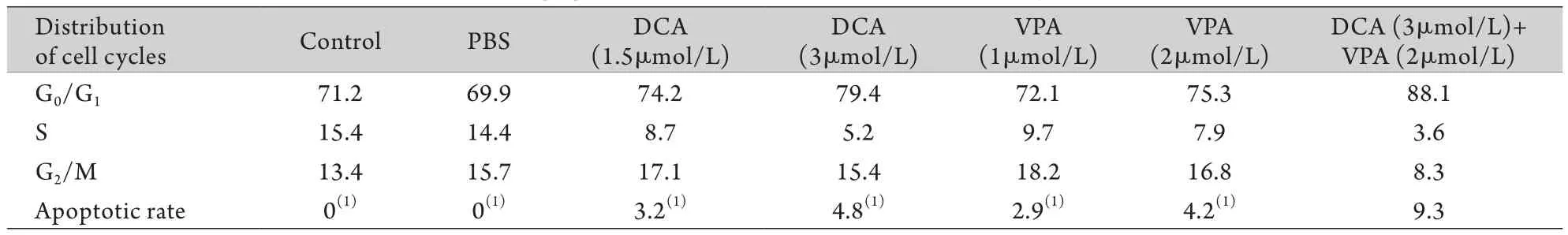
表3 各组细胞周期和凋亡率检测结果(%)Tab.3 Cell cycles and apoptotic rate of RPMI 8226 cells treated by VPA and/or DCA (%)
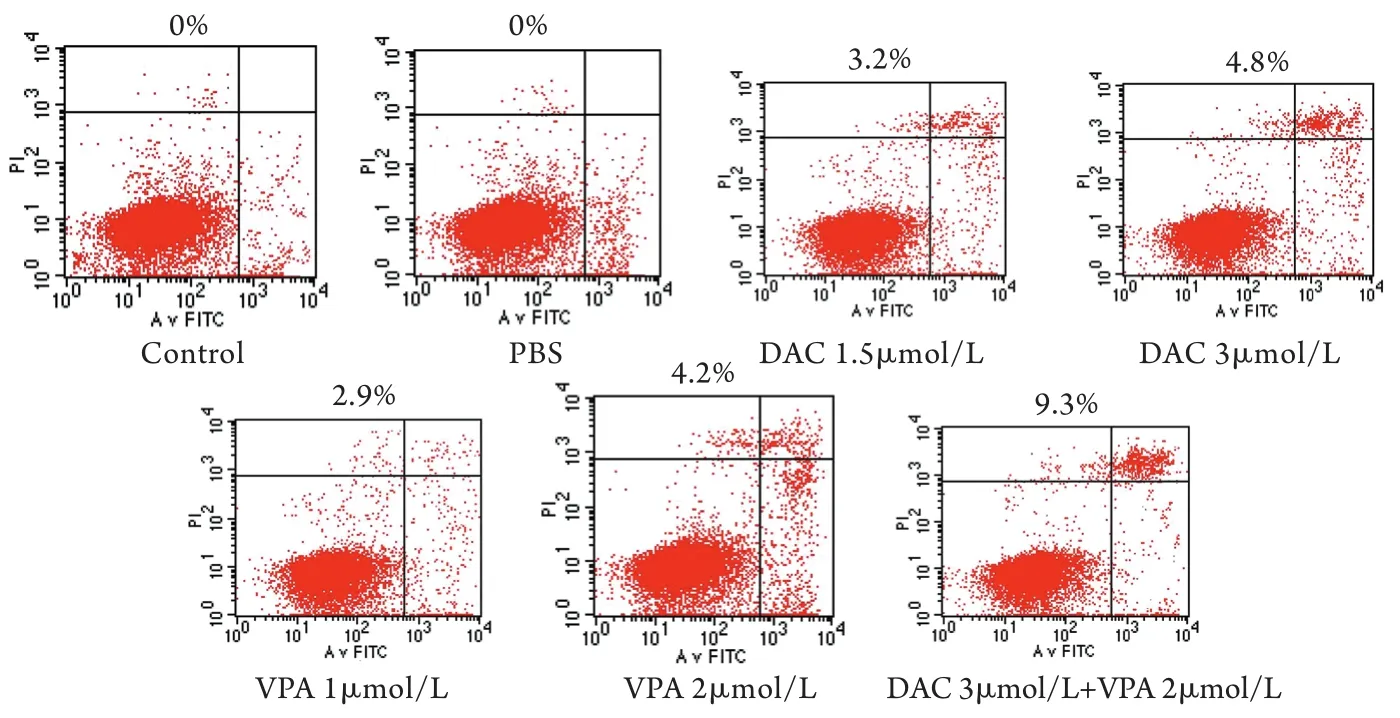
图2 不同处理组作用72h后RPMI 8226细胞的凋亡率Fig.2 Apoptotic rate of RPMI 8226 cells 72 hours after treatment in different groups
2.4 各组细胞处理前后DAPK基因甲基化状态DCA+VPA、VPA、DCA组处理72h后其DAPK启动子均有去甲基化表现,其中DCA+VPA组去甲基化程度最大,与PBS组及阴性对照组相比差异有统计学意义(图3)。
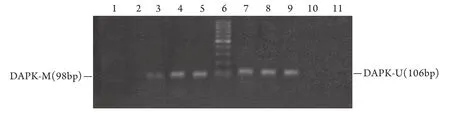
图3 各组处理72h后RPMI 8226细胞的DAPK基因甲基化状态(RT-PCR)Fig.3 Methylation of DAPK gene in RPMI 8226 cells induced by DCA and/or VPA for 72h (RT-PCR)
2.5 各组细胞DAPK基因表达结果 DCA+VPA、DCA、VPA处理组DAPK基因mRNA表达量均增加,且DCA+VPA组的相对mRNA比值高于DCA组、VPA组,显著高于PBS组及阴性对照组(图4)。
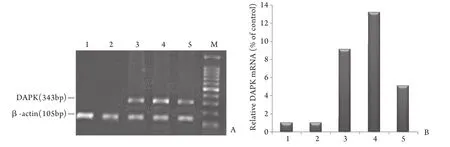
图4 RT-PCR检测DAPK基因mRNA表达情况Fig. 4 RT-PCR results for DAPK mRNA expression
3 讨 论
多发性骨髓瘤是骨髓浆细胞克隆性增殖的血液系统恶性肿瘤,约占血液系统肿瘤的10%。近年来随着多发性骨髓瘤发病机制和病理生理研究的深入,各种新思路新方法相继出现[10]。目前已有文献报道骨髓瘤的发生与抑癌基因高甲基化密切相关,由于浆细胞多个基因启动子区CpG岛发生甲基化而使其表达失活,从而导致骨髓瘤发生[1-5,11],故抑癌基因的去甲基化是多发性骨髓瘤治疗的新思路之一。DNA甲基化转移酶抑制剂可逆转DNA甲基化过程,诱导肿瘤细胞凋亡或向正常细胞分化。DCA是经典的去甲基化药物,可使高甲基化的抑癌基因去甲基化后恢复功能,从而逆转肿瘤细胞的生物学活性。DNA甲基化调节基因表达与组蛋白去乙酰化的作用密切相关。基因的甲基化有区域差异,非甲基化CpG主要用于转录活化染色质。CpG岛染色质含有高度乙酰化的组蛋白H3和H4。组蛋白去乙酰化酶使组蛋白H3和H4去乙酰化可能导致抑制转录的染色质环境的形成。低乙酰化时,转录静止区域通常是甲基化的。组蛋白去乙酰化酶异常结合到特定的启动子区,从而抑制正常功能基因的转录。DNA甲基化引起的基因沉默涉及异常招募去乙酰化酶,而富含去乙酰化酶的异染色质又可以继发性募集DNA甲基转移酶,因此,在由于DNA甲基化异常引发的恶性肿瘤中去乙酰化酶同样起着重要作用。既往用于治疗癫痫和躁郁症的老药VPA新近被发现具有组蛋白去乙酰化酶(HDCA)抑制剂的特征性作用[12]。越来越多的证据表明,VPA作为HDCA抑制剂而具有抗肿瘤作用,可能机制在于其抑制了HDCA活性,导致组蛋白高乙酰化状态,使得染色质保持更加开放的构型,开放构型的染色质引起翻译沉默路径活化或通过募集一些阻遏蛋白抑制异常表达的基因,进而使肿瘤细胞生长受抑,细胞周期阻滞及凋亡[13]。VPA对包括子宫内膜癌、乳腺癌、白血病在内的多种恶性肿瘤的生长均有抑制作用,并诱导其分化和凋亡。VPA对肿瘤细胞有选择性细胞毒性,而对正常造血细胞无严重毒性,且与多种化疗药物有协同作用。
DAPK是一类新的钙离子/钙调素依赖激酶,可使其底物蛋白的丝氨酸/苏氨酸残基磷酸化,该激酶最初是作为由γ干扰素(INF-γ)诱导细胞凋亡的一种正调控子而被分离鉴定出来的[14]。研究发现,DAPK基因5'非翻译区的CpG岛是一个超甲基化的潜在靶点,66.7%的多发性骨髓瘤DAPK的CpG岛发生超甲基化[8],其他人类肿瘤也存在DAPK基因表达缺失,如70%的B细胞性淋巴瘤和白血病细胞株的DAPK mRNA和蛋白表达下调,30%的膀胱癌、乳腺癌和肾细胞癌细胞株DAPK表达缺失,34%的垂体腺瘤检测不到DAPK,而在人类和鼠的正常组织中DAPK却有广泛表达。这提示DAPK超甲基化导致DAPK基因失活、DAPK表达缺失可能是肿瘤形成的重要因素。
因此,本研究选取DAPK基因为靶点,以多发性骨髓瘤RPMI 8226细胞株为体外实验对象,探讨DNA甲基化转移酶抑制剂DCA联合HDCA抑制剂VPA在体外是否可诱导骨髓瘤细胞凋亡、是否通过去甲基化上调DAPK基因的mRNA表达诱导骨髓瘤细胞凋亡和增殖抑制。实验结果证实与对照组及PBS组比较,3μmol/L DCA及DCA+VPA具有诱导RPMI 8226细胞凋亡及生长周期阻滞的作用,其机制可能为DCA使DAPK基因启动子去甲基化,使其重新表达,而VPA可使DCA去甲基化作用增强。本研究还发现VPA单药组处理72h后细胞DAPK启动子均有去甲基化表现,并且其DAPK基因mRNA表达量增加,原因可能是VPA抑制了HDCA异常结合到DAPK基因的启动子区,解除了其对DAPK基因转录的抑制。本研究为治疗多发性骨髓瘤提供了一种新思路,希望为5-杂氮-2'-脱氧胞苷及VPA用于临床治疗多发性骨髓瘤提供一定的体外实验依据。
[1] Fernández de Larrea C, Martín-Antonio B, Cibeira MT,et al. Impact of global and gene-specific DNA methylation pattern in relapsed multiple myeloma patients treated with bortezomib[J]. Leuk Res, 2013, 37(6): 641-646.
[2] Kim H, Jekarl DW, Kim M,et al. Prevalence of p16 methylation and prognostic factors in plasma cell myeloma at a single institution in Korea[J]. Ann Lab Med, 2013, 33(1): 28-33.
[3] Amodio N, Leotta M, Bellizzi D,et al. DNA-demethylating and anti-tumor activity of synthetic miR-29b mimics in multiple myeloma[J]. Oncotarget, 2012, 3(10): 1246-1258.
[4] Wong KY, Huang X, Chim CS. DNA methylation of microRNA genes in multiple[J]. Carcinogenesis, 2012, 33(9): 1629-1638.
[5] Hatzimichael E, Dasoula A, Kounnis V,et al. Bcl2-interacting killer CpG methylation in multiple myeloma: a potential predictor of relapsed/refractory disease with therapeutic implications[J]. Leuk Lymphoma, 2012, 53(9): 1709-1713.
[6] Sun Y, Zhang C, Chen J,et al. Autoimmune dendritic cells in combination of cytokines-induced killer cells for relapse refractory myeloma: a report of 26 cases[J]. Med J Chin PLA, 2011, 36(7): 773-775. [孙薏, 张聪, 陈健, 等. 自体树突细胞联合细胞因子诱导杀伤细胞过继治疗复发难治性骨髓瘤26例[J]. 解放军医学杂志, 2011, 36(11): 1245-1246.]
[7] Zheng Y, Sweet SM, Popovic R,et al. Total kinetic analysis reveals how combinatorial methylation patterns are established on lysines 27 and 36 of histone H3[J]. Proc Natl Acad Sci USA, 2012, 109(34): 13549-13554.
[8] Braggio E, Maiolino A, Gouveia ME,et al. Methylation status of nine tumor suppressor genes in multiple myeloma[J]. Int J Hematol, 2010, 91(1): 87-96.
[9] Hashida Y, Nemoto Y, Imajoh M,et al. Promoter methylation of the bone morphogenetic protein 6 gene in multiplemyeloma[J]. Oncol Rep, 2012, 27(3): 825-830.
[10] Hu JY, Jiang DX, Fan RH,et al. FISH analysis for multiple myeloma: a report of 14 cases[J]. J Zhengzhou Univ (Med Sci), 2010, 45(4): 659-661. [胡杰英, 蒋东霞, 范瑞华, 等. 多发性骨髓瘤14例间期荧光原位杂交分析[J]. 郑州大学学报(医学版), 2010, 45(4): 659-661.]
[11] Li J, Fu R, Wang HQ,et al. Research on cellular immune function of multiple myeloma[J]. Chin J Pract Intern Med, 2010, 30(6): 539-541. [李镜, 付蓉, 王化泉, 等. 多发性骨髓瘤细胞免疫功能的研究[J]. 中国实用内科杂志, 2010, 30(6): 539-541.]
[12] Chen L, Feng PM, Zhou D. Clinical analysis of the effects of sodium valproate on adult refractory status epilepticus[J]. Med J Chin PLA, 2008, 33(2): 200-201. [陈蕾, 冯培民, 周东. 丙戊酸钠注射液治疗成人难治性癫痫持续状态的临床效果分析[J], 解放军医学杂志, 2008, 33(2): 200-201.]
[13] Li X, Zhu Y, He H,et al. Synergistically killing activity of aspirin and histone deacetylase inhibitor valproic acid (VPA) on hepatocellular cancer cells[J]. Biochem Biophys Res Commun, 2013, 436(2): 259-264.
[14] Raveh T, Kimchi A. DAP kinasea proapoptotic gene that functions as a tumor suppressor[J]. Exp Cell Res, 2001, 264(1): 185-192.
Induction effects of decitabine in combination with valproic acid sodium on apoptosis of myeloma cells and its underlying mechanism
MA Yong-yong1, ZHOU Shu-juan1, CHEN Feng-yu2, CAI Fang-fang1, YU Kang1
1Department of Hemotology, First Affiliated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang 325000, China
2First Clinical Medical College, Wenzhou Medical University, Wenzhou, Zhejiang 325000, China
This work was supported by the Foundation of Wenzhou City Science and Technology Plan (Y20100106)
ObjectiveTo investigate the effects of decitabine (DCA) combined with valproate sodium (VPA) on the apoptosis of multiple myeloma cell line RPMI 8226 and the demethylation of death-associated protein kinase (DAPK).MethodsThe RPMI 8226 cells were cultured and treated with DCA (1.5μmol/L, 3μmol/L), VPA (1μmol/L, 2μmol/L), VPA+DCA (DCA 3μmol/L+VPA 2μmol/L) and PBS, respectively, and those cells without treatment served as negative control. The survival status of cells was detected by MTT assay after culture for 24 and 72h. The apoptotic rate and cell cycle of RPMI 8226 cells were detected by flow cytometry (FCM), and the apoptosis of cell was observed under the transmission electron microscope (TEM). MSP method was used to detect the methylation of DAPK gene in the RPMI 8226 cells. The mRNA expression of DAPK was detected by RTPCR.ResultsMTT assay showed that the cell activity decreased remarkably in VPA+DCA group after 72h compared with other groups, and the MTT value of VPA+DCA group was significantly different from those of PBS and negative control group (P<0.05). The cell activity in VPA and DCA group decreased remarkably, the MTT value of DCA 3μmol/L group was significantly different from those of PBS and negative control group (P<0.05). FCM analysis revealed that the apoptosis rate increased, the cells in G0/G1phase increased and the cells in S phase decreased in VPA, DCA and VPA+DCA groups after 72h. The apoptosis rate was higher in DCA+VPA group than in DCA and VPA groups, and significantly higher than in PBS and negative control groups (P<0.05). The typical morphological changes of RPMI 8226 cells were observed under TEM in DCA+VPA group, such as chromatin condensation, pyknosis, margination and nuclear fragmentation. The demethylation of DAPK promoters was observed in all the VPA, DCA andVPA+DCA groups, with a highest degree in DCA+VPA group. The degree of DAPK demethylation was significantly different in DCA+VPA group from PBS and control group (P<0.05). The mRNA expression levels of DAPK were up-regulated in VPA, DCA and DCA+VPA groups. The relative mRNA ratio was higher in VPA+DCA group than in other groups, and significantly higher than in PBS and negative control group (P<0.05).ConclusionDCA and VPA can induce the apoptosis of RPMI 8226 cells and the hypermethylation of DAPK promoter, which enables DAPK gene to be re-expressed.
decitabine; valproate sodium; multiple myeloma; death-associated protein kinase
R551.31
A
0577-7402(2013)10-0837-05
10.11855/j.issn.0577-7402.2013.10.012
2013-02-25;
2013-08-03)
(责任编辑:沈宁)
温州市科技计划(Y20100106)
马泳泳,医学硕士,主治医师。主要从事骨髓瘤表观遗传学方面的研究
325000 浙江温州 温州医学院附属第一医院血液科(马泳泳、周淑娟、蔡芳芳、俞康);325000 浙江温州 温州医学院第一临床医学院(陈枫煜)