高糖刺激下大鼠肾小球系膜细胞MMP-2,TIMP-2,MT1-MMP和CTGF的表达及意义
2013-08-08姚芳李志红闫喆刘青娟段惠军郄涛
姚芳,李志红,闫喆,刘青娟,段惠军,郄涛
高糖刺激下大鼠肾小球系膜细胞MMP-2,TIMP-2,MT1-MMP和CTGF的表达及意义
姚芳,李志红,闫喆,刘青娟,段惠军,郄涛
目的观察高糖刺激的大鼠肾小球系膜细胞基质金属蛋白酶-2(MMP-2)及其组织抑制物-2(TIMP-2)、膜型基质金属蛋白酶-1(MT1-MMP)和结缔组织生长因子(CTGF)的动态变化以探讨糖尿病肾病(DN)的发病机制。方法体外培养的大鼠HBZY-1肾小球系膜细胞分为低糖(5.5mmol/L葡萄糖)组、高糖(30mmol/L葡萄糖)组和渗透压对照(5.5mmol/L葡萄糖+24.5mmol/L甘露醇)组,24、48、72、96h后采用RT-PCR及Western blotting法分别检测MMP-2、TIMP-2、MT1-MMP及CTGF的mRNA及蛋白表达情况,酶联免疫吸附法(ELISA)检测培养上清中Ⅳ型胶原的含量。结果Western blotting 结果显示,与低糖组相比,高糖组MMP-2的表达在24h时略有升高,较低糖组增加10%±4%(P<0.05),至48h时则较低糖组减少42%±2%,其后随时间延长表达持续降低,至96h时较低糖组减少78%±2%;MT1-MMP表达在24h开始下降并随时间呈下降趋势,与低糖组相比较,在刺激的24h,高糖组MT1-MMP表达下降了29%±3%,随后持续下降,至96h则下降了78%±9%(P<0.01)。高糖组各时间点TIMP-2和CTGF表达均较低糖组增高,其中CTGF的表达在高糖刺激的24h即显著增高,为低糖组的201%±24%,随后持续增高,至培养96h为低糖组的484%±51%(P<0.01);TIMP-2的表达在24h时较低糖组增加55%±3%,且随时间延长呈增高趋势(P<0.01)。MMP-2、TIMP-2、MT1-MMP和CTGF的mRNA表达与相应蛋白的表达趋势基本一致。与低糖组相比,高糖组细胞上清中的Ⅳ型胶原于24h即有增加,且持续增高至96h(P<0.05)。低糖组和渗透压对照组组内、组间的各指标差异均无统计学意义。结论尽管高糖刺激早期可小幅诱导MMP-2的表达增强,但长期高糖刺激则可抑制MMP-2和MT1-MMP的表达及活化,同时促进系膜细胞TIMP-2和CTGF的表达。DN中肾小球细胞外基质的积聚可能是由于上述细胞因子和蛋白酶引起细胞外基质代谢失衡所致。
糖尿病肾病;肾小球系膜细胞;基质金属蛋白酶-2;基质金属蛋白酶组织抑制物-2;结缔组织生长因子;膜型基质金属蛋白酶-1
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见而严重的并发症,其发生率呈逐年上升趋势,已成为发达国家终末期肾病的首要原因[1]。DN的主要病理特征包括肾小球硬化及小管间质纤维化。细胞外基质(extracellular matrix,ECM)的积聚是DN中肾小球硬化的基础。近年来的研究显示ECM降解能力下降在DN的发生、发展中起着更为重要的作用[2]。基质金属蛋白酶(metalloproteinases,MMPs)家族中的MMP-2主要参与Ⅳ型胶原的降解,而后者是DN中肾小球基底膜增厚和系膜基质堆积的主要成分,因此与DN的关系最为密切[3]。近年来有关MMP-2及其组织抑制物(tissue inhibitor of metalloproteinase-2,TIMP-2)在DN中的作用存有较多争议,关于MMP-2酶原的特异膜型激活剂——膜型基质金属蛋白酶-1(membrane type 1-matrix metalloproteinase,MT1-MMP)在DN中的表达及作用鲜见报道。结缔组织生长因子(connective tissue growth factor,CTGF)是TGF-β1下游的重要效应因子,因其具有较强的致纤维化作用[4],且生物效应较单一,已成为DN研究的热点。目前有关CTGF在DN的ECM代谢障碍中的作用机制研究报道较少。本实验以肾小球中功能最活跃的系膜细胞作为研究对象,动态观察高糖刺激对体外培养的大鼠系膜细胞CTGF、MMP-2,TIMP-2和MT1-MMP及ECM表达的影响,以探讨DN中ECM代谢障碍的发生机制。
1 材料与方法
1.1 主要材料及试剂 大鼠HBZY-1肾小球系膜细胞株购自武汉大学保藏中心。羊抗CTGF、TIMP-2、MT1-MMP多克隆抗体,小鼠抗MMP-2、β-actin单克隆抗体,ECL增强化学发光试剂盒为Santa Cruz公司产品。RT-PCR试剂盒为Promega公司产品。Ⅳ型胶原ELISA试剂盒为Sigma公司产品。辣根过氧化物酶(HRP)标记兔抗羊IgG和羊抗小鼠IgG由北京中杉公司进口分装。聚偏二氟乙烯膜(PVDF)为 Milipore公司产品。温度梯度PCR仪为德国Whatman Biometra公司产品。
1.2 方法
1.2.1 细胞培养与分组 常规方法复苏肾小球系膜细胞后,采用胰酶消化法传代、培养。将细胞分为3组:低糖组(LG组,给予5.5mmol/L葡萄糖刺激)、渗透压对照组(LG+M组,给予5.5mmol/L葡萄糖+24.5mmol/L甘露醇)、高糖组(HG组,给予30mmol/L葡萄糖)。分别于刺激的24、48、72、96h收集细胞,提取蛋白及总RNA;同时收集细胞培养上清液。
1.2.2 Western blotting检测 细胞用冰PBS(0.01mol/L)洗2遍,加入细胞裂解液冰浴1h,4℃、14 000r/min离心15min,取上清,Lowry法测定蛋白浓度。每上样孔加75μg总蛋白行12%SDSPAGE凝胶电泳;湿转法电转移至PVDF膜,5%脱脂奶粉37℃封闭1h;加封闭液稀释的一抗(1:1000)于4℃过夜;洗膜后加HRP标记的兔抗羊或羊抗小鼠IgG(1:5000)37℃孵育1.5h;洗膜后加化学发光剂ECL反应1min,曝光、冲洗后扫描蛋白条带。以β-actin为内参照,采用美国UVP公司LabWork分析系统软件对条带进行定量分析。
1.2.3 RT-PCR检测 采用Trizol试剂提取细胞总RNA,用紫外可见分光光度仪测定其纯度和含量。2μg总RNA和oligo(dT)15引物按Promega公司反转录试剂盒要求加入试剂,反转录得到cDNA。取1μl cDNA进行PCR反应。所用引物、退火温度、扩增片段长度及扩增条件如下。CTGF:正义5'-CTCGCCTTGGTGCTCCTCCT-3',反义5'-TGCGGTCCTTGGGCTCATC-3',扩增片段481bp,退火温度60℃;MMP-2:正义5'-GGAGGCACGATTGGTCTG-3',反义5'-TTGGTT TCCGCATGGTCT-3',扩增片段299bp,退火温度55℃;MT1-MMP:正义5'-CCTCAAGTGGCAGCATA AT-3',反义5'-AAGTTCTCGGTGTCCATCC-3',扩增片段459bp,退火温度58℃;TIMP-2:正义5'-CCAAAGCAGTGAGCGAGAA-3',反义5'-CATCCAG AGGCACTCATCC-3',扩增片段386bp,退火温度57℃;18S rRNA:正义5'-ACACGGACAGGATTGAC AGA-3',反义5'-GGACATCTAAGGGCATCACAG-3',扩增片段238bp,退火温度56℃。所有引物均由上海生工生物公司合成,上述PCR反应均为30个循环。PCR产物行1.5%琼脂糖凝胶电泳,以18S rRNA为内参照,在凝胶成像分析系统(美国UVP公司)下进行定量分析。
1.2.4 ELISA检测 采用ELISA试剂盒检测细胞培养上清中Ⅳ型胶原的含量,严格按照试剂盒说明书进行操作。
1.3 统计学处理 采用SPSS 12.0软件进行统计学分析。计量资料符合正态分布,以表示,各组样本方差齐,组间比较采用单因素方差分析,多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 Western blotting检测结果 与低糖组相比,高糖组MMP-2的表达在24h时略有升高,较低糖组增加10%±4%(P<0.05),至48h时则较低糖组减少42%±2%,其后随时间延长表达持续降低,至96h时较低糖组减少78%±2%;MT1-MMP表达在24h开始下降并随时间呈下降趋势,高糖组与低糖组比较,在刺激的24h,MT1-MMP表达下降了29%±3%,随后持续下降,至96h下降了78%±9%(P<0.01)。高糖组各时间点TIMP-2和CTGF表达均较低糖组上调,其中CTGF的表达在高糖刺激的24h即显著上调,为低糖组的201%±24%,随后持续增高,培养至96h为低糖组的484%±51%(P<0.01);TIMP-2的表达在24h时较低糖组增加55%±3%,且随时间呈增高趋势(P<0.01)。低糖组和渗透压对照组组内、组间的各指标均无显著性差异(图1-4)。
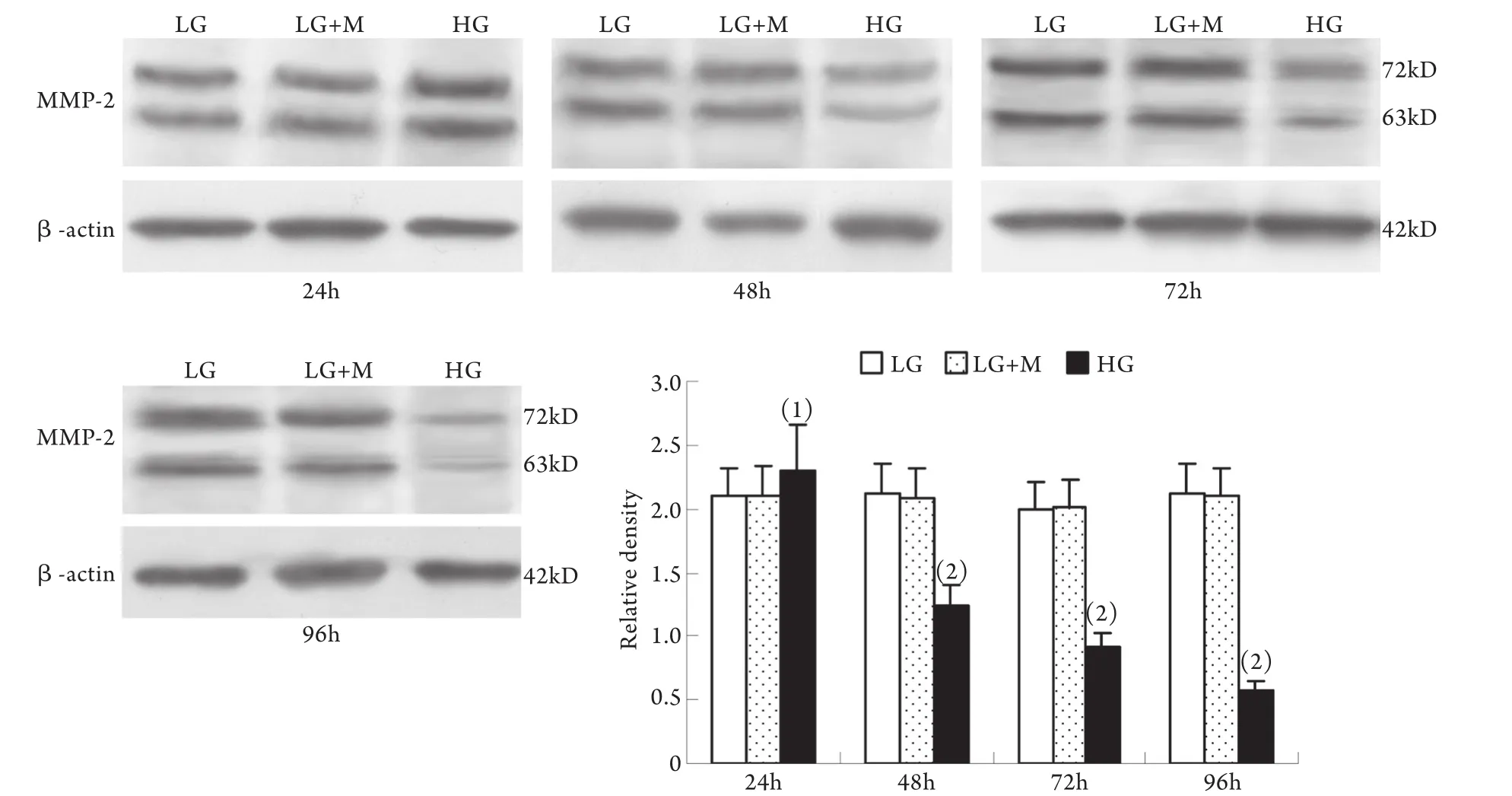
图1 系膜细胞MMP-2蛋白表达结果Fig.1 Expression of MMP-2 protein in cultured GMCs
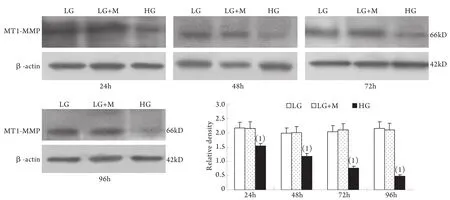
图2 系膜细胞MT1-MMP蛋白表达结果Fig.2 Expression of MT1-MMP protein in cultured GMCs
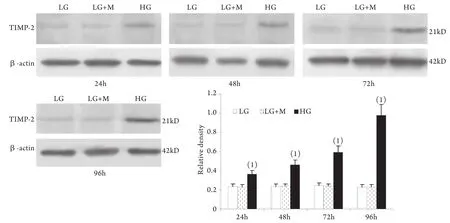
图3 系膜细胞TIMP-2蛋白表达结果Fig.3 Expression of TIMP-2 protein in cultured GMCs
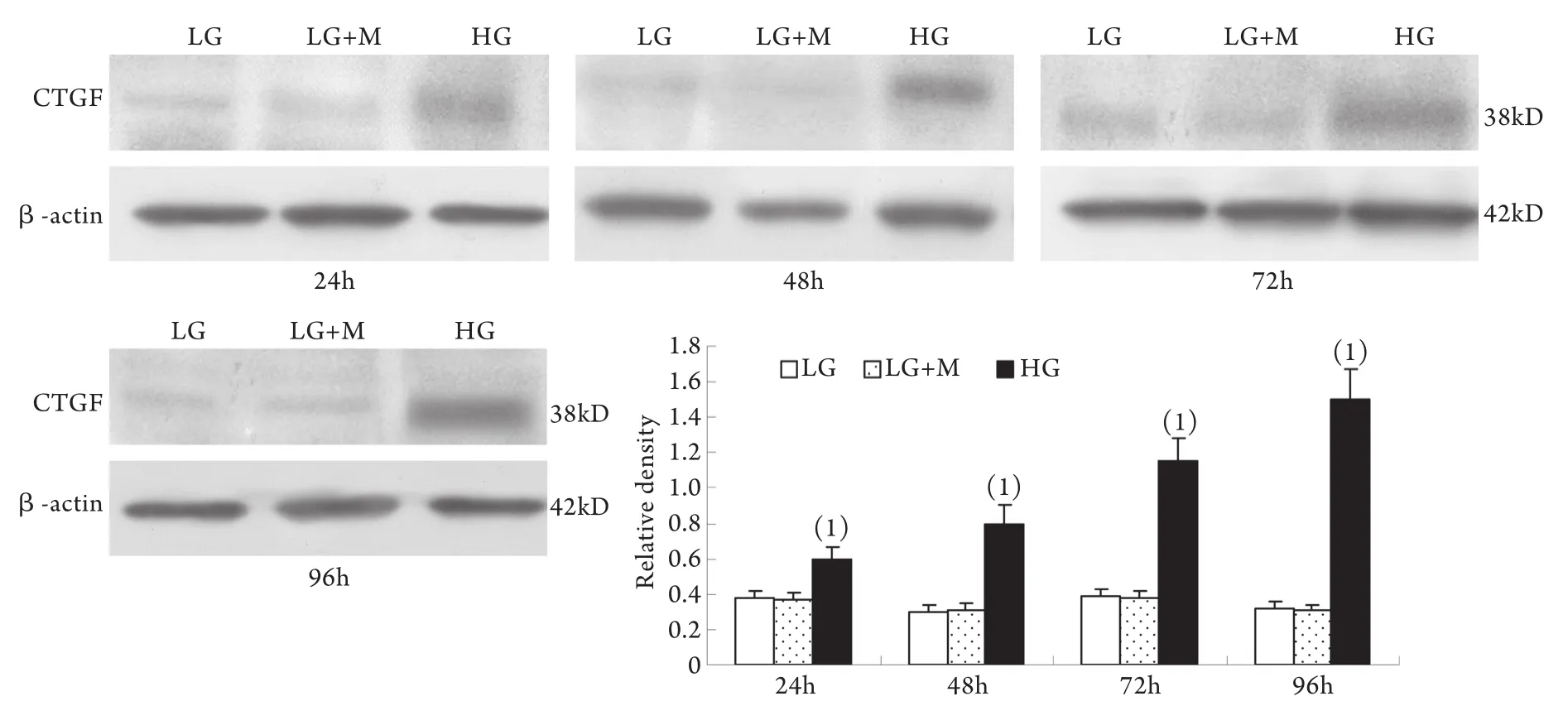
图4 系膜细胞CTGF蛋白表达结果Fig.4 Expression of CTGF protein in cultured GMCs
2.2 半定量RT-PCR检测mRNA的表达 MMP-2、TIMP-2、MT1-MMP和CTGF的mRNA表达与各自蛋白的表达趋势基本一致。即CTGF mRNA和TIMP-2 mRNA在低糖组有少量表达,在高糖组各时间点表达上调,且随时间呈增高趋势,而MT1-MMP mRNA在低常糖组有较高表达,在高糖组各时间点表达下调且随时间呈下降趋势(P<0.01)。高糖组24h的MMP-2 mRNA表达略有增加,较低糖组增加9%±2%(P<0.05),其后48~96h则低于低糖组,且随时间持续降低(图5-8)。低糖组和渗透压对照组组内、组间的各指标差异均无统计学意义。
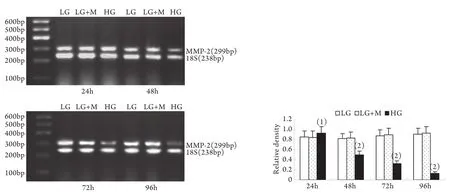
图5 系膜细胞MMP-2 mRNA表达结果Fig.5 Expression of MMP-2 mRNA in cultured GMCs
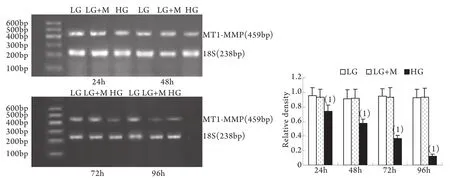
图6 系膜细胞MT1-MMP mRNA表达结果Fig.6 Expression of MT1-MMP mRNA in cultured GMCs
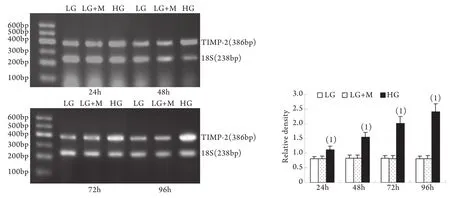
图7 系膜细胞TIMP-2 mRNA表达结果Fig.7 Expression of TIMP-2 mRNA in cultured GMCs
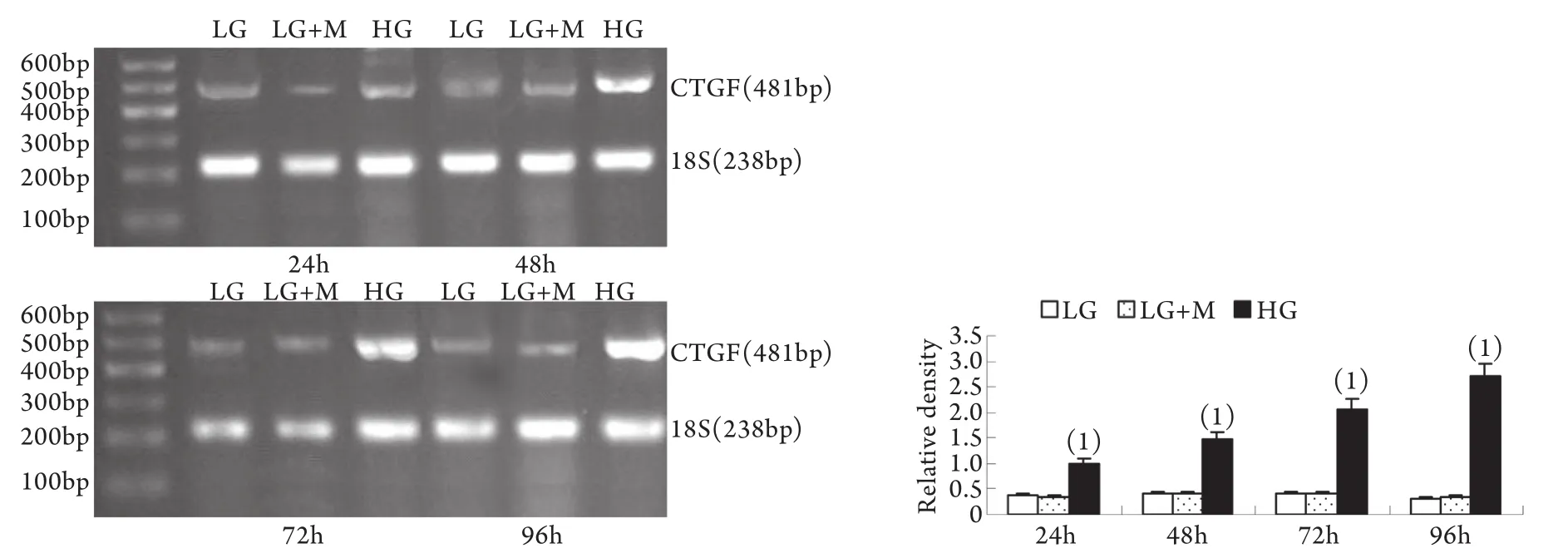
图8 系膜细胞CTGF mRNA表达结果Fig.8 Expression of CTGF mRNA in cultured GMCs
2.3 细胞上清液检测结果 与低糖组相比,高糖组细胞上清中的Ⅳ型胶原24h时即有增加,且持续增高至96h,低糖组和渗透压对照组组内、组间的Ⅳ型胶原含量差异无统计学意义(P<0.05,表1)。
表1 不同时间点系膜细胞培养上清液中Ⅳ型胶原浓度(±s,μg/L)Tab.1 Concentration of collagen Ⅳ in the supernatants of GMCs at different time points±s, μg/L)
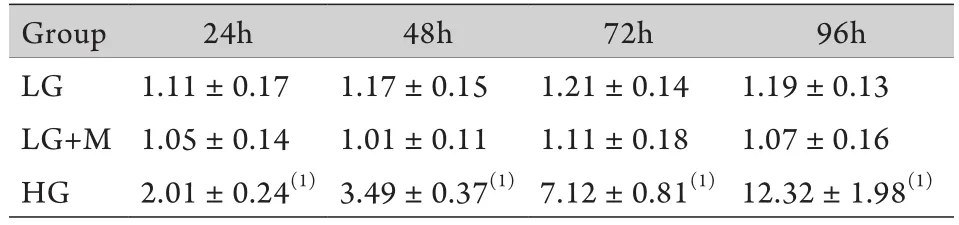
表1 不同时间点系膜细胞培养上清液中Ⅳ型胶原浓度(±s,μg/L)Tab.1 Concentration of collagen Ⅳ in the supernatants of GMCs at different time points±s, μg/L)
(1)P<0.01 compared with LG group and LG+M group
Group24h48h72h96h LG1.11±0.171.17±0.151.21±0.141.19±0.13 LG+M1.05±0.141.01±0.111.11±0.181.07±0.16 HG2.01±0.24(1)3.49±0.37(1)7.12±0.81(1)12.32±1.98(1)
3 讨 论
肾小球系膜增生和扩张是DN的重要标志,并且系膜扩张程度与DN患者的肾功能和临床症状密切相关。系膜扩张的主要原因是系膜基质合成、降解失衡。肾小球系膜细胞是肾小球中功能最活跃的细胞,具有合成细胞外基质、分泌细胞因子的功能,并能吞噬和清除异物,对于维持肾脏的正常组织结构和生理功能发挥着重要作用。早前一些体外研究显示,高糖可诱导多种ECM成分的基因表达和蛋白合成[5-6]。近年来一些体内和体外实验都提示DN中ECM降解过程受到抑制,且这种抑制现象与系膜细胞合成和分泌MMPs的功能异常有关[7-9]。多数体外实验显示高糖、血管紧张素Ⅱ(AngⅡ)、糖基化终产物(AGEs)和TGF-β1等刺激均可抑制系膜细胞MMP-9的表达和活性[10-13]。但是上述刺激因素对系膜细胞MMP-2及其相关抑制因子和激活因子的作用如何则报道不一,甚至相悖[9-15]。本实验通过动态观察高糖刺激对系膜细胞MMP-2的表达与活性的影响,发现高糖刺激对MMP-2的表达和活性的影响随刺激时间的不同而变化。高糖刺激24h,系膜细胞MMP-2的基因表达、蛋白合成与酶活性均有小幅度增高,随后从48h至96h MMP-2在转录、转录后翻译和活化三个水平上均持续下降。与此同时系膜细胞分泌Ⅳ型胶原的量从24h开始增加,且持续增高至96h。这种在高糖刺激早期MMP-2的表达与活性上调现象的调节机制目前还不清楚,可能与高糖刺激系膜细胞ECM合成增多引起反馈性MMP-2表达上调有关[16],也可能与DN早期肾小球基底膜损伤和ECM重构有关[17]。这种系膜细胞MMP-2与Ⅳ型胶原变化大致反向平行的现象提示系膜基质降解减少可能是导致DN中肾小球系膜扩张和硬化的原因之一。
本实验还同时观察了高糖刺激对系膜细胞MT1-MMP、TIMP-2表达的影响,发现在低糖培养下肾小球系膜细胞有一定水平的MT1-MMP的表达,高糖刺激后,从24h开始MT1-MMP表达降低,并随刺激时间延长持续降低。TIMP-2的变化则与MT1-MMP相反。从高糖刺激24h开始系膜细胞表达TIMP-2明显升高,并随刺激时间延长持续增高。MT1-MMP和TIMP-2 均参与MMP-2转录后的活性调节。MT1-MMP是MMP-2的特异膜型激活剂,主要表达于系膜细胞的胞膜部位,同时在胞质中也存在一定量可溶形式的MT1-MMP[18]。TIMP-2是MMP-2的特异组织抑制物,通过与MMP-2特异结合而阻止其对底物的降解作用。MT1-MMP和TIMP-2在系膜细胞的变化趋势提示二者的异常变化可能是DN中MMP-2活性下降的原因之一。
目前研究普遍认为CTGF是TGF-β1最重要的下游效应因子[19],具有调节ECM代谢、促细胞增殖、迁移和诱导上皮-间质转化的作用[20-21]。有体外研究显示CTGF除具有促进ECM合成的作用外,还具有抑制基质成分降解的作用,这一作用部分通过抑制MMP-2的活化而实现[15]。本实验在观察高糖对系膜细胞MMP-2/TIMP-2和MT1-MMP的影响的同时,还检测了系膜细胞中CTGF的表达变化。结果显示高糖刺激使CTGF表达明显增高,并且同系膜细胞分泌Ⅳ型胶原的变化趋势相一致,与MMP-2的变化大致相反。此结果提示CTGF可能参与调节DN中ECM的降解过程。
总之,正常情况下系膜细胞、细胞因子、MMPs、MT1-MMP、TIMPs和ECM之间相互制约,使ECM 的合成和降解处于一个动态平衡,但当高糖存在时,这种正常的制约和平衡遭到破坏,最终导致ECM合成增加和(或)降解减少,引起系膜细胞ECM堆积,这是糖尿病肾病的病理基础。
[1] Molitch ME, DeFronzo RA, Franz MJ,et al. Diabetic nephropathy[J]. Diabetes Care, 2003, 26 (Suppl 1): S94-S98.
[2] Thrailkill KM, Clay Bunn R, Fowlkes JL. Matrix metalloproteinases: their potential role in the pathogenesis of diabetic nephropathy[J]. Endocrine, 2009, 35(1): 1-10.
[3] Li M, Wang JS, Liu DW. Effect of mycophenolate mofetil on insulin-like growth factor-1 and matrix metalloproteinase-2 in the kidneys of diabetic rats[J]. J Zhengzhou Univ (Med Sci), 2013, 48(1): 77-80. [李敏, 王建生, 刘东伟. 霉酚酸酯对糖尿病大鼠肾组织中IGF-1、MMP-2 表达的影响[J]. 郑州大学学报(医学版), 2013, 48(1): 77-80.]
[4] Wang H, Zhao ZZ, Shen WQ,et al. Expressions of HIF-1α and CTGF in peritoneum of peritoneal dialysis rats[J]. J Zhengzhou Univ (Med Sci), 2012, 47(2): 205-208. [王红, 赵占正, 申万琴,等. 腹膜透析大鼠腹膜组织中HIF-1α和CTGF的表达[J]. 郑州大学学报(医学版), 2012, 47(2): 205-208.]
[5] Wang LH, Wu GL, Zhang LX,et al. p38 MAPK pathway in highglucose induced activation of rat mesangial cells[J]. Med J Chin PLA, 2009, 34(2): 196-199. [王丽晖, 吴广礼, 张丽霞, 等. p38 MAPK信号途径在高糖诱导的大鼠肾系膜细胞中激活的意义[J]. 解放军医学杂志, 2009, 34(2): 196-199.]
[6] Zhang D, Shao S, Shuai H,et al. SDF-1α reduces fibronectin expression in rat mesangial cells induced by TGF-β1 and high glucose through PI3K/Akt pathway[J]. Exp Cell Res, 2013, 319(12): 1796-1803.
[7] Takamiya Y, Fukami K, Yamagishi S,et al. Experimental diabetic nephropathy is accelerated in matrix metalloproteinase-2 knockout mice[J]. Nephrol Dial Transplant, 2013, 28(1): 55-62.
[8] Solini A, Rossi C, Santini E,et al. Angiotensin-II and rosuvastatin influence matrix remodeling in human mesangial cellsviametalloproteinase modulation[J]. J Hypertens, 2011, 29(10): 1930-1939.
[9] Yang XJ, Wang ZH, Li HC,et al. Correlation between matrix metalloproteinase-9 and Cystatin Cat the early stage of diabetic nephropathy[J]. Med J Chin PLA, 2006, 31(4): 346-348. [杨小洁, 王志慧, 李海潮, 等. 糖尿病肾病早期基质金属蛋白酶-9与Cystatin C的相关性[J]. 解放军医学杂志, 2006, 31(4): 346-348.]
[10] McLennan SV, Kelly DJ, Cox AJ,et al. Decreased matrix degradation in diabetic nephropathy: effects of ACE inhibition on the expression and activities of matrix metalloproteinases[J]. Diabetologia, 2002, 45(2): 268-275.
[11] Dong FQ, Li H, Wu F,et al. Effects of overexpression of decorin on matrix metalloproteinases 2 and 9 in rat mesangial and tubular cells[J]. Zhonghua Yi Xue Za Zhi, 2008, 88(48): 3444-3447.
[12] Ohtomo S, Nangaku M, Izuhara Y,et al. The role of megsin, a serine protease inhibitor, in diabetic mesangial matrix accumulation[J]. Kidney Int, 2008, 74(6):768-774.
[13] Sun SZ, Wang Y, Li Q,et al. Effects of benazepril on renal function and kidney expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 in diabetic rats[J]. Chin Med J (Engl), 2006, 19(10): 814-821.
[14] Lee MP, Sweeney G. Insulin increases gelatinase activity in rat glomerular mesangial cellsviaERK- and PI-3 kinase-dependent signaling[J]. Diabetes Obes Metab, 2006, 8(3): 281-288.
[15] McLennan SV, Wang XY, Moreno V,et al. Connective tissue growth factor mediates high glucose effects on matrix degradation through tissue inhibitor of matrix metalloproteinase type 1: implications for diabetic nephropathy[J]. Endocrinol, 2004, 145(12): 5646-5655.
[16] Corcoran ML, Hewitt RE, Kleiner DE,et al. MMP-2: expression, activation and inhibition[J]. Enzyme Protein, 1996, 49(1-3): 7-19.
[17] Keeling J, Herrera GA. Matrix metalloproteinases and mesangial remodeling in light chain-related glomerular damage[J]. Kidney Int, 2005, 68(4): 1590-1603.
[18] Yao M, Zeng S, Tu Y,et al. Changes of expression and activity of renal matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases in the stroke-prone spontaneously hypertensive rats[J]. J Logist Univ CAPF (Med Sci), 2013, 22(3): 161-165. [姚旻, 曾山, 涂悦, 等. 高血压大鼠肾脏基质金属蛋白酶及组织型基质金属蛋白酶抑制剂表达与活性的变化[J]. 武警后勤学院学报(医学版), 2013, 22(3): 161-165.]
[19] Boor P, Floege J. Chronic kidney disease growth factors in renal fibrosis[J]. Clin Exp Pharmacol Physiol, 2011, 38(7): 391-400.
[20] Russo JW, Castellot JJ. CCN5: biology and pathophysiology[J]. J Cell Commun Signal, 2010, 4(3): 119-130.
[21] Mason RM. Connective tissue growth factor (CCN2), a pathogenic factor in diabetic nephropathy. What does it do? How does it do it[J]? J Cell Commun Signal, 2009, 3(2): 95-104.
Expression of MMP-2, TIMP-2, CTGF and MT1-MMP in rat glomerular mesangial cells stimulated by high-glucose and its significance
YAO Fang1, LI Zhi-hong2, YAN Zhe1, LIU Qing-juan1, DUAN Hui-jun1, QIE Tao21Department of Pathology, Hebei Medical University, Shijiazhuang 050017, China
2Department of Endocrinology, First Central Hospital of Baoding City, Baoding, Hebei 071000, China
This work was supported by the Youth Foundation of Education Department of Hebei Province (2010150)
ObjectiveTo observe the dynamic changes of matrix metalloproteinase-2 (MMP-2), tissue inhibitor of metalloproteinase-2 (TIMP-2), membrane-type 1 matrix metalloproteinase (MT1-MMP) and connective tissue growth factor (CTGF) expression in high glucose-stimulated glomerular mesangial cells (GMCs) in rats, and investigate the mechanism of the pathogenesis of diabetic nephropathy.MethodsRat HBZY-1 GMCs were cultured and divided into 3 groups: low concentration (5.5mmol/L) D-glucose (LG) group, high concentration (30mmol/L) D-glucose (HG) group and 24.5mmol/L mannitol plus 5.5mmol/L D-glucose (LG+M) group (served as osmotic pressure control). The mRNA and protein expressions of MMP-2, TIMP-2, MT1-MMP and CTGF were detected with semi-quantitative RT-PCR and Western blotting, and the secreted collagen Ⅳin supernatants of the GMCs was detected by ELISA after cultured for 24, 48, 72 and 96h.ResultsCompared with LG group, after exposure to high glucose for 24h, MMP-2 expression was slightly increased (increased by 10%±4%) in GMCs in HG group (P<0.05). But when the exposure time last from 48h to 96h, the expression of MMP-2 was decreased by 42%±2% to 78%±2%(P<0.01). Compared with LG group, high-glucose incubation resulted in down-regulation of MT1-MMP (decreased by 29%±3% at 24h to 78%±9% at 96h,P<0.01) whereas up-regulation of TIMP-2 (increased by 55%±3% at 24h,P<0.01) and CTGF (increased by 201%±24% at 24h to 484%±51% at 96h,P<0.01). RT-PCR revealed consistent dynamic changes of MMP-2, TIMP-2, MT1-MMP and CTGF with their protein changes listed above. Compared with LG group, the secreted collagen Ⅳ in supernatants of HG group was increased by 201%±24% at 24h to 1232%±198% at 96h (P<0.01). There was no significant difference of above indexes between LG group and LG+M group.ConclusionsHigh glucose may induce and activate MMP-2 transiently, but can inhibit the expression of MMP-2 and MT1-MMP for a long term whereas induce the expressions of TIMP-2 and CTGF in GMCs. MMP-2, TIMP-2, MT1-MMP and CTGF may contribute to the metabolism imbalance of extracellular matrix then induce the accumulation of extracellular matrix in diabetic nephropathy.
diabetic nephropathy; glomerular mesangial cells; metalloproteinase-2; tissue inhibitor of metalloproteinase-2; connective tissue growth factor; membrane-type 1 matrix metalloproteinase
R587.1
A
0577-7402(2013)10-0811-07
10.11855/j.issn.0577-7402.2013.10.006
2013-05-14;
2013-07-15)
(责任编辑:张小利)
河北省教育厅青年基金(2010150)
姚芳,医学博士。主要从事糖尿病肾病基础医学研究
050017 石家庄 河北医科大学基础医学院病理教研室(姚芳、闫喆、刘青娟、段惠军);071000 河北保定 保定市第一中心医院内分泌科(李志红、郄涛)