外源性apelin-13对心肌梗死大鼠心肌干细胞的动员作用观察
2013-08-08郑楠张宁坤高连如徐小红王力朱智明
郑楠,张宁坤,高连如,徐小红,王力,朱智明
外源性apelin-13对心肌梗死大鼠心肌干细胞的动员作用观察
郑楠,张宁坤,高连如,徐小红,王力,朱智明
目的探讨给予外源性apelin-13对急性心肌梗死(AMI)后大鼠心脏的保护作用及其可能机制。方法SD大鼠随机分为3组,即假手术组(n=6)、对照组(AMI+生理盐水,n=12)和实验组(AMI+apelin-13,n=12),其中对照组死亡4只,实验组死亡5只,其余对照组和实验组大鼠于冠脉结扎术后5min内分别向心肌内注射生理盐水20μl或apelin-13 0.2μg/20μl,假手术组大鼠仅开胸,未进行冠脉结扎也未进行药物注射。采用超声心动图和心肌梗死面积测定来评价心脏功能的变化。采用免疫组化染色法检测心肌组织C-kit、Flk1、Sca1蛋白阳性表达情况,Western blotting和Real Time-PCR法定量检测前述蛋白和mRNA的表达情况。结果超声心动图及心肌梗死面积测定结果显示实验组大鼠心功能较对照组有所改善(左室射血分数:实验组为68.43%±2.06%,对照组为46.40%±15.18%;左室短轴缩短率:实验组为33.70%±1.55%,对照组为20.73%±8.14%;梗死心肌面积百分比:实验组为16.10%±3.08%,对照组为33.83%±5.64%),差异均有统计学意义(P<0.05)。免疫组化染色显示,假手术组心肌组织C-kit、Flk1、Sca1表达呈阴性,实验组和对照组染色呈阳性或强阳性。Western blotting和RT-PCR方法检测结果显示,实验组C-kit、Flk1、Sca1蛋白及mRNA表达较对照组明显增加(蛋白水平:C-kit 0.48±0.17vs1.05±0.08,Flk1 0.40±0.26vs0.88±0.10,Sca1 0.39±0.08vs0.70±0.08,P<0.05;mRNA水平:C-kit 2.89±1.89vs18.77±14.19,Flk1 2.14±0.95vs4.59±0.92,Sca1 4.32±2.44vs29.39±11.90,P<0.05),而假手术组C-kit、Flk1、Sca1蛋白无明显表达。结论外源性apelin-13蛋白对心肌梗死大鼠具有保护作用,其机制可能与刺激内源心肌干细胞的分裂增殖有关。
apelin;心肌干细胞;心肌梗死
尽管心衰的治疗近年来取得了较大进展,但仍是心血管病第一位的死亡原因。近来新发现的心血管活性肽apelin-13具有降低血压、增强心肌收缩力、促进新生血管生成、抑制细胞凋亡、调节水盐及脂肪代谢等作用[1],且实验证实其对急性缺血再灌注损伤及心梗后心衰的动物模型也具有保护作用,但其作用机制仍不十分清楚[2-4]。既往研究发现,在体外诱导骨髓间充质干细胞向心肌细胞分化的过程中,apelin/APJ信号通路可发挥重要调控作用[5-6],但apelin在体内是否也可介导心肌干细胞(cardiac stem cells,CSCs)动员,参与心肌保护及限制心室重构,从而改善心功能,目前国内外研究报道较少。
随着细胞移植技术和相关分子生物学技术的发展,已发现在人和动物的心脏组织中有少量的CSCs。目前认为CSCs是指细胞膜上能够表达一种或多种干细胞相关抗原,如干细胞因子受体(C-kit)、干细胞抗原1(Sca-1)等多能干细胞表面标志,而且CSCs能在一定条件下分化为各种心肌细胞的未分化细胞[7]。Flk1是内皮细胞和侧板中胚层的早期标志,Flk1+胚胎干细胞可分化为心肌细胞、内皮细胞和壁细胞,三维培养可形成血管[8],Flk1+诱导多能干细胞具有与Flk1+胚胎干细胞相同的心肌、血管分化潜能[9]。由此可见,Flk1+干细胞为心血管前体细胞,Flk1可作为干细胞中心血管前体细胞的表面标志。本实验拟通过结扎大鼠冠状动脉前降支建立急性心肌梗死(acute myocardial infarction,AMI)模型,观察外源性输入apelin-13是否对AMI大鼠具有保护作用,并进一步检测apelin对CSCs(以C-kit+、Sca1+、Flk1+为标准)的影响。
1 材料与方法
1.1 动物模型与分组 健康雄性SD大鼠30只,体重250±20g,由军事医学科学院实验动物中心提供。按照摸球法随机分为3组:假手术组6只,对照组12只,实验组12只。其中对照组和实验组的24只大鼠采取冠状动脉结扎法制作急性心肌梗死模型,术中及术后对照组死亡4只,实验组死亡5只,最后对照组为8只,实验组为7只。具体建模方法:以盐酸氯胺酮20mg/kg、速眠新Ⅱ 0.2mg/kg进行肌肉注射麻醉。呼吸机设置为容量控制模式,潮气量10~15ml/250g体重,呼吸频率为50~60次/min,吸呼比为1:1,通气量为潮气量+1ml。开胸后,分离胸膜,在左心耳下缘、肺动脉圆锥水平结扎左前降支。造模成功的标准为:心电图标准肢体导联Ⅱ导联ST段呈弓背型抬高;结扎动脉远端心肌出现苍白。假手术组大鼠仅开胸未行冠脉结扎,也未行药物注射。实验组大鼠在AMI手术完成后5min之内从缺血梗死心肌周围0、3、6、9点钟4个方向共注入0.2μg(20μl) apelin-13;对照组以同样方法注入生理盐水20μl。各组术后连续3d肌内注射青霉素40万U,注意保温(至少12h),统一给予标准饲料及饮水。
1.2 主要试剂 Apelin-13(Santa Cruz公司);一抗兔抗大鼠Sca1、Flk1(北京百事创新科技有限公司),一抗兔抗大鼠C-kit、内参β-actin(北京博奥森生物技术公司);蛋白提取试剂盒、蛋白定量试剂盒(北京奥博来生物技术公司),ECL发光试剂盒(北京康为世纪生物技术有限公司);SP免疫组化试剂盒、DAB显色试剂盒(河北博海生物工程有限公司);Trizol(南京凯基生物科技有限公司),RTPCR反转录试剂盒、SYBR Premix ExTaqTMⅡ(Tli RNaseH Plus) (大连宝生物公司);TTC染液(南京建成科技有限公司)。
1.3 心脏标本的处理 建模后2周,每组随机取3只大鼠行经胸超声心动图检查,而后采取颈椎脱臼法处死,开胸剪取心脏,剔除血管脂肪等非心肌组织,用冷生理盐水冲洗,放入-20℃冰箱速冻,用于心肌梗死面积检测。再以同样方法处理剩余大鼠的心脏标本(其中假手术组3只、对照组5只、实验组4只),然后每只心脏标本沿梗死心肌边缘用消毒剪将梗死心肌剪成若干黄豆大小的组织块,用锡纸将剪好的组织块包被后迅速置于液氮中冻存,以备后续用于Western blotting和Real Time-PCR检测;再将剩余的心脏标本用4%甲醛固定,以备后续用于免疫组化检测。
1.4 大鼠心脏功能的检测 采用SEUIA512彩色多普勒超声仪(SIEMENS)检测。检测指标为:左室射血分数(ejection fraction,EF)、左室舒张末径(left ventricular end-diastolic diameter,LVEDd)、左室收缩末径(left ventricular end-systolic diameter,LVEDs)及左室短轴缩短率(fractional shortening,FS)。各组原始数据均取自3个连续心动周期的平均值。
1.5 TTC染色检测心肌梗死面积 将心脏标本放入-20℃冰箱速冻20min后,沿与心脏长轴垂直方向自心尖向心底连线中点处行2~3mm的心室组织切片,将切片置于TTC染液中,放入37℃温箱避光染色20min,非梗死区染色呈红色,梗死区呈灰白色。Olympus数码相机拍照,然后采用PhotoShop图像分析系统测量心室及梗死区面积,计算梗死面积百分比。梗死面积(%)=心室组织切片梗死区面积/心室组织切片总面积×100%。
1.6 免疫组化检测心肌组织C-kit、Flk1、Scal蛋白的表达 将用4%甲醛固定的心脏标本取出,石蜡包埋,5μm连续切片,二甲苯脱蜡,梯度乙醇水化,0.01mol/L枸橼酸钠缓冲液抗原热修复,正常山羊血清封闭液室温封闭20min;加一抗(抗体稀释比例为1:80),4℃孵育过夜;加二抗,37℃孵育20min;加入辣根过氧化物酶(HRP)37℃孵育20min;DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封固,光镜下观测并拍照。染色结果根据阳性细胞染色强度及阳性细胞百分数进行分级。阳性细胞百分数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,≥75%为4分;细胞染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性强度为两种计分的乘积:0~2分为阴性(–)、3~5分为弱阳性(+)、6~8分为阳性()、9~12分为强阳性()。结果判定由两位病理科医师分别进行,取平均值。
1.7 Western blotting检测各组心肌组织C-kit、Flk1、Sca1蛋白表达 取冻存组织,液氮研磨,迅速加入120μl TSB,冰上继续研磨均匀,将研磨产物转入1.5ml离心管,4℃、12 000r/min离心5min,取上清于新的灭菌管。用Bradford法(北京奥博来公司蛋白定量试剂盒)定量蛋白,每个样品取900μg,调整体积至60μl,加入1/5体积6×上样缓冲液,混匀,置于沸水浴10min,取出,4℃、12 000r/min离心5min,然后将每个样品(60μl)进行上样(检测β-actin、Flk1时每个样品取10μl;检测C-kit、Sca1时每个样品取20μl),上样后电泳,各泳道分别加彩色预染Marker及样品蛋白进行SDS-PAGE电泳,NC膜湿转,加一抗(抗体稀释比例C-kit、Flk1、Sca1为1:200,β-actin为1:1000),4℃孵育过夜,二抗室温孵育2h,超敏ECL化学发光、显影、定影。BandScan软件分析结果条带。以C-kit、Flk1、Sca1蛋白与β-actin蛋白条带灰度比值进行半定量分析。
1.8 Real Time-PCR检测心肌组织C-kit、Flk1、Sca1 mRNA的表达 按照Trizol试剂盒说明书提取组织总RNA,采用TaKaRa公司反转录试剂盒合成cDNA。采用Bio-Rad进行扩增反应,总反应体系25μl。扩增条件:95℃ 30s;95℃ 5s,60℃ 60s,共40个循环。引物由上海生工生物工程公司设计并合成。相关引物序列如下:C-kit上游引物5'-AGCAAGAGTTAACGATTCCGGAG-3',下游引物5'-CCAGAAAGGTGTAAGTGCCTCCT-3',扩增长度344bp;Flk1上游引物5'-CCTGGCGATTTTCTCCAT C-3',下游引物5'-CATTCAGTCACCAATACCCTTT CC-3',扩增长度162bp;Sca1上游引物5'-CTAGAGA ACCCACGGGGAGA-3',下游引物5'-TCTCACGTTT CTTGGGAGGC-3',扩增长度195bp;GAPDH上游引物5'-GACATGCCGCCTGGAGAAAC-3',下游引物5'-AGCCCAGGATGCCCTTTAGT-3',扩增长度92bp。扩增结束后读取Ct值,结果以2-ΔΔCt法表示,分析实验组与对照组C-kit、Flk1、Sca1 mRNA的表达差异。
1.9 统计学处理 采用SPSS 13.0软件进行统计分析。数据结果均以表示。多组间样本均数比较采用单因素方差分析,进一步两两比较采用SNK-q检验;两组样本均数比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 彩色多普勒超声测量结果 对照组大鼠的LVEDs显著高于假手术组(P<0.05),而EF和FS显著低于假手术组(P<0.05),表明心肌梗死后大鼠心腔明显扩大,且心功能明显下降;实验组大鼠的LVEDs较对照组明显降低(P<0.05),EF和FS明显增加(P<0.05),但与假手术组比较无明显差异(表1)。
2.2 大鼠心肌梗死面积的测定 利用图像分析系统测定心室梗死区面积与心室总面积比发现:实验组和对照组大鼠心肌梗死面积与假手术组比较明显增加(P<0.05);实验组大鼠心肌梗死面积与对照组相比明显减少(P<0.05,表1、图1)。
表1 各组大鼠心功能及梗死面积比较(±s,n=3)Tab.1 Comparison of rat cardiac function and infarct size in each group (±s,n=3)
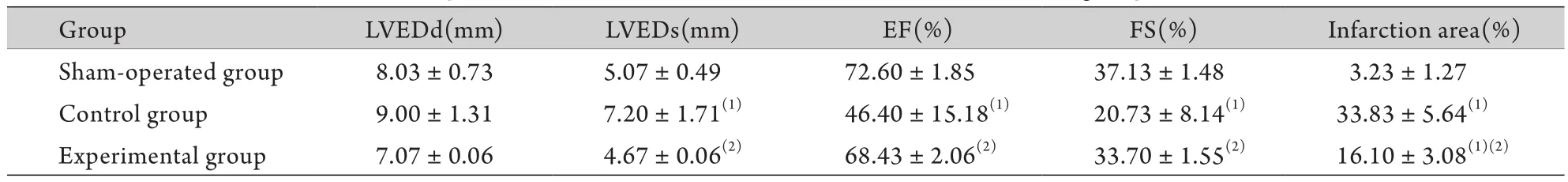
表1 各组大鼠心功能及梗死面积比较(±s,n=3)Tab.1 Comparison of rat cardiac function and infarct size in each group (±s,n=3)
LVEDd. Left ventricular end-diastolic diameter; LVEDs. Left ventricular end-systolic diameter; EF. Left ventricular ejection fraction; FS. Left ventricular fractional shortening. (1)P<0.05 compared with sham-operated group; (2)P<0.05 compared with control group
GroupLVEDd(mm)LVEDs(mm)EF(%)FS(%)Infarction area(%) Sham-operated group8.03±0.735.07±0.4972.60±1.8537.13±1.483.23±1.27 Control group9.00±1.317.20±1.71(1)46.40±15.18(1)20.73±8.14(1)33.83±5.64(1)Experimental group7.07±0.064.67±0.06(2)68.43±2.06(2)33.70±1.55(2)16.10±3.08(1)(2)
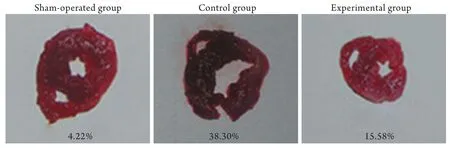
图1 各组大鼠心肌梗死面积检测结果Fig.1 Rat myocardial infarct size of each group
2.3 免疫组化染色结果 C-kit阳性着色位于胞膜和(或)胞质,Flk1、Sca1阳性着色位于胞膜和胞质中,呈淡黄色至棕黄色颗粒状。假手术组C-kit、Flk1、Sca1免疫组化染色呈阴性,实验组和对照组中C-kit、Flk1、Sca1染色阳性的细胞数量较假手术组明显增多,呈阳性或强阳性(图2)。
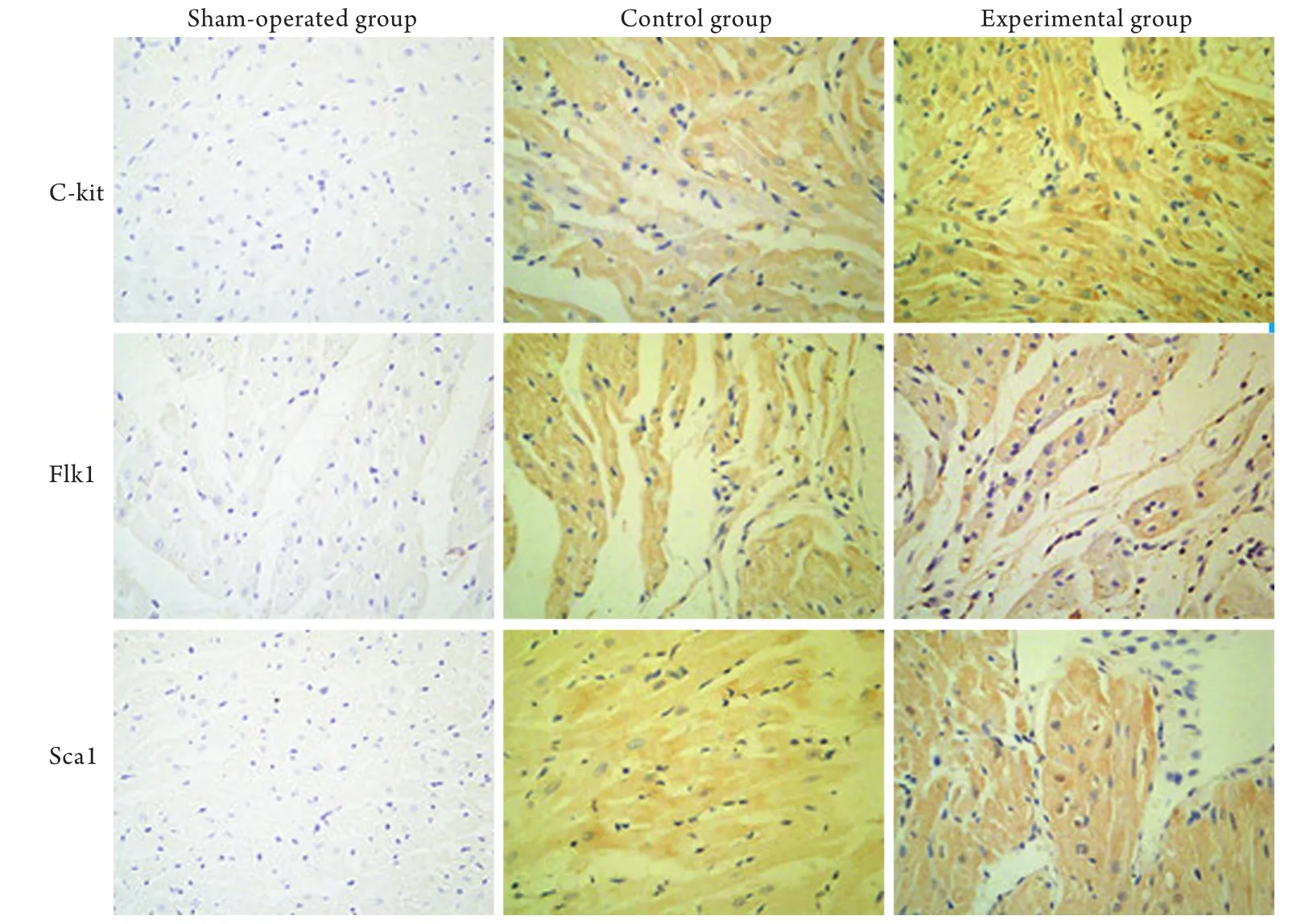
图2 各组大鼠心肌组织C-kit、Flk1、Sca1免疫组化染色结果(×400)Fig.2 C-kit, Flk1 and Sca1 expression in rat myocardial tissue detected by immunohistochemistry (×400)
2.4 Western blotting检测结果 实验组及对照组C-kit、Flk1、Sca1蛋白表达明显高于假手术组(P<0.05),且实验组C-kit、Flk1、Sca1蛋白表达明显高于对照组(P<0.05),假手术组C-kit、Flk1、Sca1蛋白基本不表达(图3)。
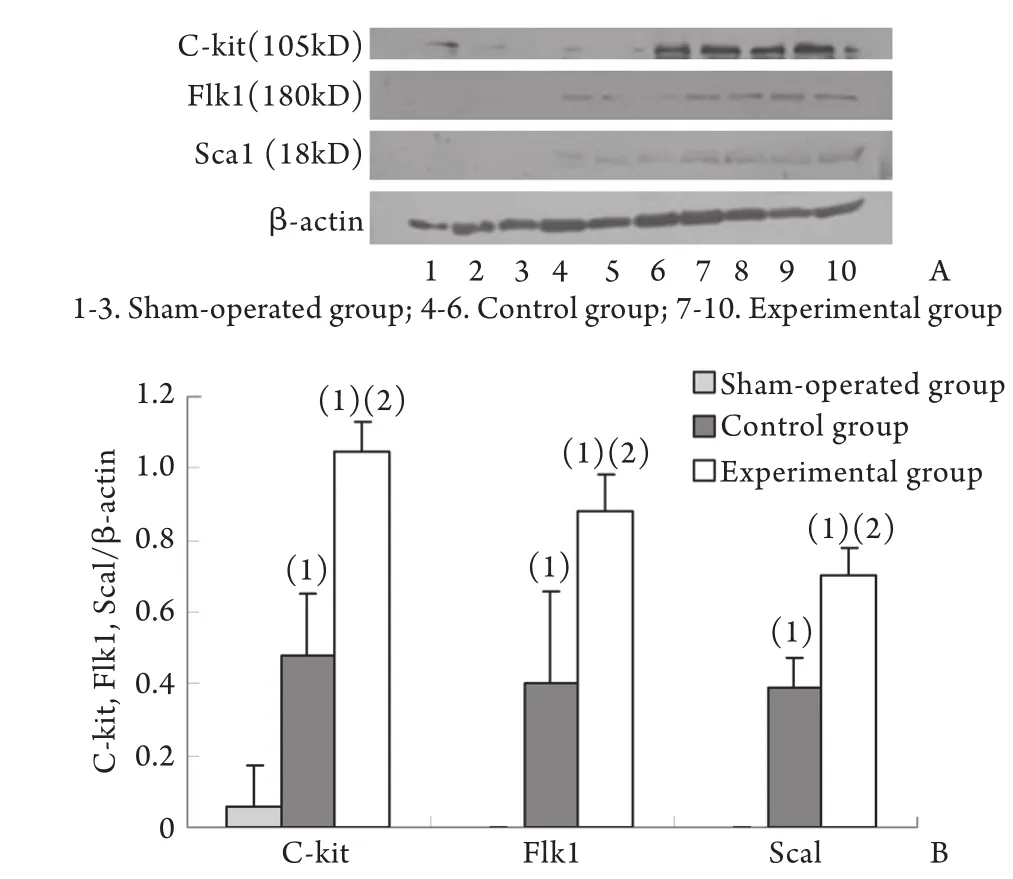
图3 C-kit、Flk1、Sca1蛋白表达水平的检测结果Fig.3 Expression of C-kit, Flk1 and Sca1 protein detected by Western blotting
2.5 Real Time-PCR检测结果 实验组C-kit、Flk1、Sca1 mRNA表达水平分别为18.77±14.19、4.59±0.92、29.39±11.90,与对照组(分别为2.89±1.89、2.14±0.95、4.32±2.44)相比均明显增加(t值分别为-2.519、-3.899、-4.143,P<0.05或P<0.01)。
3 讨 论
Apelin是1998年日本学者Tatemoto等[10]利用孤儿受体策略,以反向药理学方法从牛胃组织提取物中分离出的一种小分子多肽,为G蛋白偶联受体APJ(angiotensin Ⅱ protein J,APJ)的内源性配体。现已纯化的有apelin-10、11、12、13、15、17、19、28、36等多种肽,不同的肽片段具有不同的生物学效应,其中apelin-13生物活性可能最强。Apelin/ APJ信号与血管紧张素Ⅱ/血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1,AT1)信号系统分布相似,具有调节免疫、降低血压、增强心肌收缩力、保护心肌损伤、促进新生血管生成、抑制细胞凋亡、调节水盐及脂肪代谢等作用。研究证实apelin对于急性缺血再灌注损伤及心肌梗死后心衰的动物模型都具有保护作用[2-4,11],其机制与抑制细胞凋亡和促进血管生成有关[2],但对于apelin促进心脏结构和功能修复的详细机制仍有待进一步研究。
近年研究发现,apelin/APJ信号通路在心血管定向分化中具有极其重要的作用。干预apelin/APJ表达会影响青蛙胚胎的心脏发育;在斑马鱼胚胎中,如局部apelin缺乏,则心脏前体细胞不能到达特定的生心区(胚胎前侧中胚叶区域);另外,Cripto-/-鼠胚胎干细胞(ESCs)中几乎测不出apelin/ APJ表达,而且不会分化成心肌细胞,但通过基因转染过表达APJ可促使Cripto-/-ESCs向心肌细胞分化[12-13]。Gao等[5]研究发现,成体骨髓间充质干细胞(BMSCs)向心肌细胞分化过程中有APJ受体及其配体apelin表达,且在分化过程表达水平呈动态增高,证实了该信号通路也具有调节成体干细胞向心肌细胞分化的作用。Li等[14]采用免疫荧光标记及流式细胞分选技术进行研究发现,在小鼠心肌梗死模型中,腹腔注射apelin-13可以使体内具有心肌血管内皮定向分化潜能的祖细胞群增加,并且造模2周后检测到梗死区心肌面积缩小,毛细血管密度增加,心功能得到改善。以上实验结果表明apelin/ APJ信号通路无论对于胚胎干细胞还是成体干细胞定向心血管分化都有调控作用。
本研究结果显示:在大鼠急性心肌梗死模型中,2周后检测实验组(心肌内直接注射外源apelin-13蛋白)心肌梗死区面积较对照组(心肌内直接注射生理盐水)有所减小,心功能与之相比也有所改善,表明给予外源性apelin-13可降低心肌梗死面积,并能够改善心脏功能,延缓心衰的进展,从而对心肌梗死大鼠起到保护作用,与国内外相关研究结果相一致[2-4]。免疫组化检测显示,实验组和对照组心肌组织C-kit、Flk1、Sca1染色阳性的细胞数量较假手术组明显增多,呈阳性或强阳性,而假手术组基本呈阴性,说明冠脉结扎对实验组和对照组大鼠CSCs产生了一定的刺激扩增作用。Western blotting和RT-PCR检测显示,CSCs表面标记物C-kit、Flk1、Sca1的蛋白和mRNA表达水平在实验组较对照组明显增加,而假手术组心肌组织中C-kit、Flk1、Sca1蛋白表达为阴性,与免疫组化检测结果一致,说明给予外源性apelin-13可促进CSCs的扩增。以上实验结果说明给予外源性apelin-13对心肌梗死大鼠具有一定的保护作用,并且这种保护作用与刺激内源心肌干细胞的分裂扩增密切相关。
目前认为应用特殊效应因子直接刺激动员体内CSCs较应用心脏活检组织体外分离、扩增CSCs然后植入到受损心脏部位的策略更适于临床,因为它可以避免细胞植入途径的选择、植入细胞存活率低以及宿主免疫排斥等问题[15],且目前已有一些研究证实诸如HGF、IGF-1、FGF-2和EGF等生长因子可影响CSCs的迁移、扩增及分化能力[16-18]。本研究显示apelin也可作为这样一种特殊效应因子,通过其分子机制及旁/自分泌效应介导动员体内CSCs的扩增。
综上所述,本研究结果表明,apelin作为成体干细胞定向心血管分化的调控因子,可以通过刺激体内CSCs的分裂扩增,达到促进受损心肌再生和心脏结构功能修复的目的。该结果既在整体水平上说明apelin是调控成体干细胞定向心血管分化的关键因子,又为可操控性理论提供了新的依据。
[1] Zhang Z, Yu B. Pathophysiologic effects of Apelin/APJ signal in cardiovascular system[J]. Int J Cardiovasc Dis, 2008, 35(5): 284-286. [张志, 于波. Apelin/APJ信号在心血管系统的生理和病理生理作用[J]. 国际心血管病杂志, 2008, 35(5): 284-286.]
[2] Zeng XJ, Zhang LK, Wang HX,et al. Apelin protects heart against ischemia/reperfusion injury in rat[J]. Peptides, 2009, 30(6): 1144-1152.
[3] Japp AG, Newby DE. The apelin-APJ system in heart failure: pathophysiologic relevance and therapeutic potential[J].Biochem Pharmacol, 2008, 75(10): 1882-1892.
[4] Simpkin JC, Yellon DM, Davidson SM,et al.Apelin-13 and apelin-36 exhibit direct cardioprotective activity against ischemia-reperfusion injury[J]. Basic Res Cardiol, 2007, 102(6): 518-528.
[5] Gao LR, Zhang NK, Bai J,et al. The apelin-APJ pathway exists in cardiomyogenic cells derived from mesenchymal stem cellsin vitroandvivo[J]. Cell Transplant, 2010, 19(8): 949-958.
[6] Xu XH, Wang L, Zhang NK,et al. Influence of apelin-13 on umbilical cord mesenchymal stem cells differentiate into the cardiac muscle cell induced by 5-azacytidine (5-aza)[J]. Med J Chin PLA, 2013, 38(10): 796-800. [徐小红, 王力, 张宁坤, 等. Apelin-13对5-aza诱导脐带间充质干细胞向心肌细胞分化的影响[J]. 解放军医学杂志, 2013, 38(10): 796-800.]
[7] Leri A, Kajstura J, Anversa P. Cardiac stem cells and mechanisms of myocardial regeneration[J]. Physiol Rev, 2005, 85(4): 1373-1416.
[8] Yang L, Soonpaa MH, Adler ED,et al. Human cardiovascular progenitor cells develop from a KDR1 embryonic-stem-cellderived population[J]. Nature, 2008, 453(7194): 524-528.
[9] Narazaki G, Uosaki H, Teranishi M,et al. Directed and systematic differentiation of cardiovascular cells from mouse induced pluripotent stem cells[J]. Circulation, 2008, 118(5): 498-506.
[10] Tatemoto K, Hosoya M, Habata Y,et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2): 471-476.
[11] Cao Y, Chen Y, Zhang NK,et al. Plasma apelin level and its clinical significance following autologous bone marrow mononuclear cell transplantation in patients with severe ischemic heart failure[J]. Med J Chin PLA, 2011, 36(7): 757-760. [曹毅, 陈宇, 张宁坤, 等. 自体骨髓单个核细胞移植治疗后重度缺血性心力衰竭患者血浆Apelin水平变化及其临床意义[J]. 解放军医学杂志, 2011, 36(7): 757-760.]
[12] D'Aniello C, Lonardo E, Iaconis S,et al. G protein-coupled receptor APJ and its ligand apelin act downstream of Cripto to specify embryonic stem cells toward the cardiac lineage through extracellular signal-regulated kinase/p70S6 kinase signaling pathway[J]. Circ Res, 2009, 105(3): 231-238.
[13] Zeng XX, Wilm TP, Sepich DS,et al. Apelin and its receptor control heart field formation during zebrafish gastrulation[J]. Dev Cell, 2007, 12(3): 391-402.
[14] Li L, Zeng H, Chen JX. Apelin-13 increases myocardial progenitor cells and improves repair postmyocardial infarction[J]. Am J Physiol Heart Circ Physiol, 2012, 303(5): 605-618.
[15] Zheng N, Zhang NK, Gao LR. Research progress of adult cardiac stem cells[J]. Med J Chin PLA, 2013, 38(4): 98-101. [郑楠, 张宁坤, 高连如. 成体心肌干细胞的研究进展[J]. 解放军医学杂志, 2013, 38(4): 98-101.]
[16] Rota M, Padin-Iruegas ME, Misao Y,et al. Local activation or implantation of cardiac progenitor cells rescues scarred infracted myocardium improving cardiac function[J]. Circ Res, 2008, 103(1): 107-116.
[17] Aghila Rani KG, Kartha CC. Effects of epidermal growth factor on proliferation and migration of cardiosphere-derived cells expanded from adult human heart[J]. Growth Factors, 2010, 28(3): 157-165.
[18] Rosenblatt-Velin N, Lepore MG, Cartoni C,et al. FGF-2 controls the differentiation of resident cardiac precursors into functional cardiomyocytes[J]. J Clin Invest, 2005, 115(7): 1724-1733.
Effect of exogenous apelin-13 on cardiac stem cell mobilization in rats with myocardial infarction
ZHENG Nan1, ZHANG Ning-kun2, GAO Lian-ru2, XU Xiao-hong2, WANG Li2, ZHU Zhi-ming2*
1Heart Center of Naval Clinical Medical College, Second Military Medical University, Beijing 100048, China
2Department of Cardiology, Navy General Hospital, Beijing 100048, China
*
, E-mail: zhuzhiming6542@sina.com
This work was supported by the National Natural Science Foundation of China (81170094)
ObjectiveTo explore the protective effect of exogenous apelin-13 on heart after acute myocardial infarction (AMI) in rats and its mechanism.MethodsSD rats were randomly divided into 3 groups: sham-operated group (n=6), control group (AMI + saline solution,n=12), experimental group (AMI + apelin-13,n=12). Four rats died in the control group, and five in the experimental group. The rest rats of both control and experimental groups underwent intramyocardial injection with saline solution 20μl and apelin-13 0.2μg/20μl within 5min after coronary artery ligation, respectively. The rats of sham-operated group underwent thoracic surgery without both coronary artery ligation and drug injection. Echocardiography was performed and myocardial infarct size was measured to evaluate the changes of cardiac function. Immunohistochemical staining method was used to detect the positive expression of C-kit, Flk1 and Sca1 in myocardial tissue. Western blotting and RT-PCR were used to quantitatively examine the expression levels of C-kit, Flk1 and Sca1 protein and mRNA in myocardial tissue.ResultsThe results of echocardiography and myocardial infarct size measurement showed that cardiac function of rats was improved more significantly in experimental group than in control group (EF: 68.43%±2.06% in experimental group and 46.40%±15.18% in control group; FS: 33.70%±1.55% in experimental group and 20.73%±8.14% in control group; infarction myocardial area percentage: 16.10%±3.08%in experimental group and 33.83%±5.64% in control group;P<0.05). Immunohistochemical staining of C-kit, Flk1 and Sca1 was negative in sham-operated group and positive or strong positive both in experimental group and control group. Western blotting and RT-PCR showed that the protein and mRNA expression of C-kit, Flk1 and Sca1 were significantly higher in experimental group than in control group (protein level: C-kit 0.48±0.17vs1.05±0.08, Flk1 0.40±0.26vs0.88±0.10, Sca1 0.39±0.08vs0.70±0.08,P<0.05; mRNA level: C-kit 2.89±1.89vs18.77±14.19, Flk1 2.14±0.95vs4.59±0.92, Sca1 4.32±2.44vs29.39±11.90,P<0.05), and there was no obvious expression of C-kit, Flk1 or Sca1 protein in sham-operated group.ConclusionExogenous apelin-13 protein has protective effect on rats against myocardial infarction, which is closely related to stimulating the proliferation of endogenous cardiac stem cells.
apelin; cardiac stem cells; myocardial infarction
R329.28;R331.31
A
0577-7402(2013)10-0801-06
10.11855/j.issn.0577-7402.2013.10.004
2013-06-04;
2013-07-15)
(责任编辑:张小利)
国家自然科学基金(81170094)
郑楠,主治医师,硕士研究生。主要从事干细胞的基础及临床研究工作
100048 北京 第二军医大学海军临床医学院心脏中心(郑楠);100048 北京 海军总医院心脏中心(张宁坤、高连如、徐小红、王力、朱智明)
朱智明,E-mail:zhuzhiming6542@sina.com