两种水生植物对滇池草海富营养化水体水质的影响
2013-08-03张志勇张君倩闻学政刘海琴严少华江苏省农业科学研究院农业资源与环境研究所江苏南京2004中国科学院测量与地球物理研究所环境与灾害监测评估湖北省重点实验室湖北武汉430077
王 智,张志勇,张君倩,闻学政,王 岩,刘海琴,严少华* (.江苏省农业科学研究院农业资源与环境研究所,江苏 南京 2004;2.中国科学院测量与地球物理研究所,环境与灾害监测评估湖北省重点实验室,湖北武汉 430077)
水体富营养化是当前水体污染面临的主要问题.目前在亚太地区,54%的湖泊水体富营养化,而在非洲、欧洲、北美和南美的湖泊中,富营养化的比例分别是28%,53%,48%和41%[1].我国的富营养化现象更为普遍,目前 66%以上的湖泊、水库处于富营养化的水平,以滇池、巢湖及太湖三大湖泊尤为严重,并且富营养化有加重的趋势[2].湖泊富营养化不仅对湖泊水质有严重影响,而且影响到周边水环境和人文景观,甚至通过给水系统危害到公众的健康.因此,水体富营养化治理成为当前世界的热点问题.
利用水生植物治理水体富营养化由于具有净化效果好、投资少,并且不产生二次污染等优点,越来受到人们的广泛重视和研究[3-7].水葫芦,学名“凤眼莲(Eichhornia crassipes)”,是一种典型的漂浮植物,生长快,去污能力强,被广泛应用于实际水体修复工程中[8-10].轮叶黑藻(Hydrilla verticillata),具有很强的分枝和营养繁殖能力,生存范围广,适应性强,是净化水体的优良沉水植物[11],广泛应用于水体修复的生态工程[12].关于水葫芦和轮叶黑藻对水体的净化效果已经有过一定的研究.例如,吴娟等[11]的模拟实验研究表明黑藻的生长能显著降低富营养化水体的氮磷水平;张志勇等[13]采用人工模拟试验方法,比较了水葫芦对 4种不同程度富营养化水体氮磷的净化效果和去除能力.然而在同一条件下对这 2种水生植物在富营养化水体中的净化差异却报道甚少.在实际的水生植物生态工程中,为了能有效地带走水体的营养物质,水生植物常常需要进行采收.但在先前的研究中,很少有人关注水生植物采收后水体水质的变化.
本文以滇池草海富营养化水体为研究对象,利用人工模拟的方法,比较了典型漂浮植物水葫芦和典型沉水植物轮叶黑藻在生长期和收获后,水体主要理化因子的变化.以期为合理利用两种水生植物净化富营养化湖泊水体提供参考依据.
1 材料与方法
1.1 水生植物来源
漂浮植物水葫芦采集于滇池草海入湖河道西坝河中,沉水植物轮叶黑藻采集于滇池草海(24°58'44.2''N; 102°37'57.7''E).
1.2 实验设计
试验于2011年7月9日至11月18日,在滇池草海西北岸(24°58'11.4''N;102°38'04.5''E)一个通风透光的挡雨棚中进行.试验容器为 9个约400 L塑料水箱,水箱长、宽、高分别为97、66和 76cm.在每个水箱中加入采集于滇池草海(24°58'44.2''N; 102°37'57.7''E)混合均匀的底泥,泥厚约 20cm,然后加入滇池草海西园隧道处混合均匀的水体约350L,静置4d后开始试验.开始试验前用自来水轻轻冲洗水生植物表层附着物及杂质,挑选长势及大小接近的株体用于试验.每个处理组水箱中加入水葫芦苗鲜重 0.6kg,轮叶黑藻鲜重 0.6kg.水葫芦直接投放在水体表面,轮叶黑藻均匀种植于水体,将根小心地插入底泥使之固定生长(尽可能不扰动底泥).试验分 3组,分别为空白对照组、水葫芦处理组和轮叶黑藻处理组,每组设置3个平行.在试验初始,测定水生植物体内氮磷含量.为了避免水分蒸发而引起试验误差,每天补充适当的自来水至初始水面.试验过程中气温为11~28.℃试验分2个阶段,第1阶段为水生植物种养期,探讨水生植物对水体理化因子的影响,第2阶段是水生植物收获后,探讨水生植物采收后水体理化因子的变化.在11:00~13:00间定期取样测定水体水温、溶解氧(DO)、pH值、电导率(EC)、氧化还原点位(Eh)、总磷(TP)、总氮(TN)及叶绿素(Chl-a)指标.于种植后约 80d时(2011年9月28日),将水生植物采收,采收前测定水体理化指标及水生植物生物量、体内氮磷含量.水葫芦采用人工直接移出水面的方式采收,而轮叶黑藻采用剪刀将其底泥以上部分剪断并将其移出水面的方式采收.在水生植物采收后约 50d后(2011年11月18日),取水样测定上述指标.
1.3 分析方法
DO、水温、pH值、EC及 Eh采用 YSI professional plus (USA)测定仪现场测定.TP及TN测定:水样在过硫酸钾 121℃消解 30min后,利用流动分析仪测定.Chl-a采用热乙醇法[14]测定.水生植物鲜重测定采用称重法,干重测定采用75℃恒温烘干后称重测定.株体中总氮、总磷采用浓H2SO4-H2O2消解法测定,测定方法详见《土壤农化分析》[15].
1.4 数据处理
所有数据均由均值±标准差表示.所有统计处理采用统计软件 SPSS 16.0.不同区域水质参数比较差异采用方差分析 LSD检验(利用Levene’s-test进行不同组间方差齐次性检验,若方差不齐,则进行倒数转换),显著性水平设置为P < 0.05.
2 结果
2.1 水温
在试验过程中,水体水温如图1所示.可以看出,在水生植物种养期(2011年7月9日至2011年 9月 28日),水体水温变化幅度较小,为 18.8~23.7℃范围波动,此温度较适宜水生植物生长.不同处理组间水温变化规律基本一致.
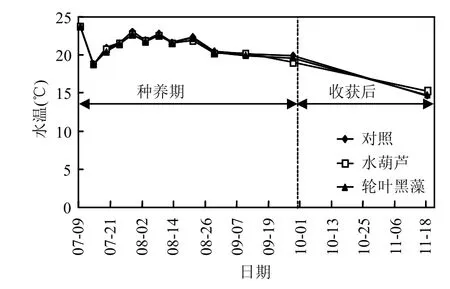
图1 实验过程中水体水温变化Fig.1 Changes of water temperature during the experiments
2.2 植物生物量及氮磷含量变化
2种水生植物在试验初始和采收期主要指标参数如表1所示.在试验开始的7月9日,水生植物初始放养量均为0.6kg.至9月28日采收时(生长约80d),水葫芦生物量达6.6kg,增长1000%,而轮叶黑藻生物量为1.1 kg,仅增长83%.两种水生植物的干物质含量在试验初期均显著性低于采收时期(P<0.05).在水葫芦植株中,干物质氮、磷浓度在试验初期均显著性高于采收期,而轮叶黑藻植株中仅氮的浓度在试验初期显著性高于采收期(P<0.05).通过植物生物量及植株氮磷浓度计算出水葫芦和轮叶黑藻在试验初期和采收期体内的氮磷含量见表1.由表1可知,水葫芦吸收同化作用带走系统中氮、磷分别为 3.64g和0.54g,而轮叶黑藻的吸收同化作用带走系统中氮磷分别为1.74g和0.46g.水葫芦吸收同化的氮、磷量分别是轮叶黑藻吸收同化量的 209%和117%.
2.3 水体DO与pH值变化
在水生植物种养期,第 5d后,对照组和轮叶黑藻处理组 DO较初始的 11.3mg/L下降至~8.0mg/L,之后在 5~11mg/L 的范围波动,均值为8.0mg/L(图2a),统计分析显示它们组间差异不显著(P>0.05);水葫芦处理组在水葫芦种养后 DO迅速下降,约 30d后下降至最低 2.3mg/L,之后缓慢上升,在种养期间统计分析显示水葫芦处理组DO含量显著低于对照组和轮叶黑藻处理组(P <0.05),但当水葫芦采收后,水体DO迅速上升至对照及轮叶黑藻处理组水平(图2a).
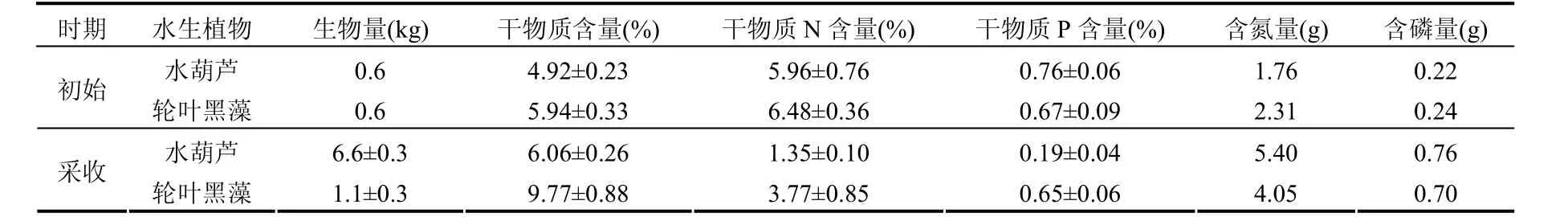
表1 水生植物生物量及体内氮磷含量Table 1 Biomass and nitrogen and phosphorus contents of two aquatic macrophytes (Eichhornia crassipes and Hydrilla verticillata)
对照组pH值从试验开始的9.0缓慢上升至试验结束时的 10.2;而在水葫芦种养后,水体 pH值从试验初始的9逐步下降至7.7,约20d后趋于稳定,但当水葫芦采收后,水体 pH值出现一定的反弹,达 9.8;在轮叶黑藻种植后,水体 pH 值在试验前15d内由9迅速上升至10.1,后趋于稳定,当其采收后,pH值出现一定程度的下降(图 2b).pH值在水生植物种养期间表现为:轮叶黑藻处理组>对照组>水葫芦处理组(P<0.05),而在水生植物收获后,水体 pH值基本能恢复到对照水平(P>0.05) (图 2b).
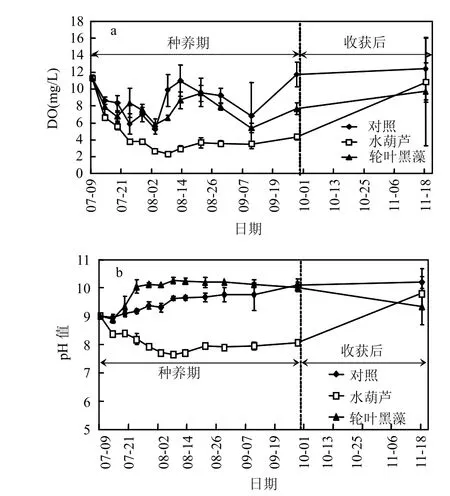
图2 试验过程中水体溶解氧及pH值的变化Fig.2 Changes of dissolved oxygen (DO) and pH in the water during the experiments
2.4 水体EC及Eh变化
对照组EC先上升后下降并趋于稳定(图3a).水葫芦处理组EC在试验初始(7月9日至8月8日),与对照组基本一致,之后(8月8日至9月10日)显著性高于对照组(P<0.05),在水葫芦收获后,水体EC迅速下降(图3a).轮叶黑藻处理组EC在试验的前 10d迅速下降,之后有所回升并趋于稳定,采收后,其水体电导率略有上升(P>0.05)(图3a).统计分析表明,在水生植物种养期,轮叶黑藻处理组水体EC显著性低于对照组和水葫芦处理组(P<0.05),而在水生植物收获后,水葫芦处理组显著性低于轮叶黑藻处理组(P<0.05) (图3a).
在水生植物种养期,对照组及处理组水体Eh均出现一定的波动(图 3b).轮叶黑藻处理组水体Eh略低于对照组(P>0.05),但显著性低于水葫芦处理组(P<0.05);水葫芦处理组Eh显著性高于对照组(P<0.05) (图3b).当水生植物收获后,处理组Eh基本恢复到对照组水平(图3b).

图3 试验过程中水体电导率及氧化还原电位的变化Fig.3 Changes of conductivity (EC) and redox potential(Eh) in the water during the experiments
2.5 水体TN及TP变化
模拟系统水体中,TN、TP的变化如图4所示.对照组TN浓度变化幅度为1.85~2.38mg/L,表现为先缓慢下降,后趋于平稳,最后缓慢上升的趋势.水葫芦处理组TN浓度从试验初始的2.23 mg/L逐步下降至8月13日的1.25mg/L,后小幅波动变化.轮叶黑藻处理组TN在试验初始迅速下降,由7月9日的2.23mg/L迅速下降至7月14日的1.52mg/L,之后下降速率变缓;至8月21日之后,水体TN缓慢回升.统计分析发现,水生植物处理组水体TN显著性低于对照组(P<0.05),在试验初始的前30d内,轮叶黑藻对水体TN的净化效果显著性高于水葫芦,而在35d之后,其净化效果与前30d相反(P<0.05).对照组、水葫芦处理组和轮叶黑藻处理组 TN的最低浓度分别出现在 7月29日、9月28日(采收时)和 7月 29日,分别为1.84,1.04,1.32mg/L,较试验初始分别下降17.4%、53.4%和 40.8%(图 4a).在水生植物采收后,水体TN基本稳定在采收前的水平(图4a).

图4 试验过程中水体总氮及总磷的变化Fig.4 Changes of total nitrogen (TN) and total phosphorus (TP) in the water during the experiments
水体TP变化规律与TN类似(图4b).对照组TP由7月9日的0.21mg/L缓慢波动下降至8月13日的 0.19mg/L,后逐步上升至 9月 10日的0.25mg/L,之后趋于稳定;水葫芦处理组 TP从试验开始的 0.21mg/L逐步下降至 8月 21日的0.09mg/L,后略有回升并趋于稳定;轮叶黑藻处理组TP由7月9日的0.21mg/L迅速下降至7月14日的0.15mg/L,之后下降速率变缓;至8月13日之后,水体TP缓慢回升.统计分析发现,水生植物处理组水体TP显著性低于对照组(P<0.05),在试验前20d内,轮叶黑藻对水体TP的净化效果显著性高于水葫芦,而在35d之后,其净化效果与前20d相反(P<0.05).对照组、水葫芦处理组和轮叶黑藻处理组TP的最低浓度分别出现在8月13日、8月 21日和 7月 29日,分别为 0.19,0.09,0.14mg/L,较试验初始分别下降 9.5%、57.2%和33.3%(图4b).在水生植物采收后,水体TP基本稳定在采收前的水平(图4b).
2.6 水体Chl-a的变化
模拟水体Chl-a的变化趋势如图5所示.对照组水体Chl-a浓度在22.1~40.5μg/L范围波动.水葫芦处理组在试验初始阶段(7月9日~8月3日),水体Chl-a含量出现一定的波动,随后由8月3日的30.7μg/L迅速下降至8月8日的1.8μg/L,之后基本稳定在较低的水平;轮叶黑藻处理组Chl-a浓度由7月9日的33.7μg/L逐步下降至8月3日的1μg/L,后缓慢上升.统计分析发现,轮叶黑藻处理组在整个试验周期内其 Chl-a含量均显著性低于对照组(P<0.05);水葫芦处理组在前25d内,其 Chl-a浓度仅略低于对照组(P>0.05),在 30d后其水体 Chl-a浓度显著性低于对照组(P<0.05).在试验初始的前 25d内,轮叶黑藻对水体Chl-a的净化效率显著性高于水葫芦,而在3d之后,其净化效果与前 20d相反(P<0.05).当水生植物采收后约 50d内,水葫芦处理组水体 Chl-a含量基本稳定在采收前的低水平,而轮叶黑藻处理组水体Chl-a含量较采收时有所上升(图5).
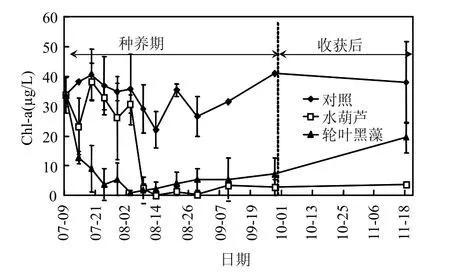
图5 试验过程中水体叶绿素a浓度变化Fig.5 Concentrations of chlorophyll-a (Chl-a) in the water during the experiments
3 讨论
在试验初始,水葫芦体内氮磷含量明显高于采收期,可能暗示水葫芦积累氮磷量与水体氮磷含量密切相关.在试验初始,水葫芦采集于水体氮磷浓度高的西坝河(TN 8.45mg/L,TP 0.76mg/L),而在采收时期,模拟系统的氮磷含量远远低于西坝河水体.而轮叶黑藻仅氮的浓度在采收期明显低于试验初始,这一方面可能是由于轮叶黑藻初始采集于相对污染低的草海水体,另一方面是由于轮叶黑藻直接与底泥接触,能直接吸收底泥中营养盐,而底泥中营养盐浓度远远高于水体的缘故.本研究表明,水葫芦同化吸收水体氮磷的量显著性高于轮叶黑藻.关于植物对水体氮磷的摄取量,不同植物间存在明显的差异.卢少勇等[16-17]的研究表明,浮水植物(如水葫芦)对氮磷的吸收能力远高于沉水植物.试验系统中,初始水体氮磷浓度分别为2.23和0.21mg/L,水体体积为350L,那么水体共含氮磷分别0.78和0.073g.而本研究发现,在试验系统中水葫芦吸收同化作用带走系统中氮磷分别为3.64g和0.54g,而轮叶黑藻的吸收同化作用带走系统中氮磷分别为1.74g和0.46g,说明水生植物同化吸收的营养盐有相当一部分来自于底泥.
本研究发现,水葫芦能显著降低水体 DO及pH值(图2).水葫芦能降低水体DO和pH值已经被广泛证实[18-20].水体 DO受水体初级生产者光合作用放氧、大气复氧及水体有机物分解耗氧的影响.水葫芦的存在一方面阻碍了水体初级生产者对水体光能的利用从而减少了水体初级生产者的光合放氧[21];另一方面由于水葫芦的覆盖而阻断了大气向水体复氧[22];此外,水葫芦根系的呼吸作用需要消耗水体的DO.pH值的降低的原因可能是:水葫芦抑制了藻类的生长从而阻止了水体初级生产者对水体CO2的吸收利用;水葫芦根系及水生动物呼吸作用产生 CO2;一些有机物在水葫芦根际的分解产生大量的有机酸等.在水葫芦生长到一定时期,水体 pH值基本稳定在 8左右,其原因可能是由于水中的酸碱缓冲体系发挥了调节功能[23].轮叶黑藻处理组和对照组水体DO间不存在显著性差异,这是处理组中的轮叶黑藻与对照组中的蓝藻均能在水体中进行光合作用释放氧气的缘故.沉水植物能显著提高水体的 pH 值,与文献[11,24]报道一致,可能是沉水植物的光合作用消耗水中的CO2缘故[25].
水体电导率(EC)反应了水体离子强度,水体不同形态营养盐离子、金属离子等均影响着水体的 EC.本研究发现,水葫芦能一定程度的提高水体的 EC,而轮叶黑藻能降低水体电导率.吴振斌等[23]在凤眼莲净化燕山石油化工废水的静态试验中研究发现,试验结束时,水葫芦净化池中的EC较试验开始时略有升高.本文的结论与吴振斌等[23]的研究一致,其可能是由于水葫芦在生长过程中其根系会分泌出各种有机酸和其他化感物质,以及水葫芦的生长过程中,其根系能释放CO2的缘故.与先前的研究一致[25-26],本研究也发现沉水植物能显著性降低水体的 EC,表明轮叶黑藻能降低水体的离子浓度,这可能是由于:植物对水体营养盐的吸收及吸附水体悬浮物所致[25];沉水植物组较高的pH值使水体一些金属离子发生沉淀作用.
Eh 是水体多种氧化物质与还原物质发生氧化还原反应的综合结果,它虽然不能直接反应某种氧化物质与还原物质浓度的指标,但有助于了解水体的电化学特征,分析水体的性质.先前关于水生植物对水体底泥Eh的影响广泛受到人们的关注[27-29],而关于水生植物对水体Eh的影响报道甚少.贺锋等[26]通过对东湖围隔中菹草对水体的影响研究,发现其能显著性降低水体的 Eh值,但其并未对其原理做详细解释.水体的 Eh主要受DO、pH值及温度的影响,一般来说,DO越高、pH值越低及温度越低,水体的 Eh越高[30].本研究中,虽然沉水植物处理组水体DO较对照组未见显著性增加,但pH值较对照组显著性增加,故其Eh值低于对照组;而水葫芦处理组可能是由于pH值降低所改变引起的Eh增加效应大于DO降低所引起的Eh值降低效应.伊军等[31]建议在不含任何有毒有害物质的情况下,将Eh值<200mV的水体作为健康饮用水标准.本研究 2种水生植物处理的富营养化水体其Eh值均低于120mV(图3b).
本模拟实验中,在种养相同生物量的情况下,试验初期,轮叶黑藻对水体 TN、TP及 Chl-a消减效果优于水葫芦(图4,图5),而从长期的削减效率来看,水葫芦处理组要优于轮叶黑藻处理组.这可能是由于 2种植物本身的生理特性存在一定的差异所致.沉水植物整个株体均在水体中,而水葫芦仅根在水面以下,试验初期在相同生物量的情况下,沉水植物对水体发生作用的有效生物量大;而到了试验后期,由于水葫芦生长速度远远超过轮叶黑藻,导致水葫芦处理组对水体氮磷去除效果要优于轮叶黑藻.本研究发现,由于水葫芦处理组水体氮磷浓度稳定在较轮叶黑藻处理组低的水平,藻类生长所需的营养盐较少,水体 Chl-a浓度未见上升,而轮叶黑藻处理组 Chl-a浓度较采收前有所上升(图5).这从一定意义上说明水葫芦对于富营养化湖泊水体修复、蓝藻水华的控制具有重要的意义.
在实际的湖泊污染治理中,漂浮植物(如水葫芦)由于其覆盖水面生长,能降低水体 DO,并且阻挡光照,可能会对水体生态系统带来不利影响[32];而沉水植物在富营养化湖泊中易受到湖泊水文条件(如水深)的影响,且易受到水体动物的破坏(如龙虾的撕咬).在富营养化湖泊中,由于附着藻类常常对沉水植物生长造成不利影响,湖泊中大范围的沉水植物恢复还鲜有先例[33].因此,单独依靠其中一种方法治理湖泊富营养化难以达到良好的效果.由于沉水植物的光合放氧能一定程度上弥补漂浮植物的耗氧;漂浮植物不受水深限制,而沉水植物适宜透明度高的浅水地带;漂浮植物能高效抑制藻类生长,根系吸附颗粒物,能为沉水植物提供高透明度,对减少沉水植物表面的附着生物提供有利条件.基于此,笔者提出结合漂浮植物与沉水植物,在湖岸浅水地带种植沉水植物,在远离岸边的深水区和低透明度区种植漂浮植物,充分发挥各自的优势而达到湖泊治理的目的.
4 结论
4.1 水葫芦能降低水体 DO、pH 值,增加水体EC、Eh等指标,而轮叶黑藻则与水葫芦相反.
4.2 水葫芦和轮叶黑藻均能显著低降低水体的氮磷营养盐浓度及叶绿素含量.相同初始种养量的情况下,试验初期轮叶黑藻对降低水体氮磷及叶绿素浓度效果优于水葫芦,但长期来看,水葫芦对水体氮磷及叶绿素的去除效果优于轮叶黑藻.
4.3 在水生植物采收后约50d内(9月28日~11月 18日),水体氮磷浓度能基本维持在水生植物采收前的水平.
4.4 漂浮植物与沉水植物结合的方式可能是恢复治理富营养化湖泊的可行途径.
[1]Chorus I, Bartram J.Toxic cyanobacteria in water: a guide to their public health consequences, monitoring, and management[M].London: E and FN Spon, 1999,416.
[2]黄漪平,范成新,濮培民,等.太湖水环境及其污染控制 [M].北京:科学出版社, 2001.
[3]成小英,王国祥,濮培民,等.冬季富营养化湖泊中水生植物的恢复及净化作用 [J].湖泊科学, 2002,14(2):139-144.
[4]Rodriguez-Gallego L, Mazzeo N, Gorga J, et al.The effects of an artif i cial wetland dominated by free-f l oating plants on the restoration of a subtropical, hypertrophic lake [J].Lakes and Reservoirs: Research and Management, 2004,9:203-215.
[5]柴 夏,刘从玉,谢 超,等.生态系统修复与构建过程中的水生植物品种选择——以惠州西湖生态系统的修复与构建工程为例 [J].污染防治技术, 2008,21(2):18-21.
[6]Sun L, Liu Y, Jin H.Nitrogen removal from polluted river by enhanced floating bed grown canna [J].Ecological Engineering,2009,35:135-140.
[7]Lu Q, He Z L, Graetz D A, et al.Phytoremediation to remove nutrients and improve eutrophic stormwaters using water lettuce(Pistia stratiotes L.) [J].Environmental Science and Pollution Research, 2010,17:84-96.
[8]Jayaweera M, Kasturiarachchi J.Removal of nitrogen and phosphorus from industrial wastewaters by phytoremediation using water hyacinth (Eichhornia crassipes (Mart.) Solms) [J].Water Science and Technology,2004,50:217-225.
[9]Chunkao K, Nimpee C, Duangmal K.The King's initiatives using water hyacinth to remove heavy metals and plant nutrients from wastewater through Bueng Makkasan in Bangkok, Thailand [J].Ecological Engineering, 2012,39:40-52.
[10]王 智,张志勇,张君倩,等.水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征 [J].中国环境科学, 2012,32(1):142-149.
[11]吴 娟,吴振斌,成水平.黑藻对水体和沉积物理化性质的改善和营养元素的去除作用 [J].水生生物学报, 2009,33:589-595.
[12]刘从玉,刘平平,刘正文,等.沉水植物在生态修复和水质改善中的作用——以惠州南湖生态系统的修复与构建(中试)工程为例 [J].安徽农业科学, 2008,36:2908-2910.
[13]张志勇,刘海琴,严少华,等.水葫芦去除不同富营养化水体中氮,磷能力的比较 [J].江苏农业学报, 2009,25:1039-1046.
[14]张丽彬,王启山,徐新惠,等.乙醇法测定浮游植物叶绿素 a含量的讨论 [J].中国环境监测, 2009,24:9-10.
[15]鲍士旦.土壤农化分析 [M].北京:中国农业出版社, 2000.
[16]卢少勇,金相灿,余 刚.人工湿地氮去除机理 [J].生态学报,2006,26:2670-2677.
[17]卢少勇,金相灿,余 刚.人工湿地磷去除机理 [J].生态环境,2006,15:391-396.
[18]Giraldo E, Garzon A.The potential for water hyacinth to improve the quality of Bogota River water in the Muña Reservoir:comparison with the performance of waste stabilization ponds [J].Water Science and Technology, 2002,42:103-110.
[19]Rommens W, Maes J, Dekeza N, et al.The impact of water hyacinth (Eichhornia crassipes) in a eutrophic subtropical impoundment (Lake Chivero, Zimbabwe).I.Water quality [J].Archiv.of Hydrobiologie, 2003,158:373-388.
[20]蔡雷鸣.福建闽江水口库区飘浮植物覆盖对水体环境的影响[J].湖泊科学, 2006,18:250-254.
[21]Meerhoff M, Mazzeo N, Moss B, et al.The structuring role of free-floating versus submerged plants in a subtropical shallow lake [J].Aquatic Ecology, 2003,37:377-391.
[22]Hunt R, Christensen I.Understanding dissolved oxygen in streams: Information kit [M].CRC Sugar, 2000.
[23]吴振斌,丘昌强,王德铭.凤眼莲净化燕山石油化工废水的研究Ⅱ.静态净化试验 [J].水生生物学报, 1987,11:299-309.
[24]赵联芳,朱 伟,莫妙兴.沉水植物对水体pH值的影响及其脱氮作用 [J].水资源保护, 2009,24:64-67.
[25]王传海,李宽意,文明章,等.苦草对水中环境因子影响的日变化特征 [J].农业环境科学学报, 2007,26:798-800.
[26]贺 锋,吴振斌,邱东茹.东湖围隔中菹草与藻类生化他感作用的初步研究 [J].水生生物学报, 2002,26:421-424.
[27]王震宇,温胜芳,邢宝山,等.4种水生植物根际磷素耗竭效应的比较 [J].环境科学, 2008,29:2475-2480.
[28]Boros G, Søndergaard M, Takács P, et al.Influence of submerged macrophytes, temperature, and nutrient loading on the development of redox potential around the sediment–water interface in lakes [J].Hydrobiologia, 2011,665:117-127.
[29]Freeman CW, Urban R A.Sediment oxidation capabilities of four submersed aquatic macrophytes [J].Journal of Freshwater Ecology, 2012,27:259-271.
[30]徐华成,徐晓军,王 凯,等.饮用水氧化还原电位的影响因素分析 [J].苏州科技学院学报: 工程技术版, 2007,20:63-64.
[31]尹 军,刘 志.饮用水 ORP的健康意义及影响因素探讨 [J].中国给水排水, 2005,21:25-28.
[32]Villamagna A, Murphy B.Ecological and socio-economic impacts of invasive water hyacinth (Eichhornia crassipes): a review [J].Freshwater Biology, 2010,55:282-298.
[33]秦伯强,许 海,董百丽.富营养化湖泊治理的理论与实践 [M].北京:高等教育出版社, 2011.
