阿萨希毛孢子菌脂筏的观察
2013-07-19吕运通王文岭杨蓉娅夏志宽李海涛王聪敏
吕运通,王文岭,杨蓉娅,夏志宽,李海涛,丛 林,王聪敏
阿萨希毛孢子菌(Trichosporon asahii,T. asahii)是毛孢子菌属中最常见的深部致病菌,在免疫功能低下的宿主可导致致命的系统感染[1]。目前人们对T. asahii 生长调节的研究尚处于空白。近年来发现脂筏是细胞膜上富含胆固醇和鞘磷脂的微结构域,是一种动态结构,成簇的脂筏组成富含甾醇的区域(sterolrich domains,SRDs),这一区域就像一个蛋白质停泊的平台,与膜的信号转导、促进细胞的生长均有密切的关系[2],其中包含控制细胞生长和毒力的蛋白糖磷脂酰肌醇锚定蛋白等[3]。本实验应用Filipin 荧光染剂对T. asahii 中的SRDs 区进行特异的荧光染色,以此来分析脂筏在调控T. asahii 菌丝生长、分支以及假菌丝继续出芽生长等方面的作用。
1 材料与方法
1.1 材料
T. asahii(CBS2479,CBS 公司),-80℃保存。Filipin荧光染色试剂盒(激发波长340 nm,GENMED 公司)。二甲基亚砜(DSMO,Sigma 公司)。两性霉素B(Amersco 公司)。荧光显微镜(leica dm3000 数码拍摄系统),UV 滤光片(Ex365/Em460)。
1.2 方法
1.2.1 菌液制备 取浓度为106/ml的 2 ml菌种分别转种于7个30 mlYPD液体培养基小三角烧瓶中,37 ℃,150 r/min培养,分别培养8 h、16 h、24 h、2 d、3 d、4 d、5 d、6 d、7 d。
1.2.2 Filipin荧光染色 菌悬液离心后用清洗液A清洗,移除清洗液,重复两次;然后取少量底层悬浊液滴在载玻片上,加固定液B固定30 min,移除固着液;加清洗液A清洗两遍后移除清洗液;加水解液C水解1 h(避免干燥),移除水解液;清洗液A清洗两遍后移除清洗液,加抗干扰液D10 min;加染色剂E并避光染色10~20 min。在荧光显微镜下观察真菌形态及荧光分布。
1.2.3 两性霉素B干预 将两性霉素B粉末稀释成0.2、0.5、1、2 μg/ml,分别加入到浓度为106cfu/ml菌悬液中摇菌72 h,注意避光。重复上述荧光染色步骤,在荧光显微镜下观察真菌形态及荧光分布。
2 结果
2.1 正常培养条件下T. asahii荧光染色
8h、16h 后荧光显微镜下观察视野中只有孢子和刚出芽的芽胞,随机选择视野观察发现在孢子和芽胞顶端无明显的荧光,仅细胞膜周围有均匀弥漫的荧光(图1a,1b)。24 h 时观察视野内大部分孢子已生长成菌丝,可观察到菌丝的一端或两端出现荧光,尚未观察到隔膜荧光的出现(图1c)。2、3、4、5、6、7 d 后视野中除可观察到菌丝顶端荧光外,隔膜荧光开始出现(图1d-1i)。
2.2 两性霉素B干预后T.asahii荧光染色
T.asahii 经不同浓度两性霉素B 干预后通过Filipin 荧光,分别在普通光镜和荧光显微镜下观察发现,随着两性霉素B 浓度的增加,菌丝的生长抑制程度越明显,其顶端细胞膜和隔膜处荧光消失,而菌体内出现散在荧光(图2)。
3 讨论
Filipin 是一种甾醇结合荧光染料,这种染料可以与真菌的SRDs 区特异性结合。在白念珠菌中,Filipin 荧光可出现在菌丝生长的各个阶段,包括菌丝的顶端和隔膜部位,而假菌丝中未观察到荧光[4]。在T. asahii 生长过程中,我们不仅在菌丝的各生长阶段的顶端和隔膜及分支部位观察到了荧光,而且在假菌丝的两端及隔膜、缩窄环部也观察到了荧光。在前期研究中,在扫描电镜下观察发现假菌丝的两端可产生芽管和菌丝[5];我们通过FM4-64 对T. asahii 荧光染色的方法发现假菌丝两个顶端均出现较明显的荧光[6],说明T. asahii 的假菌丝具有转化成菌丝的能力。本研究在T. asahii 的顶端、隔膜及分支部位观察到了Filipin 荧光,这说明脂筏在调控T. asahii 的顶端生长及分枝生长方面起着重要作用。
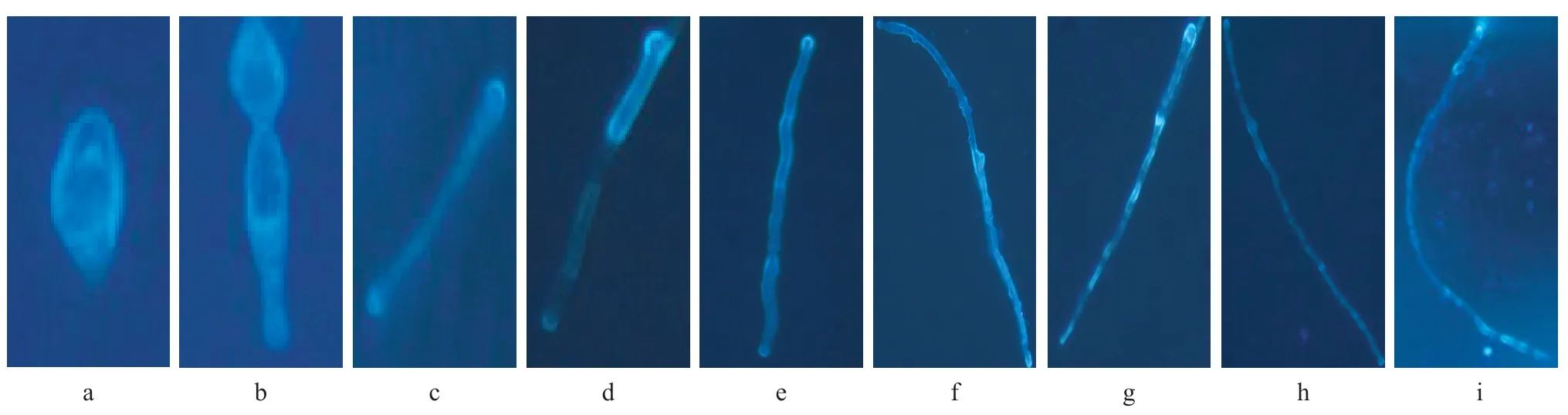
图1 不同培养时间T.asahii荧光染色

图2 不同浓度两性霉素B对T.asahii生长影响(3d,×100)
两性霉素B 是多烯类抗真菌药,可与真菌细胞膜上的甾醇结合,损伤膜的通透性、导致细胞内重要物质外漏,从而破坏细胞的正常代谢。经过两性霉素B 处理的T. asahii 形态发生较明显的变化,且不同浓度的两性霉素B 处理过的T. asahii 的形态变化差别也较明显。随着两性霉素B 浓度的增加,T. asahii 的生长受到的抑制越明显,光镜下观察发现随着两性霉素B 浓度增加,菌丝变得短粗,菌体膜的顶端缺乏较明显的荧光,且观察不到隔膜这一结构,荧光主要分散在菌体的内部,这也从另一角度证实了两性霉素B 是通过干扰菌体内的甾醇的转运,从而影响菌体的生长。
真菌的极性生长是极其精细和复杂的过程,需要各组成成分相互协调、相互作用来完成。在细胞膜中成簇脂筏其间镶嵌多种蛋白,Takeda和Chang[7]研究发现在裂殖酵母中,蛋白myo1、Cdc15 及其他的蛋白相结合为富含甾醇区域提供了支架,从而介导富含甾醇区域的形成。研究还发现在缺乏myo5 蛋白或Sla2 肌动蛋白相关蛋白的白念珠菌突变体中富含甾醇的区域无法形成[8]。Pearson 等[9]通过研究发现在构巢曲霉中MesA 蛋白参与菌丝顶端富含甾醇区域的形成和成蛋白SepA 的定位。细胞膜上的脂筏结构被破坏后,蛋白失去定位,可以看出,脂筏一旦被破坏,不仅会影响菌体的生长,同时也影响细胞膜上蛋白的功能。本研究仅是对T. asahii 的脂筏结构用荧光染色的方法作了初步的观察研究,从脂筏结构角度来分析T. asahii 的极性生长,还需要更多针对性研究进一步证实。
[1] 杨蓉娅, 敖俊红, 王文岭, 等. 阿萨希丝孢酵母引起播散性毛孢子菌病国内首例报告 [J]. 中华皮肤科杂志, 2001, 34(5):329-332.
[2] Alvarez FJ, Douglas LM, Konopka JB. Sterol-rich plasma membrane domains in fungi [J]. Eukaryot Cell, 2007, 6(5):755-763.
[3] Brown DA, London E. Structure and function of sphingolipidand cholesterol-rich membrane rafts [J]. J Biol Chem, 2000, 275(23):17221-17224.
[4] Martin SW, Konopka JB. Lipid raft polarization contributes to hyphal growth in Candida albicans [J]. Eukaryot Cell, 2004, 3(3):675-684.
[5] Wang WL, Yang RY, Ao JH. Uncommon characteristics of the structure and development of Trichosporon asahii [J]. Chin Med J, 2009, 122(15):1806-1810.
[6] 吕运通, 王文岭, 杨蓉娅, 等. 阿萨希毛孢子菌顶体观察 [J]. 实用皮肤病学杂志, 2013, 6(1):12-14.
[7] Takeda T, Chang F. Role of fission yeast myosin I in organization of sterol-rich membrane domains [J]. Curr Biol, 2005, 15(14):1331-1336.
[8] Oberholzer U,Nantel A, Berman J, et al.Transcript profiles of Candida albicans cortical actin patch mutants reflect their cellular defects: contribution of the Hog1p and Mkc1p signaling pathways [J]. Eukaryot Cell, 2006, 5(8):1252-1265.
[9] Pearson CL, Xu K, Sharpless KE, et al. MesA, a novel fungal protein required for the stabilization of polarity axes in Aspergillus nidulans [J]. Mol Biol Cell, 2004, 15(8):3658-3672.
