1, 8-二氮杂双环(5, 4, 0)-7-十一烯的合成工艺及其应用开发
2013-07-18冯筱晴王瑞瑞王彦臣宋国强
冯筱晴,沈 力,王瑞瑞,王彦臣,宋国强
(1常州大学制药与生命科学学院,江苏 常州 213164;2常州市药品制造与质量控制工程重点实验室,江苏 常州213164)
光聚合技术是 20世纪 60年代发展起来具有“5E”特点:高效(efficient)、适应性广(enabling)、经济(economical)、节能(energy saving)和环境友好(environmental friendly)的一种新型材料表面加工技术。光产碱剂(PBG)是继自由基光引发剂和光产酸剂之后发展出的一种光引发剂,属于光固化体系中的关键组分,基于其良好的抗氧阻性和抗基板腐蚀性,在微电子行业和高端表漆中得到广泛的应用[1-4]。新型取代苄基脒类光产碱剂以1, 8-二氮杂双环(5, 4, 0)-7-十一烯(DBU)这种双脒环类化合物为结构主体,光解后释放强碱DBU,引发效率高可催化含有环氧树脂或脂肪族异氰酸酯类配方,由此可期待此类PBG扩展光聚合配方的应用前景,实现DBU的应用价值提升[5-7]。
目前文献报道的 DBU的合成方法主要有氮丙啶-内酰胺法、内酰胺-丙烯腈霍夫曼反应法、内酯-烯化二胺法等,相对于内酰胺-丙烯腈加氢环合法,前3种方法原料价格较高,反应条件苛刻,总收率较低且研究报道较少[8-12]。本工作重点研究内酰胺-丙烯腈加氢环合制备工艺,通过对反应温度、催化剂用量、投料比等影响因素的考察,改进工艺以较高收率和纯度得到DBU。此工艺分为3个步骤:①由ε-己内酰胺和丙烯腈合成N-(β-氰乙基)-ε-己内酰胺(CEC,Ⅰa);②将CEC催化加氢合成N-(γ-氨基丙基)-ε-己内酰胺(APC,Ⅰb);③APC脱水环化、减压蒸馏,即可得DBU(Ⅰc)[12-13]。DBU的合成路线见图1。
再以DBU(Ⅰc)为原料,分别和5种取代基氯化苄经过先取代成氯盐再还原的方法,合成5种取代苄基脒类光产碱剂Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe。分别考察不同溶剂,不同温度及原料投料比对两步反应的影响。研究表明:此合成工艺,第一步成盐收率高,第二步采用氢化锂铝为还原剂还原活性强,操作简单,可高纯度高收率地得到5种取代苄基脒类光产碱剂,为此系列PBG的合成作为参考[14-15]。PBGs的合成路线见图2。

图1 DBU的合成路线
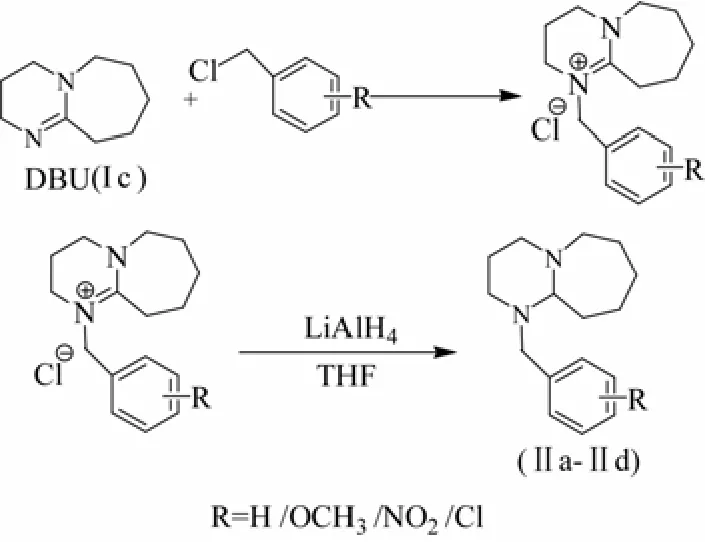
图2 取代苄基DBU类光产碱剂的合成路线
1 实验部分
1.1 仪器和试剂
Bruker DRX 500MHz核磁共振仪(德国Bruker公司),溶剂为DCCl3;GC-2010型气相色谱仪(日本岛津);Agilent 1260型液相色谱仪(美国安捷伦公司)。
ε-己内酰胺、丙烯腈、对苯二酚、对甲苯磺酸、二甲苯、氯苄、4-氯代氯苄、4-硝基氯苄、3-甲氧基氯苄、4-甲氧基氯苄等均为分析纯级试剂,镍、甲苯、THF、二氯甲烷、甲醇、氢氧化钾、氢化锂铝、无水硫酸镁等均为工业级,含量均≥99.0%。
1.2 产物分析色谱条件
液相色谱:Shim-pack CLC-ODS 6.0 mm× 150 mm、1.0 mL/min流速、柱温25 ℃、流动相90%甲醇/水、检测波长254 nm。
气相色谱:AC-1、FID1检测器,温度250 ℃、SPL1温度280 ℃、柱箱温度210 ℃、总流量51.5 mL/min、柱流量1.21 mL/min、压力150.0 kPa、分流比39.0、氮气载气。
1.3 DBU(Ⅰc)的合成
1.3.1N-(β-氰乙基)-ε-己内酰胺(Ⅰa)的合成
向250 mL带机械搅拌的反应瓶中投入22.6 g(0.20 mol)ε-己内酰胺,120 mL甲苯为溶剂,再加入0.56 g(0.01 mol)氢氧化钾。在恒压漏斗中放入16.9 g(0.24 mol)丙烯腈和少量对苯二酚,待ε-己内酰胺融化时滴加丙烯腈,20 min内滴完,油浴控制反应温度在70 ℃左右,保温反应24 h,停止反应,有机相水洗至中性,无水MgSO4干燥,过滤,旋蒸除去溶剂,减压蒸馏得产品34.0 g,收率98.1%,纯度97.8%。
1.3.2N-(γ-氨基丙基)-ε-己内酰胺(Ⅰb)的合成
取 30 g(0.18 mol)N-(β-氰乙基)-ε-己内酰胺加入高压釜中,250 mL无水甲醇为溶剂,再加入30 g镍,通入氢气,保持釜内压力2 MPa,搅拌机转速450 r/min,保持温度80~100 ℃反应5 h。后处理:将反应料液抽滤除去镍,干燥,旋蒸得到产品27.9 g,收率91.1%,纯度98.0%。
1.3.3 APC成环反应
向250 mL带机械搅拌的反应瓶中投入20.0 g(0.12 mol)N-(γ-氨基丙基)-ε-己内酰胺(APC)和1.03 g对甲基苯磺酸,120 mL二甲苯为溶剂,油浴控温150~160 ℃反应8 h,停止反应,向烧瓶中加入少量水停止反应,有机相水洗至中性,无水MgSO4干燥,过滤,减压旋蒸除去溶剂得产品17.4 g,收率91.4%,纯度大于95.4%。
Ⅰc的1HNMR(CDCl3,500MHz):δ为3.295~3.273(2H, t,—CH2);3.231~3.186(4H, m,—CH2);2.417~2.397(2H, t, —CH2);1.825~1.778(2H, m, —CH2);1.670~1.661(4H, m, —CH2);1.655~1.576(2H, m, —CH2),LC-MS MS(m/z)为 152[M]+。
1.4 8-苄基-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱa)的合成
1.4.1 取代合成氯盐反应
在带搅拌的 100 mL四口烧瓶中,称取 4.0 g DBU,加入50 mL甲苯,室温下搅拌。取3.5 g氯苄,以20 mL甲苯溶解,转移至25 mL的恒压滴液漏斗内,约30 min滴完,升温至 90 ℃,反应6 h,抽滤,滤饼用新鲜甲苯洗涤,除去溶剂得白色固体季胺盐7.2 g。
1.4.2 亚胺还原反应
在带搅拌的100 mL四口烧瓶中,取4.0 g白色固体季胺盐,加入50 mL无水THF。控温25 ℃搅拌反应,称取0.273 g氢化锂铝分批加至烧瓶中,搅拌过夜,薄层层析(TLC)磷钼酸显色跟踪反应至原料反应完全。后处理:料液温度降至0 ℃,依次滴加1.0 mL水,1 mL 10%的NaOH水溶液,1.0 mL水,继续反应1 h。反应料液抽滤,收集有机相,蒸除溶剂,剩余物用乙酸乙酯溶解,少量去离子水洗2~3遍,收集有机相干燥,过滤,旋蒸得浅黄色油状液体 2.7 g产品,产率 76.7%,液相分析纯度93.2%。
Ⅱa的1H NMR(CDCl3,500MHz):δ为7.365~7.353(1H, d,—C6H5);7.301~7.240(2H, q,—C6H5);7.234~7.221(2H, d, —C6H5);3.828~3.821(2H, d, —CH2);3.107~3.041(1H, m, —N—CH);2.981~2.831(4H, m, —CH2);2.423~2.408(3H, q, —CH2);2.254~2.217(4H, m, —CH2);2.047~1.463(5H, m, —CH2),LC-MS MS(m/z)为 245[M+1]+。
1.5 8-(4-氯苄基)-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱb)的合成
以4-氯代氯化苄和DBU为原料按照1.4节中的方法合成产品Ⅱb,Ⅱb的1HNMR(CDCl3,500MHz),δ为 7.289~7.249(4H, m, —C6H4);3.853~3.824(2H, d, —N—CH2);3.487~3.345(1H, m, —CH2);3.031~2.924(2H, m, —CH2);2.776~2.642(2H, m, —CH2);2.563~2.518(2H,m, —CH2);2.418~1.236(10H, m, —CH2),LC-MS MS(m/z)为 277[M+1]+。
1.6 8-(4-甲氧苄基)-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱc)的合成
以4-甲氧氯化苄和DBU为原料按照1.4节中的方法合成Ⅱc,Ⅱc的1HNMR(CDCl3,500 MHz),δ为 7.262~7.238(2H, t, —C6H4);6.851~6.834(2H, q, —C6H4);3.833~3.792(2H, q, —N—CH2);3.432~3.345(2H, m, —OCH2);3.036~2.921(2H,m, —CH2);2.809~2.784(2H, m, —CH2);2.689~2.635(2H, m, —CH2);2.388~1.391(10H, m,—CH2),LC-MS MS(m/z)为 275[M+1]+。
1.7 8-(3-甲氧苄基)-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱd)的合成
以3-甲氧氯化苄和DBU为原料按照1.4节中的方法合成Ⅱd,Ⅱd的1HNMR(CDCl3,500 MHz),δ为 7.278~7.232(1H, t, —C6H4);7.221~7.1-2(1H, t, —C6H4);6.841~6.824(2H, q,—C6H4);3.801~3.792(2H, q,—N—CH2);3.422~3.335(2H,m, —OCH2);3.028~2.897(2H, m,—CH2);2.796~2.763(2H, m,—CH2);2.673~2.583(2H, m,—CH2);2.368~1.372(10H, m,—CH2),LC-MS MS(m/z)为 275[M+1]+。
1.8 8-(4-硝基苄基)-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱe)的合成
以4-硝基氯化苄和DBU为原料按照1.4中的方法合成Ⅱe,Ⅱe的1HNMR(CDCl3,500MHz),δ为 8.133~7.262(4H, m,—C6H4);3.975~3.943(2H, d,—CH2);3.238~3.207(2H, d,—CH2);3.118~3.102(2H, q,—N—CH);2.752~1.406(14H,m,—CH2), LC-MS MS(m/z)为 290[M+1]+。
2 结果与讨论
2.1 N-(β-氰乙基)-ε-己内酰胺(Ⅰa)的合成
(1)反应温度的选择 通常情况下较高反应温度有利于ε-己内酰胺和丙烯腈反应,而温度过高丙烯腈容易发生自聚,所以反应中加入少量对苯二酚防止发生聚合[12]。考察以氢氧化钾为催化剂,不同反应温度的影响,实验结果见表1。
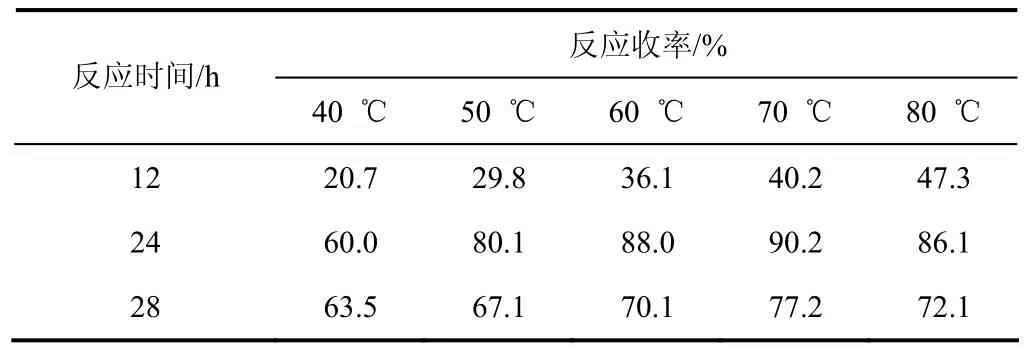
表1 温度对反应结果的影响
由表1可以看出:反应温度小于70℃时,随着反应温度的提高,缩合反应收率逐渐提高;当反应温度高于70 ℃,反应24 h后,虽然原料转化率依然较高,但已产生部分聚合产物,目标产物收率降到了 86.1%,同样反应时间增长也使得聚合产物迅速增多。综合考虑,温度应控制在65~70 ℃,反应24 h较佳。
(2)投料比的选择 通过改变投料比,试图提高缩合反应的收率,由于丙烯腈的价格较便宜,在70℃条件下,通过改变丙烯腈的量来考察反应,实验结果见表2。

表2 投料比对反应结果的影响
由表2可以看出:70 ℃条件下,随着丙烯腈的量增加,缩合反应收率逐渐提高;当ε-己内酰胺和丙烯腈的摩尔投料比达到1∶1.2时,Ⅰa的反应收率达到最高,继续增加丙烯腈的量,收率变化幅度不明显。根据原料经济学原理,最终确定反应投料比为1∶1.2。
2.2 N-(γ-氨基丙基)-ε-己内酰胺(Ⅰb)合成
在高压釜中以镍加氢法对 Ⅰa进行还原,从而合成N-(γ-氨基丙基)-ε-己内酰胺(Ⅰb),控制氢气量一定情况下,考察不同温度的影响,实验结果见表3。
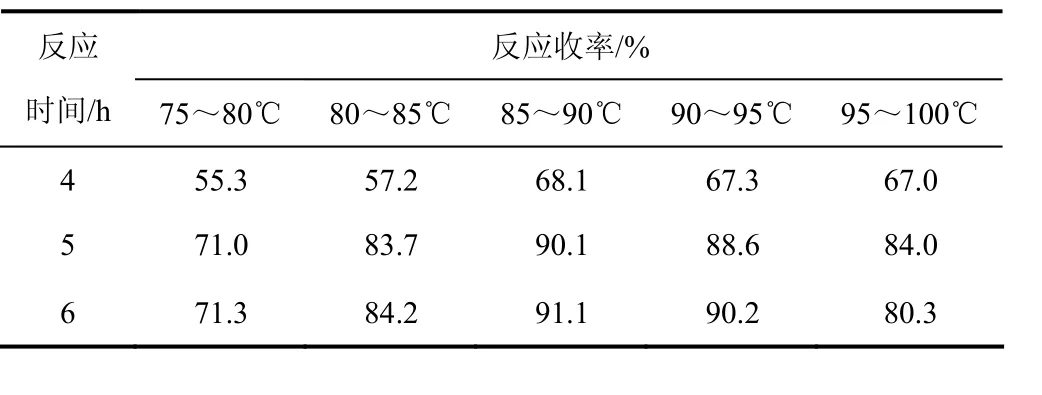
表3 温度对反应结果的影响
由表3可以看出:在反应温度小于90 ℃时,随着反应温度的提高,有利于反应,还原产物Ⅰb收率逐渐提高;当温度高于90 ℃后,反应5 h,气相分析副产物增多,Ⅰb收率反而下降,而当反应温度控制在85~90 ℃,反应6 h,反应收率变化较小。综合考虑,控制温度在85~90 ℃反应5 h较佳。
2.3 APC成环反应
(1)反应时间的选择 以对甲基苯磺酸为催化剂,二甲苯为溶剂,在高温下使N-(γ-氨基丙基)-ε-己内酰胺(Ⅰb)成环生成DBU,气相监测,考察反应时间的影响,实验结果见表4。

表4 反应时间对反应结果的影响
由表4可以看出:随着反应时间变长,DBU(Ⅰc)的收率逐渐提高,7~8 h后反应达到平衡,综合考虑反应转化率及能耗问题,确定反应时间为7.5 h。
(2)催化剂量的选择 在150 ℃反应7.5 h的条件下,考察催化剂用量对反应的影响,实验结果见表5。
由表5可以看出:在其它条件不变的情况下,增加对甲基苯磺酸的量,可以提高 DBU的收率,当其用量达到1.6 g时,反应收率最高达到97.3%,继续增加时,反应趋于平衡,Ⅰc收率增加幅度不明显,考虑到催化剂用量过多,原料和酸性废水后处理成本增加,最终确定催化剂用量为1.6 g,相当于反应底物量的8%。

表5 催化剂量对反应结果的影响
2.4 8-苄基-1, 8-二氮杂双环[5.4.0]十一烷(Ⅱa)的合成
(1)取代成盐反应温度的选择 在甲苯中以等摩尔量的DBU(Ⅰc)和氯苄反应生成8-苄基-1,8-二氮杂双环[5.4.0]-7-十一烯氯盐,通常情况下较高反应温度有利于氯盐生成。考察反应温度的影响,实验结果见表6。
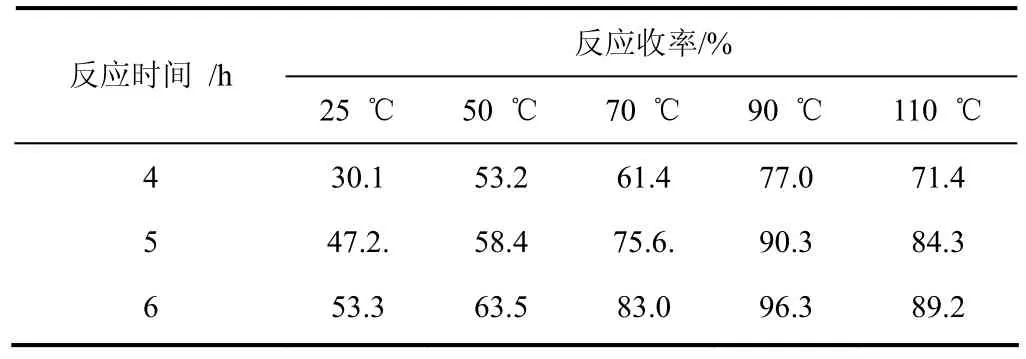
表6 温度对反应结果的影响
由表6可以看出:随着反应温度的升高,氯盐收率明显提高,当温度达到90 ℃反应6 h,收率最高达到 96.3%;继续升高温度直至甲苯回流,液相跟踪显示氯苄已经反应完全,然而氯盐收率反而下降,由此说明氯苄在较高温度环境中不稳定,容易分解,不参与氯盐生成,因此综合考虑,反应温度应控制在90~95 ℃反应6 h较佳。
(2)取代成盐反应投料比的选择 在90 ℃甲苯溶剂中,通过改变投料比,提高成盐反应的收率,实验结果见表7。由表7可以看出:90 ℃条件下,随着 DBU或氯苄的量增加,成盐反应收率都相应提高,当摩尔投料比达到1∶1.05时,氯盐的反应收率达到 98.7%,继续增加氯苄的量,氯盐收率变化已经不明显,相对于提高 DBU量得到的反应效果较好,原料经济。因此,最终确定反应投料比为1∶1.05。

表7 投料比对反应结果的影响
(3)亚胺还原反应投料比的选择 以氢化铝锂为还原剂在THF中,室温下将8-苄基-1, 8-二氮杂双环[5.4.0]-7-十一烯氯盐中的亚胺双键还原,考察原料投料比对反应收率的影响,实验结果见表8。
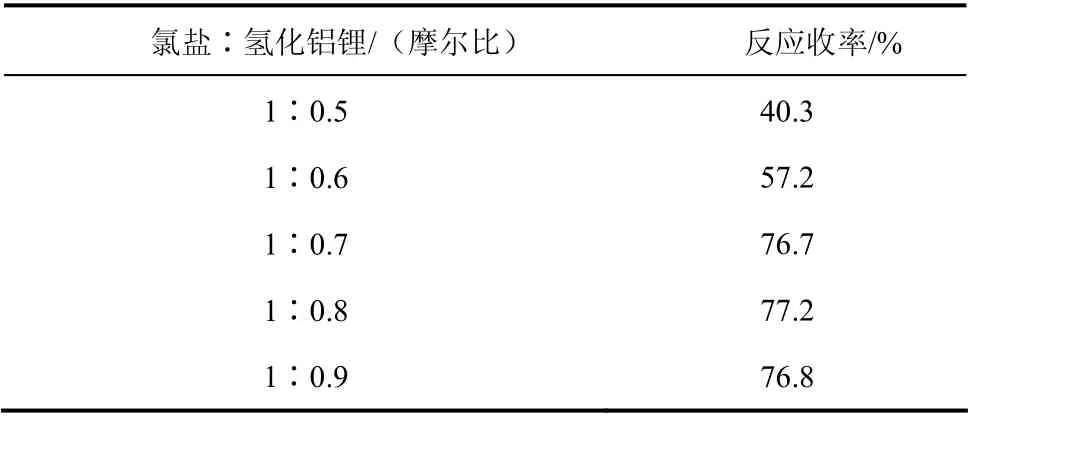
表8 投料比对反应结果的影响
由表8可以看出:氢化铝锂还原性强,室温条件下,随着还原剂量的增加,亚胺还原反应收率相应提高;当反应摩尔投料比达到1∶0.7时,Ⅱa的反应收率达到 76.7%,继续增加还原剂的量,收率变化已经不明显。因此从原料经济学考虑,最终确定氯盐和氢化铝锂的反应投料比为1∶0.7。
2.5 其它几种取代苄基脒类光产碱剂的合成工艺优化结果
以合成出的DBU(Ⅰc)和4种带不同取代基团的氯化苄为原料,经先取代成盐再还原的方法,成功合成其它4种取代苄基DBU类光产碱剂,通过对溶剂,成盐温度,投料比及其它反应条件的考察,得到这4种PBGs的工艺优化结果见表9。
综上得出结论:当在氯化苄苯环上取代硝基时可以明显增强苄基碳正离子活性,使其与DBU 反应成盐活性增加,反应温度降低,时间缩短,产率较高;而当含有给电子基时,苄基活性相应降低,投料比需增加。
3 结 论
(1)通过单因素试验法,得到了目标产物Ⅰa,Ⅰb和DBU(Ⅰc)的较佳合成工艺条件为:以ε-己内酰胺和丙烯腈在甲苯中合成Ⅰa,温度对此缩合反应的影响较大,ε-己内酰胺和丙烯腈按1∶1.2投料,70 ℃条件下反应24 h,Ⅰa收率98.1%,纯度大于97.8%;以Ⅰa为原料在85~90℃经钯碳加氢还原5 h得Ⅰb,收率91.1%,纯度大于98.0%;以Ⅰb量8%的对甲苯磺酸催化,反应7.5 h得DBU(Ⅰc),收率97.3%,纯度大于95%,此工艺得到改进。

表9 其它4种PBGs的合成工艺优化结果
(2)以DBU(Ⅰc)和氯化苄为原料(摩尔比为1∶1.1)甲苯为溶剂在90 ℃下反应6 h,氯盐收率近100%,以0.7当量的氢化铝锂常温下还原氯盐得Ⅱa,收率76.7%,纯度93.2%。
(3)以DBU(Ⅰc)分别和甲氧基、氯基、硝基取代的氯化苄为原料,选用不同溶剂、投料比、温度及还原剂量合成Ⅱb、Ⅱc、Ⅱd、Ⅱe,收率均达到70%以上,提高了DBU的产品附加值。结果表明:经硝基取代的氯苄反应活性最高,成盐反应温度低;以 DBU(Ⅰc)和取代基氯苄经先成盐再还原的方法,可成功合成此类取代苄基 DBU类光产碱剂。此方法原料来源广泛,操作简便,收率相对较高,纯度较好,可为此类化合物的工业化生产奠定理论基础。
[1]姚梅,王汝敏,董萌.紫外光固化体系的研究进展[J].中国胶黏剂,2006,15(6):33-36.
[2]魏杰金,养智.光固化涂料[M].北京:化学工业出版社,2005.
[3]余宗萍,廖申伟,罗荣荣.常用光引发剂在紫外光固化涂料中的应用研究[J].上海涂料,2010,48(8):13-16.
[4]Shi Suqing,Gao Hong,Wu Gangqiang,et al.Cyclic acetal as coinitiator for bimolecular photoinitiating systems[J].Polymer,2007,23(48):2860-2865.
[5]Baudin G,Dietliker K,Jung T.Photoactivable nitrogen bases:US,7538104B2[P].2009.
[6]Edward J Urankar,Jean M J Frechet.Photogenerated base in polymer curing and imaging:Cross-linking of base sensitive polymers containing enolizable pendant groups[J].Chem.Mater., 1997,9(12):2861-2868.
[7]Kutal C,Willson C G.Photoinitiated cross-linking and image formation in thin polymer films containing a transition metal compound[J].The Journal of the Electrochemical Society,1987,134:2280.
[8]Naoya Kumagai,Shigeki Matsunaga.An efficient synthesis of bicyclic amidines by intramolecular cyclization [J].Angewandte Chemie International Edition,2004,43(4):478-482.
[9]Noboru Matsumura,Hiroshi Nishiguchi,Masao Okada,et al.Preparation and characterization of 6-substituted 1,8-diazabi-cyclo[5.4.0]undec-7-ene[J].Journal of Heterocyclic Chemistry,1986,23(3):885–887.
[10]Armin Guggisberg,Urs Kramer, Christian Heidelberger.Umamidierungsreaktionen an cyclischen amino-amid-systemen.3 Mitteilung über umamidierungsreaktionen [J].Helvetica Chimica Acta,1978,61(3):1050–1063.
[11]马震,马斌,杨文库.1,8-二氮杂双环(5,4,0)-7-十一烯的制备方法:中国,200310115849.5[P].2003.
[12]赵会吉,邢金仙,殷长龙.辛二腈加氢制取辛二胺的研究[J].石油大学学报,2001,25(3):59-61.
[13]阳海,庞怀林,廖文文.催化加氢合成6-氨基-7-氟-2H-1,4-苯并恶嗪-3(4H)-酮[J].精细化工,2006,23(11):1142- -1144.
[14]钟荣,曾兆华,杨建文,等.光产碱反应及其应用[J].高分子通报,2003(2):43-49.
[15]许文杰,杨建文,曾兆华,等.光敏性季铵盐的合成与性能研究[J].功能高分子学报,2002,15(2):128-130.
