2型糖尿病患者外周血内皮祖细胞数量变化及机制探讨
2013-07-13刘华伟王丽莉刘庆君诸葛欣肖广辉
刘华伟,王丽莉,刘庆君,诸葛欣,肖广辉
(1.天津市蓟县人民医院西院心内科,天津301900;2.天津医科大学总医院保健医疗部,天津300052;3.天津医科大学第二医院干部病房,天津300211)
内皮祖细胞(EPCs)是一类能增殖并分化为血管内皮细胞的前体细胞,1997年Asahara等[1]首次证实成人外周血中存在内皮细胞的前体细胞—EPCs,它来源于骨髓,能在体外扩增并分化为血管内皮细胞,并能在体内缺血组织中整合形成新生血管。本研究旨在讨论内皮祖细胞在2型糖尿病(T2DM)患者中的数量变化及其机制探讨。
1 对象和方法
1.1 对象 选择2009年9月-2010年10月在我院住院的患者110例,其中男性85例,女性25例,年龄 65~95 岁,平均(80.45±5.91)岁,其中 T2DM 患者符合1999年WHO诊断标准。将所有患者分为2组:T2DM组患者61例,男48例,女13例,年龄65~95岁,平均(80.56±5.32)岁;无糖尿病组 49例,男37例,女 12例,年龄70~93岁,平均(80.37±7.42)岁。将糖尿病组再次分为糖化血红蛋白(HbA1c)>7%组 24例,男 18例,女 6例,年龄 65~89岁,平均(80.89±5.16)岁;HbA1c≤7%组 37例,男 30例,女7例,年龄 67~95岁,平均(80.31±4.64)岁。
排除标准:肿瘤及血液系统疾病者;急性感染及慢性阻塞性肺疾病患者;心力衰竭及急性心肌梗死;心电图显示有明显的心肌缺血;严重的肝肾功能损害者;近期无外伤、骨折,外科手术及溃疡。
1.2 方法
1.2.1 临床资料收集 所有患者均询问冠心病病史、高血压病史及用药情况,测量血压、身高、体质量,并计算体质量指数(BMI)=体质量/身高(kg/m2)。
1.2.2 测定方法 所有研究对象均隔夜空腹10 h以上取肘部静脉血测定HbA1c、血红蛋白(Hb)、白蛋白(ALB)水平、外周血白细胞计数(WBC)及EPCs数量。另外留取静脉血6 mL,应用医用台式离心机3000 r/min离心20 min,收集血清,-80℃保存待用。EPCs的提取、标记及流式细胞计数采用美国BD公司的流式细胞仪进行测定,样品按需标记FITC-CD34、PE-CD133,数据由设门法分析,CD34、CD133双阳性的细胞为EPCs。人基质细胞衍生因子 1α(SDF-1α)、活性氧(ROS)、内皮型一氧化氮合酶(eNOS),采用美国R&D公司提供的试剂盒,用ELISA及酶标仪测定结果。
1.3 统计学处理 采用SPSS17.0软件进行统计分析,各数据做正态检验和方差齐性检验。计量资料:对于正态分布的数据,以±s表示;计数资料:以是与否表示,组间比较采用χ2检验。两组间比较应用t检验,EPCs与各影响因素之间的关系应用多元线性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病组与非糖尿病组一般资料的比较 糖尿病组61例,非糖尿病组49例,两组间年龄、性别、合并冠心病、高血压比例及病程龄、BMI、收缩压(SBP)、舒张压(DBP)、Hb、ALB、外周血 WBC 及用药情况均无统计学差异。见表1。
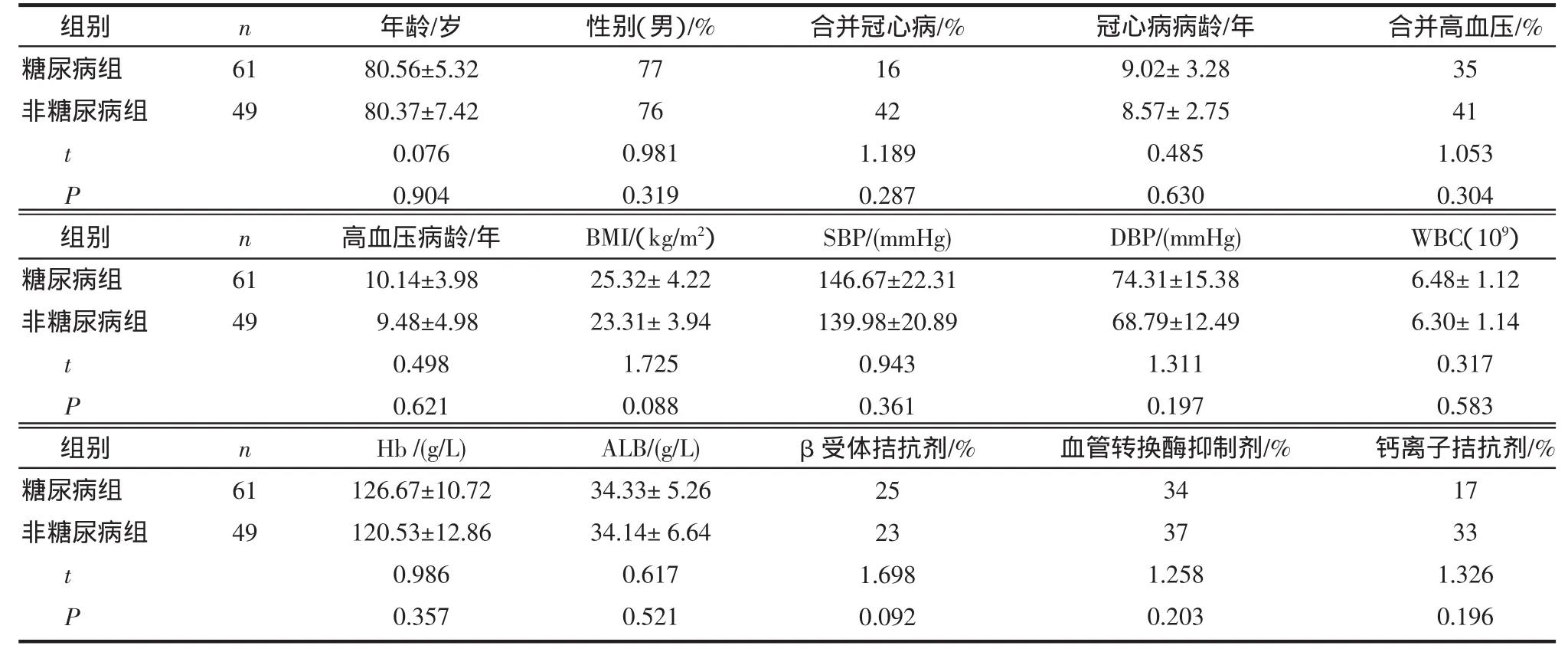
表1 糖尿病组与非糖尿病组一般资料及用药情况比较
2.2 对影响EPCs的因素进行多元线性回归分析 经回归分析后,与EPCs的数量独立相关的变量为糖尿病、冠心病及高血压(P=0.024、0.035、0.046)。见表 2。
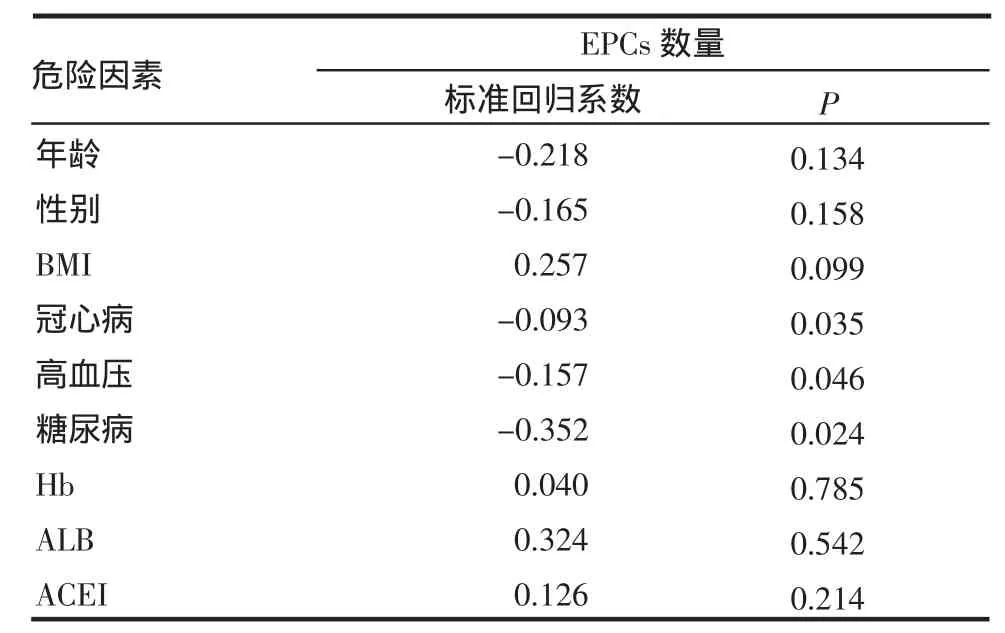
表2 EPCs数量为因变量的多元线性回归分析
2.3 糖尿病组与非糖尿病组之间EPCs的数量及各检测因子的比较 糖尿病组与非糖尿病组相比:EPCs的数量及SDF-1α明显减少,而ROS相对增高,差异有统计学意义(P<0.05)。两组间eNOS水平差异无统计学意义。见表3。
表3 糖尿病组与非糖尿病组间EPCs的数量及各检测因子的比较(±s)

表3 糖尿病组与非糖尿病组间EPCs的数量及各检测因子的比较(±s)
ROS/(ng/mL)2.61±0.700.83±0.273.3860.001 SDF-1α/(ng/mL)1756.43±2132679.35±1982.8690.005 EPCs的数量(20 万单核细胞-1)23±452±92.2460.033 eNOS/(U/L)32.84±3.2531.76±2.431.6580.103糖尿病组非糖尿病组t P组别
2.4 糖尿病组内根据HbA1c进行分组并比较 EPCs的数量在HbA1c>7%组中降低,差异有统计学意义(P<0.05),但其ROS则相对升高,差异有统计学意义(P<0.05)。见表 4。

表4 糖尿病组按HbA1c分组各组之间的比较
3 讨论
EPCs是血管内皮细胞的前体细胞,具有高增殖潜能及内皮特性,不仅参与胚胎期血管发育,同时在成体血管新生中起重要作用。目前大家将含有CD34+CD133+的细胞视为EPCs[2]。正常情况下,EPCs主要定居于骨髓,外周血中EPCs数量极少。在某些生理或病理条件下,EPCs可从骨髓动员至外周血,归巢到血管损伤部位,增殖分化为成熟内皮细胞,通过补充替代凋亡、缺失的内皮细胞促进损伤内皮的修复,发挥维持血管的完整性功能。可以说,EPCs是血管内皮功能重要的保护因素,是修复损伤内皮的“细胞库”。因此从某种意义上说,外周循环中EPCs的功能与数量决定着损伤血管的内皮修复程度。机体对于缺血性损伤具有一定的代偿机制,主要表现为侧枝循环的建立和血管新生,既往研究表明,EPCs以出生后血管发生的方式参与缺血局部的代偿性血管重建过程,在人体生理及病理性血管新生过程中发挥重要作用。在组织缺血缺氧条件下,某些细胞因子如SDF-1、VEGF等因子的释放,可动员EPCs入血。T2DM患者的心血管事件是普通人的2~4倍。T2DM带来的高血管病发生危险应该归于糖毒性和脂毒性对血管壁尤其是内皮细胞的负性损伤作用。内皮功能失调和损伤在糖尿病人早期即可普遍出现,也是动脉粥样硬化的早期病理改变[3],这些都是加速动脉粥样硬化的进展因素之一,也是T2DM患者的一个重要特征。本研究通过对多个危险因素的多元线性回归分析发现糖尿病危险因素的存在与EPCs数量有明显相关性,且呈负相关(r=-0.352,P=0.024),有糖尿病比无糖尿病的患者的EPCs数量明显减少(P<0.05),这也充分说明了糖尿病在该特殊群体中对EPCs的影响。
SDF-lα在造血干细胞的动员和迁移过程中扮演重要角色。CXCR4是目前已知SDF-1唯一的受体,有研究表明SDF-1与CXCR4结合后促进E PCs沿SDF-1的浓度梯度发生迁移、增殖、归巢并抑制EPCs的凋亡[4]。本研究发现T2DM患者外周血中SDF-1α浓度与EPCs数量成正相关(r=0.249,P=0.019),因此得出较高SDF-1α水平对维持外周血中有足够多数量EPCs特别重要。结果还显示单纯糖尿病患者外周血中SDF-1α水平下降明显(P<0.01)。SDF-1α水平下降则外周血中EPCs数量下降,血管修复能力受损。
Churdchomjan[5]报道T2DM患者和正常对照组相比,EPCs数量明显下降,且EPCs数量和血糖控制水平成负相关。具有血管并发症的糖尿病病人与无血管并发症的糖尿病病人相比,循环EPCs数目明显降低,且其数目与血管并发症严重程度密切相关[6],糖尿病人循环EPCs数目下降可能反映了EPCs存活能力的下降或EPCs骨髓动员减少。髙糖可能损坏eNOS表达或者使其Ser1177位点磷酸化,NO生成减少,内皮增殖减少,凋亡增加,进而发展为内皮功能失调和糖尿病动脉粥样硬化[7]。ROS在高糖诱导的eNOS激活或抗氧化剂可以逆转的成熟血管内皮细胞凋亡起了重要作用[8],表明高糖本身,通过线粒体/NAD(P)H-氧化酶调节的ROS表达能够引起基因表达改变和糖尿病血管内皮行为。Vit C和NAC两种水溶性抗氧化剂,能够进入到线粒体并赋予线粒体抗氧化损伤的保护作用[9],预防高糖诱导的人类大动脉内皮细胞凋亡。因此降低高糖诱导的ROS水平被认为是辅助血管新生治疗和预防糖尿病并发症的重要方法之一[10]。Tamarat等[11]将糖尿病小鼠EPCs移植入正常小鼠的缺血肢体,发现缺血肢体局部在移植后血管修复程度降低。糖尿病小鼠外周损伤组织的SDF水平降低,其循环血中的EPCs水平亦降低,并表现出增殖、粘附以及整合入血管的能力受损[12]。本研究发现血糖控制不良(HbA1c>7%)的糖尿病病人EPCs数目明显低于血糖控制良好(HbA1c≤7%)的病人(P<0.05),ROS在血糖控制较差病人中明显升高(P<0.05),进一步证明严格控制血糖能够提高EPCs功能,在糖尿病人群中有利于预防和改善严重的血管并发症。
综上所述,T2DM患者外周血EPCs数量减少,在糖尿病慢性心血管并发症的发生和进展中起重要作用,高血糖环境引起内皮细胞ROS大量生成是EPCs数量减少的可能机制之一。
[1]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964
[2]Liew A,McDermott J H,Barry F,et al.Endothelial progenitor cells for the treatment of diabetic vasculopathy:panacea or Pandora’s box[J].Diabetes Obes Metab,2008,10(5):353
[3]Avogaro A,de Kreutzenberg S V,Fadini G.Endothelial dysfunction:causes and consequences in patients with diabetes mellitus[J].Diabetes Res Clin Pract,2008,82(Suppl 2):S94
[4]Isabelle P,David J,Shahin R.The SD-1/CXCR4 ignaling pathway:a molecular hub modulating neoangiogesis[J].Trends Immunol,2007,28(7):299
[5]Churdchomjan W,Kheolamai P,Manochantr S,et al.Comparison of endothelial progenitor cell function in type 2 diabetes with good and poor glycemic control[J].BMC Endocrine Disorders,2010,10:5
[6]Fadini G P,Miorin M,Facco M,et al.Circulating endothelial progenitor cells are reduced in peripheral vascular complications of type 2 diabetes mellitus[J].J Am Coll Cardiol,2005,45(9):1449
[7]Du X L,Edelstein D,Dimmeler S,et al.Hyperglycemia inhibits endothelial nitric oxide synthase activity by posttranslational modification at the Akt site[J].J Clin Invest,2001,108(9):1341
[8]Ho F M,Lin W W,Chen B C,et al.High glucose-induced apoptosis in human vascular endothelial cells is mediated through NF-kappaB and c-Jun NH2-terminal kinase pathway and prevented by PI3K/Akt/eNOS pathway[J].Cell Signal,2006,18(3):391
[9]Kc S,Carcamo J M,Golde D W.Vitamin C enters mitochondria via facilitative glucose transporter 1(Glut1)and confers mitochondrial protection against oxidative injury[J].FASEB J,2005,19(12):1657
[10]Callaghan M J,Ceradini D J,Gurtner G C.Hyperglycemia-induced reactive oxygen species and impaired endothelial progenitor cell function[J].Antioxid Redox Signal,2005,7(11-12):1476
[11]Tamarat R,Silvestre J S,Le Ricousse-Roussanne S,et al.Impairment in ischemia-induced neovascularization in diabetes:bone marrow mononuclear cell dysfunction and therapeutic potential of placenta growth factor treatment[J].Am J Pathol,2004,164(2):457
[12]Gallagher K A,Liu Z J,Xiao M,et al.Diabetic impairments in NO-mediated endothelial progenitor cell mobilization and homing are reversed by hyperoxia and SDF-1 alpha[J].J Clin Invest,2007,117(5):1249
