尤瑞克林治疗不同TOAST分型急性脑梗死的临床疗效观察
2013-06-12巩企霞眭
巩企霞眭 建* 赵 晶
(1 江苏大学临床医学院,江苏 镇江,212001;2 江苏大学临床医学院,江苏大学附属医院,江苏 镇江 212001;3 江苏大学第四附属医院镇江市第四人民医院神经内科,江苏 镇江,212001)
尤瑞克林治疗不同TOAST分型急性脑梗死的临床疗效观察
巩企霞1眭 建2* 赵 晶3
(1 江苏大学临床医学院,江苏 镇江,212001;2 江苏大学临床医学院,江苏大学附属医院,江苏 镇江 212001;3 江苏大学第四附属医院镇江市第四人民医院神经内科,江苏 镇江,212001)
目的 评价尤瑞克林治疗不同 TOAST 分型急性脑梗死的临床疗效。方法 采用随机对照设计,将 120 例急性脑梗死患者,随机分为尤瑞克林组 (60 例 ) 和对照组 (60 例 )。两组患者均进行 TOAST 分型,给予基础治疗,尤瑞克林组加用尤瑞克林注射液 0.15 PNA 单位+ 生理盐水 50mL 静脉泵入,1 次 /d,共 21d。两组患者均在治疗前后进行神经功能缺损程度评分(NIHSS)。结果 两组患者治疗前 NIHSS评分无差异 (P>0.05),治疗后 NIHSS 评分均较治疗前降低(P<0.05)。尤瑞克林组治疗后 NIHSS 评分低于对照组 (P<0.05)。TOAST 分型,其中 L、S 型两组治疗后 NIHSS 评分均较治疗前降低 (P<0.05);L 型尤瑞克林组治疗后 NIHSS 评分低于对照组 (P<0.05)。S 型尤瑞克林组治疗后 NIHSS 评分低于对照组,但差异无统计学意义。临床疗效比较,其中 S 型两组临床疗效有差异 (P<0.05)。计算标准化有效率,尤瑞克林组 80.75% 高于对照组 52.23%。结论 TOAST 分型中,尤瑞克林能显著改善 L、S 亚型急性脑梗死患者的神经功能缺损评分,提高临床疗效。
脑梗死;尤瑞克林;疗效;TOAST 分型
目前国内外治疗脑梗死的主要方法是溶栓治疗。溶栓治疗有严格的时间窗限制、存在较多的禁忌证,且治疗后出血并发症较多[1]。寻找脑梗死的安全有效治疗方法仍是目前研究发展的方向。尤瑞克林即人尿激肽原酶(human urinary kallikein),是近年上市的一种国家级一类新药[2],是从尿液中提取的一种糖蛋白,临床研究证实其能激活自身激肽原酶—激肽系统[3],能选择性扩张脑细小动脉,改善缺血脑组织的血供和氧供,同时还能促进缺血区血管及神经再生[4-6]。脑梗死的治疗不能一概而论,应根据不同的病因、发病机制、临床类型、发病时间等确定针对性强的治疗方案,实施以分型、分期为核心的个体化治疗[7]。TOAST分型是国际上广为接受的一种病因分类[8]。本研究通过观察尤瑞克林治疗不同TOAST分型的急性脑梗死的临床疗效,旨在分析尤瑞克林在治疗急性脑梗死的作用机制。
1 资料与方法
1.1 临床资料
1.1.1 研究对象
镇江市第四人民医院神经内科2011年01月至2012年06月收治的120例急性脑梗死患者,均符合1995年第四届全国脑血管病学术会议通过的脑梗死诊断标准[9],经头颅CT或MRI证实。病例入选标准:①年龄18~75岁;②首次发病或既往有脑梗死病史未留后遗症;③发病时间<48h;④最近1个月内无出血性疾病或出血倾向;⑤无肝肾功能不全;⑥无消化性溃疡、出血性脑卒中、脑肿瘤、脑外伤病史;⑦患者或亲属签署知情同意书。
1.1.2 分组
采用随机对照设计,将120例患者随机分为两组:尤瑞克林组60例,包括男42例,女18例;年龄(64.28±9.14)岁;伴有高血压39例,糖尿病10例,冠心病11例;入院时NIHSS评分(5.98±6.12)分。对照组60例,包括男39例,女21例;年龄(64.02±8.54)岁;伴有高血压40例,糖尿病14例,冠心病9例;入院时NIHSS评分(6.85± 5.99)分。两组患者的年龄、性别组成、既往史、入院时NIHSS评分等基线比较差异均无统计学意义(P>0.05)。
按TOAST分型,将两组脑梗死患者分别分为大动脉粥样硬化型(L)、小动脉闭塞型(S)、心源性脑栓塞型(C)、其他明确病因型(O)、不明原因型(U)[10]。其中尤瑞克林组有L 20例(33.3%),S 22例(36.7%),C 7例(11.7%),O2例(3.3%),U 9例(15%);对照组有L 22 例(36.7%),S 21例(35%),C 7例(11.7%),O 2例(3.3%),U 8例(13.3%)。两组TOAST分型比较,差异无统计学意义(P>0.05)。
1.2 治疗方法
两组患者根据病情均给予基础治疗,抗血小板治疗、他汀类制剂、胞二磷胆碱神经保护剂、疏血通注射液,根据梗死面积酌情选用脱水剂减轻脑水肿。若合并基础疾病时须进行相应对症处理,如控制血压、血糖等。对照组仅给予上述基础治疗。尤瑞克林组在此基础上给予0.15 PNA单位尤瑞克林(商品名:凯力康,广东天普生化医药股份有限公司,国药准字H20052065)加入生理盐水50mL中静脉泵入,每天1次,连续治疗21d。治疗组用药前24h及治疗期间禁用血管紧张素转换酶抑制剂,禁用类固醇类及其他脑梗死治疗药物。
1.3 监测指标
分别对两组患者治疗前及治疗后第2l天进行NIHSS评分。在治疗过程中监测血压。治疗前和治疗后第21天进行血尿常规、血生化、血凝及心电图等检查,必要时复查头颅CT、头颅MRI。观察药物相关的出血性事件及不良反应。
1.4 疗效评价和安全性评价
1.4.1 疗效评价标准
依据临床NIHSS评分的改善程度分为:基本痊愈:NIHSS评分减少90%以上;显著进步:NIHSS评分减少46%~89%;进步:NIHSS评分减少18%~45%;无变化:NIHSS评分减少或者增加<18%;恶化:NIHSS评分增加>18%;死亡。以基本痊愈、显著进步、进步均视为有效,无变化、恶化、死亡视为无效[11]。
1.4.2 安全性评价
密切观测治疗期间患者血压,治疗前后实验室指标,详细记录各种不良反应事件。因不良反应事件而中途退出者仍须参加安全性评价[12]。
1.5 统计学分析
采用统计软件SPSS16.0进行统计分析。结果以均数±标准差(χ—±s)表示。计量资料两样本均数比较使用独立样本t检验,配对资料使用配对t检验,计数资料比较采用χ2检验。标准化有效率的计算采用直接法。所有统计均采用双侧检验,P<0.05有统计学意义。
2 结 果
2.1 两组患者治疗前后NIHSS评分
治疗前尤瑞克林组与对照组患者NIHSS评分比较,差异无统计学意义(P>0.05)。治疗第21d后,两组患者NIHSS评分均较治疗前下降,差异均有统计学意义(P<0.05)。与对照组相比,尤瑞克林组治疗后NIHSS评分低于对照组,其差异有统计学意义。提示尤瑞克林改善患者神经功能缺损程度优于对照组。见表1。
TOAST分型5个亚型中尤瑞克林组与对照组患者治疗前NIHSS评分比较,差异均无统计学意义(P>0.05)。L、S型两组治疗后NIHSS评分均较治疗前降低(P<0.05);L型尤瑞克林组治疗后NIHSS评分低于对照组,差异有统计学意义。S型尤瑞克林组治疗后NIHSS评分低于对照组,但差异无统计学意义。C、O、U型治疗前后NIHSS评分无明显改变。见表2。
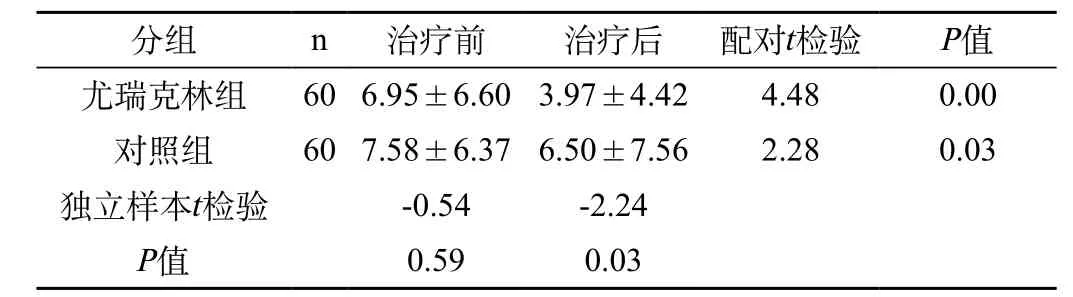
表1 治疗前后神经功能缺损评分(NIHSS)比较

表2 两组不同TOAST亚型治疗前后神经功能缺损评分(NIHSS)比较
2.2 两组患者疗效评价
治疗后第21天,尤瑞克林组基本痊愈10例,显著进步16例,进步23例,无变化10例,恶化10例,死亡0例,有效49例;对照组基本痊愈1例,显著进步12例,进步18例,无变化24例,恶化2例,死亡3例,有效31例;经χ2检验比较两样本的有效率,两组疗效比较,差异有统计学意义(χ2=10.84,P=0.01)。
TOAST分型的5个亚型中分别比较尤瑞克林组与对照组的临床疗效,其中S型两组临床疗效有差异,差异有统计学意义;其他亚型两组间疗效差异均无统计学意义(P>0.05)。见表3。

表3 两组不同TOAST亚型治疗后临床疗效比较
尤瑞克林组与对照组中TOAST分型的5个亚型分布比例不同,分别计算两组的标准化有效率为:尤瑞克林组80.75%,对照组52.23%,提示尤瑞克林组的总有效率高于对照组。
2.3 安全性分析
尤瑞克林组中患者均使用静脉泵入尤瑞克林,严格控制静脉泵入速度,且该组患者使用尤瑞克林前24h及用药过程中均禁用血管紧张素转化酶抑制剂(ACEI)类降压药物,本研究中未有低血压发生。1例C型脑梗死患者在应用尤瑞克林治疗第20天时出现出血性脑梗死,提前停药,停药后病情仍进展,其他患者未见明显的不良反应。尤瑞克林组其他患者用药前后血尿粪常规、血生化及心电图等检查均无异常变化。
3 讨 论
尤瑞克林是从人尿中提取的一种糖蛋白制剂,为国家一类新药[13]。它通过催化激肽原产生胰激肽、之后在激肽酶1的作用下产生一个九肽调节物,从而靶向性的作用于缺血/损伤特异性诱导产生的β1受体,引起血管平滑肌舒张等效应。药效学研究显示尤瑞克林能选择性扩张缺血部位细小动脉,增加缺血脑组织血供及氧供,抑制血小板聚集,减少神经细胞和神经胶质细胞的凋亡、炎症细胞的浸润,促进新生血管生成和神经细胞再生[14]。II期、III期临床试验结果显示,尤瑞克林用于治疗急性脑梗死是安全有效的。
本研究发现,尤瑞克林治疗急性脑梗死21d后可明显改善患者NIHSS评分,效果优于对照组,总有效率高于对照组。这与国内大多数文献研究结果相同。在此基础上,本研究考虑到急性脑梗死不同病因可能会影响其治疗疗效及预后[15,16],进一步分析,不同TOAST分型对尤瑞克林疗效的影响。结果发现,尤瑞克林组治疗有效及NIHSS评分显著改善者,多为L、S型;C、O、U型治疗前后NIHSS评分无明显改善,临床疗效尚不确定。Nagano H等[17]在颈动脉内注射玻璃珠诱发兔脑栓塞,研究尤瑞克林对微循环的影响,发现尤瑞克林对血管的扩张作用有选择性,由强到弱依次为较小的细小动脉、较大的细小动脉、小动脉。S型多为小血管病变,梗死灶较小,在脑梗死急性期,尤瑞克林可有效扩张细小动脉,使病变血管再通或促进缺血区侧支循环形成,改善缺血脑组织的血供及氧供,改善S型急性脑梗死患者NIHSS评分;L型为动脉粥样硬化性血栓形成致大动脉管腔狭窄>50%,多为慢性起病,伴有侧支循环开放,在脑梗死急性期使用尤瑞克林可促进新生血管形成。在动物试验中,已证实尤瑞克林可促进缺血区新生血管生成,减少神经细胞凋亡,发挥神经保护作用。Liu等[18]用转基因方法在脑缺血/再灌注大鼠模型中研究人组织型激肽原酶神经保护机制,发现人组织型激肽原酶通过激活ERK1/2信号通路而非JNK, P38信号通路,减少ROS产生,抑制caspase-3活性,发挥神经保护作用。Su等[19]在Liu的研究基础上进一步发现,人组织型激肽原酶通过激活Homer1b/c信号通道使ERK1/2、Akt-GSK3β磷酸化从而激活ERK1/2信号通路。C型多为心源性栓子栓塞颅内较大动脉,涉及的机制较为复杂[20-22],尤瑞克林在不同TOAST分型中的作用及其机制仍需进一步研究。
本研究通过独立样本t检验得出L型尤瑞克林组改善NIHSS评分优于对照组。这与郑文旭等的研究结果相同[23]。通过 检验得出S型尤瑞克林临床疗效优于对照组。提示病因并非是影响尤瑞克林治疗急性脑梗死临床疗效的惟一因素,其疗效可能受多种因素共同影响。TOAST分型只涉及病因诊断,本身存在着局限性,以及本研究存在样本量较少、研究时间较短等不足,其结果不能作为指导尤瑞克林用药选择的惟一依据,尚不能明确尤瑞克林的作用机制。针对TOAST分型的不足,高山[24,25]等提出了一种结合发病机制的新的分型方法CISS(Chinese ischemic stroke subclassification,CISS)分型。为进一步观察尤瑞克林疗效并深入研究其相关机制,可采用CISS分型方法进行多中心大样本随机对照研究。
综上所述,尤瑞克林治疗急性脑梗死有效而安全,治疗时间窗延长,可以使更多未能进行溶栓治疗的急性脑梗死患者获得良好的治疗效果,改善预后。临床应根据脑梗死类型选择应用,提高治疗疗效,避免医疗资料的浪费。
[1]Cohen JE,Leker RR.Intravenous Thrombolytic Therapy for Acute Ischemic Stroke[J].N Engl J Med,2011,365(10):964-967.
[2]唐 超 刚 ,李 振 东 ,甄 君 ,等 .尤 瑞 克 林 治 疗 急 性 脑 梗 死 效 果 的TOAST分型评价[J].中国医药指南,2012,10(29):401-403.
[3]Campbell DJ.The kallikrein-kinin system in humans[J].Clin Exp Pharmacol Physiol,2001,28(12):1060-1065.
[4]Xia CF,Yin H,Yao YY,et al.Kallikrein protects against ischemic stroke by inhibiting apoptosis and inflammation and promoting angiogenesis and neurogenesis[J].Hum Gene Ther,2006,17(2):206-219.
[5]Chao J,Chao L.Experimental therapy with tissue kallikrein against cerebral ischemia[J].Front Biosci,2006,11:1323-1327.
[6]李晓 莉,侯 永 敏,苗丕渠.治疗急性 脑 梗 死 新 药--凯 力康[J].中国处方药,2005(11):69-72.
[7]饶明俐.中国脑血管病防治指南[M].北京:中华医学会神经病学分会,人民卫生出版社,2007: 1-102.
[8]陈 望春.缺 血性 脑 卒中分型 的临床应 用及 意义[J].南昌大学 学 报(医学版),2011,51(1):93-98.
[9]中华 神经科 学会,中华 神经 外科 学会.各 类 脑 血管 疾 病 诊 断 要点[J].中华神经科杂志,1996,29(6):379-380.
[10]Adams HJ,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST.,Trial of Org 10172 in Acute Stroke Treatment[J].Stroke,1993,24(1):35-41.
[11]中 华 神 经 科 学会,中 华 神 经 外 科 学会.脑 卒 中患 者 临 床 神 经 功能缺损程序评分标准(1995)[J].中华神经科杂志,1996,29(6): 381-383.
[12]谭 盛,陈健,刘卉,等.尤 瑞克 林 治疗急性前循环脑 梗 死 的 近 期 疗效和安全性研究[J].中华神经医学杂志,2011,10(6):622-625.
[13]丁德云.新药临床研究之路-凯力康(注射用尤瑞克林)临床研究简介[J].中国处方药,2005(11):64-66.
[14]李晓莉,侯永敏,苗丕渠.治疗急性脑梗死新药--凯力康[J].中国处方药,2005(11):69-72.
[15]常华军,全亚萍,陈顺中.TOAST分型与脑梗死急性期神经功能和预后的关系[J].中国现代神经疾病杂志,2009,9(5):456-459.
[16]甄 志刚,汪 立 燕,王晋朝,等.急性 脑 梗 死TOAST分型的 相关研 究进展[J].实用心脑肺血管病杂志,2011,19(9):1433-1434.
[17]Nagano H,Hayashim S.Effects of a human urinary kininogenase (SK-827) on cerebral microcirculation after glass bead-induced cerebral embolism in rabbits[J].In Vivo,1992,6(5):497-502.
[18]Liu L,Zhang R,Liu K,et al.Tissue kallikrein protects cortical neurons against in vitro ischemia-acidosis/reperfusion-induced injury through the ERK1/2 pathway[J].Exp Neurol,2009,219(2): 453-465.
[19]Su J,Tang YP,Zhou HG,et al.Tissue kallikrein protects neurons from hypoxia/reoxygenation-induced cell injury through Homer1b/c[J].Cell.Signal,2012,24(11):2205-2115.
[20]Montaner J,Perea-Gainza M,Delgado P,et al.Etiologic diagnosis of ischemic stroke subtypes with plasma biomarkers[J].Stroke, 2008,39(8):2280-2287.
[21]Licata G,Tuttolomondo A,Di Raimondo D,et al.Immunoinflammatory activation in acute cardio-embolic strokes in comparison with other subtypes of ischaemic stroke[J].Thromb Haemost,2009,101(5):929-937.
[22]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Inflammation in Ischemic Stroke Subtypes[J].Curr Pharm Des,2012,PMID:22390641
[23]郑文 旭,刘萍,杨兰.注 射用尤 瑞克 林 治 疗不 同病因 分型 脑 梗 死的疗效观察[J].中国医师进修杂志,2010,33(12):19-21.
[24]Gao S,Wang Y J,Xu AD,et al.Chinese ischemic stroke subclassification[J].Front Neurol,2011,2:6.
[25]Amarenco P,Bogousslavsky J,Caplan LR,et al.Classification of stroke subtypes[J]. Cerebrovasc Dis,2009,27(5):493-501.
The Effect of Human Urinary Kallikrein on Acute Cerebral Infarction of Different Subtype
GONG Qi-xia1, SUI Jian2, ZHAO Jing3
(1 Jiangsu University of Clinical Medicine, ZhenJiang 212001,China; 2 Jiangsu University of Clinical Medicine, Jiangsu University Affiliated Hospital, Zhenjiang 212001, China; 3 Fourth Affiliated Hospital of Jiangsu University, Department of Neurology, Zhenjiang Fourth People’s Hospital, Zhengjiang 212001, China
ObjectiveTo evaluate the clinical efficacy of Human Urinary Kallikrein in the treatment of acute cerebral infarction (ACI) according to TOAST (The Trial of Org 10172 in Acute Stroke Treatment, TOAST) classification.MethodsOne hundred and twenty patients with acute cerebral infarction were enrolled in the randomized control trail. These patients were assigned to kallikrein treatment group (n=60)and control group(n=60). They were both treated by identical basis therapy. The patients in the treatment group were treated by syringe pumps of 0.15 PNA kallikrein diluted in 50mL 0.9% saline once daily for 21 consecutive days. The National Institutes of Health Stroke Scale (NIHSS) scores of two groups were analyzed before and after the treatment linking to TOAST classification.ResultsBefore the treatment, the difference of the NIHSS scores between the kallikrein treatment group and the control group has no statistical significance (P>0.05). At the end of treatment, the NIHSS scores in both group are decreased (P<0.05),and the NIHSS scores of the kallikrein treatment group is lower than that of the control group(P<0.05). After the treatment, the NIHSS scores of large-artery atherosclerosis subtype(L) and smallartery occlusion lacunar subtype(S) which are two subtypes of TOAST classification in two group are both decreased (P<0.05). In the L and S subtype, the NIHSS scores of the treatment group is lower than that in the control group.(in the L subtype, P<0.05;in the S subtype, P<0.05). The effective rate in both group of the S subtype is significantly different(P<0.05). The standardization effective rate of the treatment group and the control group is 80.75%,52.23%, respectively.ConclusionHuman urinary kallikrein which is safe in clinical use could reduce neurological deficits. And it is an effective treatment against large-artery atherosclerosis(L) subtype and small-artery occlusion lacunar(S) subtype patients of acute cerebral infarction.
Cerebral infarction; Kallikrein; Efficacy; TOAST
R743.3
:B
:1671-8194(2013)05-0005-04
*通讯作者:E-mail: jwcsj@163.com
