超滤配合LC-MS/MS法测定普伐他汀人血浆蛋白结合率
2013-05-22谢展雄陈桂红彭巧华吴铁松温中明深圳龙华新区观澜人民医院广东深圳58000深圳宝安区西乡人民医院广东深圳58000深圳光明新区人民医院广东深圳58000
谢展雄,陈桂红,彭巧华,吴铁松,温中明(.深圳龙华新区观澜人民医院,广东 深圳 58000;.深圳宝安区西乡人民医院,广东 深圳 58000;.深圳光明新区人民医院,广东 深圳 58000)
普伐他汀钠(Pravastatin sodium,结构见图1 A)是一种3-羟基-3-甲基戊二酰辅酶A还原酶(HMG-CoA还原酶)抑制剂,通过竞争性抑制胆固醇合成中的关键限速酶HMG-CoA还原酶从而影响羟甲基戊二酰辅酶A还原成羟甲戊酸(MVA),使胆固醇在肝细胞内合成减少,适用于饮食限制仍不能控制的原发性高胆固醇血症或合并有高甘油三酯血症的患者(Ⅱa和Ⅱb型)[1-2]。由于肝脏是合成胆固醇的最主要场所,普伐他汀钠因水溶性特点而对肝细胞具高度的选择性,在胆固醇生物合成中发挥较强的HMG-CoA还原酶的抑制作用,从而明显降低血中胆固醇含量[3]。但普伐他汀在血中蛋白结合率高,以蛋白结合型的药物存在血中会影响其跨膜运转,从而影响其在肝细胞中的分布。因此,普伐他汀血浆蛋白结合率对其临床疗效有一定影响。已有研究报道应用高效液相色谱串联质谱法(LC-MS/MS)法检测人血中的普伐他汀钠浓度[4-6],但并未见LC-MS/MS法应用于普伐他汀钠血浆蛋白结合率研究,笔者现探讨如下。
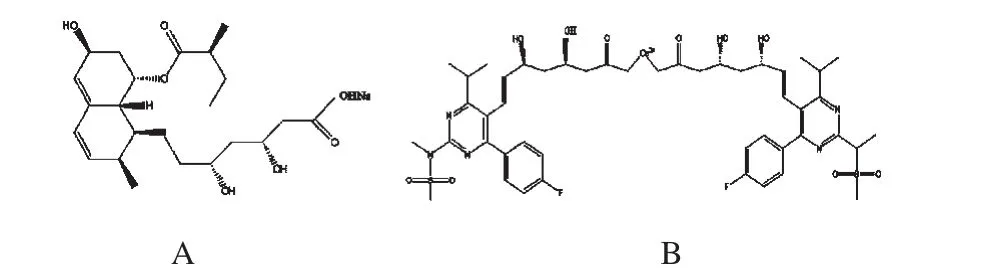
图1 普伐他汀钠和瑞舒伐他汀结构式A.普伐他汀钠;B.瑞舒伐他汀Fig 1 Structure of pravastatin sodium and rosuvastatinA.pravastatin sodium;B.rosuvastatin
1 材料
1.1 仪器
Waters Quattro Micro液-质联用仪,配有电喷雾电离(ESI)(美国Waters公司);Waters 2695高效液相色谱仪,包括四元泵,PAD二极管阵列检测器、自动进样器、Masslynx 4.02工作站(美国Waters公司);M37610-33涡旋混合器(美国Thermo Scientific公司);Sigma 2-16 K台式高速冷冻离心机(德国Sigma公司);Sartorius BP 211 D型十万分之一电子天平(北京赛多利斯天平有限公司);HGC-96 A氮吹仪(上海禾工科学仪器有限公司);DK-S23型电热恒温水浴锅(上海森信实验仪器有限公司);Milli-Q纯水机(美国Millipore公司);Amicon Ultra-30离心超滤管(美国Millipore公司)。
1.2 药品与试剂
普伐他汀钠对照品(批号:20110612,纯度>98%)、瑞舒伐他汀(内标,批号:20100609,纯度>99%,结构式见图1 B)均购于上海研晶生物科技有限公司;普伐他汀钠片(中美上海施贵宝制药有限公司,批号:20111026,规格:每片20 mg)。乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱与质谱条件
色谱柱:Waters XTerra MS C18(150mm×2.1mm,5μm);Waters Symmetry C18保护柱(20 mm×3.9 mm,5 μm);流动相:甲酸铵(含0.2%甲酸)-乙腈(60∶40,V/V);柱温:40℃;流速:0.3 ml/min;全波长扫描。
ESI:正离子模式检测;毛细管电压:3.50kV;锥孔电压:70.00 V;其人二级锥孔电压:3.00 V;六级杆透镜电压:0.3 V;离子源温度:100℃;脱溶剂气温度:350℃;锥孔气流量:50 L/h;脱溶剂气流量:450 L/h。选择质核比范围:100~1500 m/z,扫描方式为多反应监测(MRM),检测通道为普伐他汀钠m/z 448.2→327.7和瑞舒伐他汀(内标)m/z 483.2→258.6。数据由Masslynx 4.02(美国Waters公司)获得和处理。普伐他汀钠和内标的离子扫描图谱见图2。
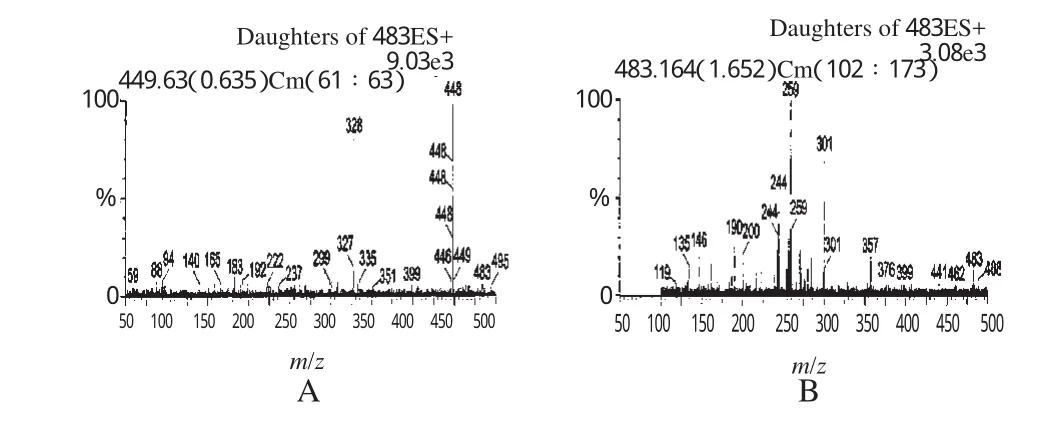
图2 产物离子扫描图谱A.普伐他汀钠;B.瑞舒伐他汀Fig 2 Product ion scan spectraA.pravastatin sodium;B.rosuvastatin
2.2 标准溶液的制备
准确称取普伐他汀钠和内标瑞舒伐他汀各1.0 mg,加甲醇分别溶解于100 ml量瓶中,作为储备母液(普伐他汀钠质量浓度10.0 μg/ml,瑞舒伐他汀质量浓度10.0 μg/ml),于4℃冰箱保存备用。取普伐他汀钠储备母液用甲醇依次稀释成1.25、3.75、10.00、25.00、50.00、125.00 ng/ml系列浓度作为标准工作溶液,于4℃冰箱保存待用;将瑞舒伐他汀储备母液稀释成200.0 ng/ml作为工作溶液,于4℃冰箱保存待用。低、中、高3个(1.25、10.00、125.00 ng/ml)质量浓度的普伐他汀钠标准工作溶液作为质控(QC)样本以备后用。
2.3 血浆样品的处理
健康志愿者给药前抽取静脉血5 ml作为空白对照;给药后1、2、4、6、12、24 h时分别分部分抽取静脉血5 ml,所取全血即时离心制备血浆,存储于-20℃冰箱。待测血浆样品从冰箱取出,于37℃解冻。A部分:微量加样器精密吸取500 μl置离心超滤管中,12000 r/min离心10 min;滤液加内标工作溶液100 μl,涡旋5 min,置另一离心管中,30℃水浴氮气吹干;残留物加流动相150 μl复溶,12000 r/min离心10 min,得上清液即为游离型药物血浆样品;吸取10 μl进样分析。B部分:微量加样器精密吸取500 μl置另一10 ml的离心管中,加内标工作溶液100 μl,加入 100 mmol/L甲酸铵 100 μl,涡旋1 min,再加入叔丁基甲基醚5 ml,涡旋5 min,3000 r/min离心10 min;上清液置另一离心管中,30℃水浴氮气吹干,残留物加流动相150 μl复溶,12000 r/min离心10 min,得上清液即为总的药物血浆样品;吸取10 μl进样分析。
2.4 方法学验证
2.4.1 标准曲线的制备和定量限考察:取空白血浆250 μl,加入普伐他汀钠系列工作溶液50 μl,配成相当于普伐他汀钠血浆浓度为0.25、0.75、2.00、5.00、10.00、50.00 ng/ml的血浆样品,分别按“2.3”项下A部分和B部分方法处理,并进样分析。记录峰面积,以待测物浓度(x)为横坐标,待测物与内标的峰面积比值(y)为纵坐标,用加权最小二乘法进行线性回归,得游离型、总的药物检测的标准曲线方程分别为y=0.0277123 x-0.0100645(r=0.9995)、y=0.0212767 x+0.0006445(r=0.9985)。结果表明,普伐他汀钠血药浓度分别在0.25~50.00 ng/ml、25.00~50.00 ng/ml范围内线性关系良好;定量限为0.25 ng/ml。
2.4.2 专属性:分别将空白血浆、空白加样、游离型血浆样品和总药物型血浆样品分别按“2.3”项下相对应的方法处理,进样分析,结果见图3。在MRM模式下,血浆中普伐他汀钠和瑞舒伐他汀(内标)能够很好地分离,峰形良好,无血浆内源性物质峰干扰。其保留时间分别为普伐他汀钠1.0 min和瑞舒伐他汀1.3 min。
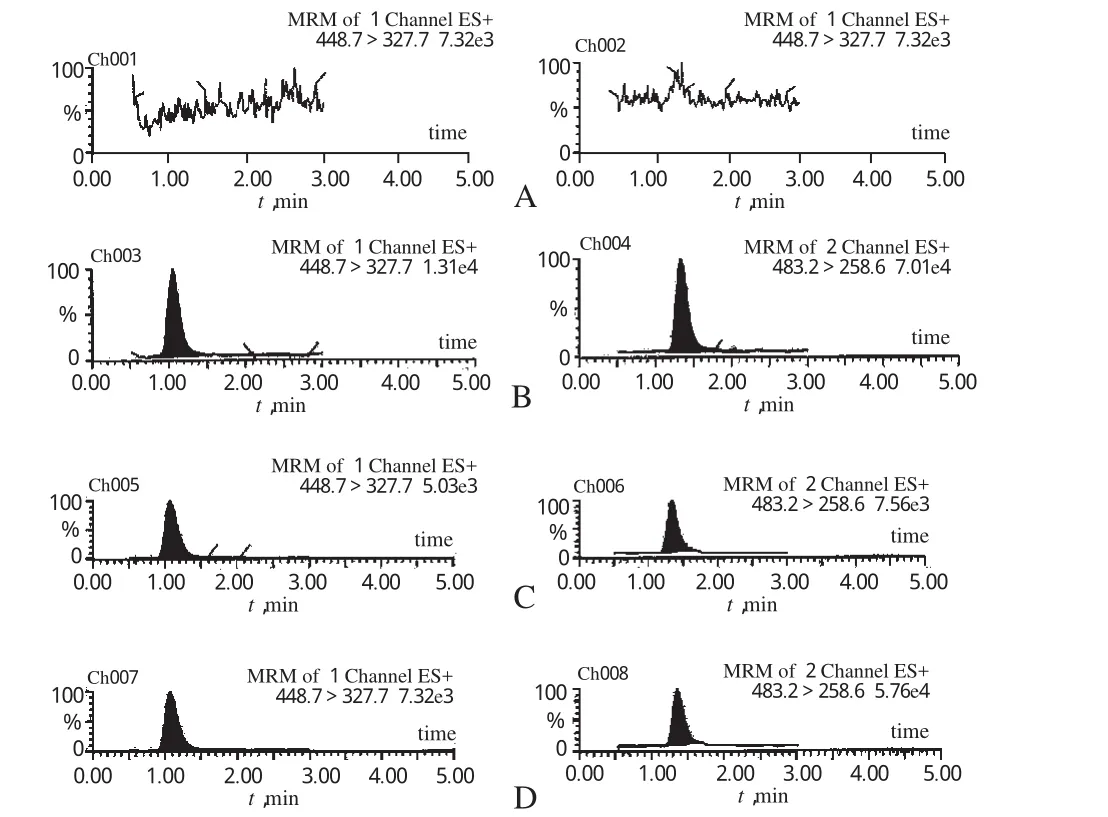
图3 MRM模式下典型色谱图A.空白血浆;B.空白血浆+普伐他汀钠对照品+内标;C.游离型血浆样品;D.总药物型血浆样品;1.普伐他汀钠;2.瑞舒伐他汀Fig 3 The typical chromatograms in MRM modeA.blank plasma;B.blank plasma+pravastatin sodium control+internal standard;C.free type plasma sample;D.whole type plasma sample;1.pravastatin sodium;2.rosuvastatin
2.4.3 方法精密度:分别取空白血浆250 μl,加入高、中、低3个质量浓度的QC样本溶液50 μl,按“2.3”项下A部分和B部分方法分别处理。同一质量浓度样品于同一天连续进样6次,进行日内精密度分析;同一质量浓度样品于连续3 d进样,进行日间精密度分析。其所得RSD值的范围为5.0%~13.4%,说明方法精密度良好,结果见表1。

表1 精密度及回收率试验结果Tab 1 Results of precision and recovery tests
2.4.4 方法回收率:分别取空白血浆250 μl,加入高、中、低3个质量浓度的QC样本溶液50 μl,按“2.3”项下A部分和B部分方法分别处理,记录峰面积,计算浓度。与相对应的QC样本溶液进行比较,得方法的平均加样回收率,A部分方法处理:95.2%、87.2%和90.4%,B部分方法处理:87.5%、88.2%和90.7%,详见表1。
2.4.5 绝对回收率和基质效应:分别取空白血浆250 μl,加入高、中、低3个质量浓度的QC样本溶液50 μl,分别按“2.3”项下A部分和B部分方法分别处理,进样分析,记录峰面积。与上述QC样本溶液直接进样分析所得峰面积进行比较,其所得绝对回收率为(99.4±1.7)%、(99.6±1.6)%、(98.1±2.7)%(A部分方法处理)和(97.1±1.9)%、(98.4±2.2)%、(99.1±2.6)%(B部分方法处理)。QC样本溶液直接进样分析所得峰面积计算所得浓度与QC样本溶液实际浓度比较即为基质效应,其RSD值分别为13.2%、10.1%、7.8%(A部分方法处理),5.2%、8.5%、6.1%(B部分方法处理),符合药物体内分析方法的规定。
2.4.6 稳定性试验:分别取空白血浆250 μl,加入高、中、低3个质量浓度的QC样本溶液50 μl,按“2.3”项下A部分和B部分方法分别处理,分别于室温放置8 h,-20℃放置2周及2个冻融循环,检测放置前后浓度变化。结果,在3种贮存条件下,各浓度样品未见明显的变化。浓度前后变化的偏差小于±15%。说明样品在正常贮存条件下是稳定的。
2.5 蛋白结合率
6名健康成人志愿者空腹口服给药(20 mg)后按上述时间间隔抽取静脉血,按“2.3”项下A部分和B部分方法分别处理,并进样分析。普伐他汀钠蛋白结合率=(总的普伐他汀钠血浆浓度-游离型普伐他汀钠血浆浓度)/总的普伐他汀钠血浆浓度。1、2、4、6h时结果分别(50.5±5.7)%、(51.2±3.5)%、(49.8±6.8)%、(52.4±10.1)%。
3 讨论
药物血浆蛋白结合率是药物与血浆蛋白结合的量占药物总浓度的百分率,是药动学的重要参数之一。它影响药物在体内的分布、代谢与排泄,从而影响其作用强度和时间,并往往与药物的相互作用及作用机制等密切相关。因此,药物血浆蛋白结合率的研究无论对于新药研究开发还是指导临床合理用药都具有重要意义。本试验利用超滤方法处理样品配合灵敏的LC-MS/MS法检测而得游离型普伐他汀血浆浓度,并与溶剂法处理所得总的药物浓度相比较。所得结果可以看出不同时间普伐他汀血浆蛋白结合率约50%左右,保持一种较稳定的状态,其原因可能是随着药物被机体不断代谢,与血浆蛋白结合的药物又不断游离出来,从而使游离型和结合型的药物比例保持相对不变。普伐他汀的血浆清除半衰期约为1.5~2 h左右,由于普伐他汀被机体代谢的原因,志愿者一次性口服给药后12 h和24 h的时间点未能检出普伐他汀,因此,无法计算这2个时间点的血浆蛋白结合率。
超滤是一种筛孔分离过程,主要用来截留分子质量高于500的物质。通过高速离心所施加的压力让游离的药物滤过,而大分子的蛋白和药物和蛋白结合物也被除去。其本身有去除蛋白的作用。但超滤法的使用时因、压力问题而造成部分结合型药物又游离出来,从而对结果产生一定影响。
本文应用超滤和溶剂法处理血浆样品配合LC-MS/MS检测技术,建立了一种专属性强、准确度高、简单快速的普伐他汀钠的临床血药浓度检测方法,通过检测游离型的药物浓度和血中总的药物浓度,可用于测定其在健康志愿者血中的蛋白结合率。
[1]毛利东.普伐他汀的药理作用及临床应用[J].中国实用医药,2010,5(15):180.
[2]宋少冈,陶金成,吴建龙,等.普伐他汀调节冠心病患者血脂及血压的临床观察[J].中国药房,2005,16(22):1725.
[3]Shiomi M,Ito T,Tsukada T,et al.Reduction of serum cholesterol levels alters lesional composition of atherosclerotic plaques.Effect of pravastatin sodium on atherosclerosis in mature WHHL rabbits[J].Arterioscler Thromb Vasc Biol,1995,15(11):1938.
[4]邓鸣,刘会臣,薛洪源,等.HPLC-MS法同时测定人血浆中普伐他汀及其主要代谢物3′α-异普伐他汀[J].药物分析杂志,2005,25(2):160.
[5]谭志荣,欧阳冬生,周淦.简单灵敏的LC-MS/MS方法检测人血浆中普伐他汀的浓度[J].中国新药杂志,2008,17(13):1150.
[6]张敏,谭志荣,陈豪.LC-MS/MS方法检测人血浆中普伐他汀的浓度约[J].药物分析杂志,2009,29(1):58.
