消化道中燕麦β-葡聚糖对EGCG吸附作用的体外研究*
2013-05-05马雅钦高瑞萍崔峻赵国华
马雅钦,高瑞萍,2,崔峻,赵国华,3
1(西南大学食品科学学院,重庆,400715)2(遵义医学院公共卫生学院,贵州 遵义,563000)3(重庆市农产品加工技术重点实验室,重庆,400715)
目前,膳食纤维与功能小分子相互作用研究成为热点。多糖和多酚可以通过氢键、疏水相互作用等结合[1]。许多多糖能与蛋白质竞争结合多酚[2],形成的多糖多酚复合物能为机体提供更持久的抗氧化能力[3]。燕麦β-葡聚糖是以细胞壁非淀粉多糖的形式存在的可溶性膳食纤维,在调节机体免疫功能[4]、抗肿瘤活性[5]、降低胆固醇和血脂以及调节血糖[5-6]等方面起重要作用[7],具有较强的吸附小分子的能力。表没食子儿茶素没食子酸酯(EGCG)是茶多酚中主要功能成分,具有增强机体抵抗力、抗氧化性、抗癌、降血糖血脂等生理功能[8-10]。前期研究表明,β-葡聚糖可主要通过氢键等作用力吸附茶多酚形成复合物[11],并且在合适浓度下二者的复合作用在产物的抗氧化影响上表现为增效作用[12]。影响胃肠液中β-葡聚糖吸附EGCG的因素尚不清楚。利用燕麦β-葡聚糖和EGCG为试验材料,模拟胃肠液反应环境,探讨胃肠液中胃蛋白酶、胰蛋白酶、pH值和EGCG浓度对燕麦β-葡聚糖吸附EGCG的影响,以期探讨体内β-葡聚糖吸附EGCG的生物学作用。
1 材料方法
1.1 实验材料与试剂
燕麦β-葡聚糖,郑州荔诺生物科技公司;EGCG:杭州禾田生物科技有限公司;胃蛋白酶(1∶10 000)、胰蛋白酶(1∶1 000),Sigma公司。色谱甲醇,天津四友化学试剂有限公司;其他试剂均为分析纯,购于成都科龙试剂有限公司。
1.2 仪器与设备
WS-26恒温水浴锅,上海齐欣科学仪器有限公司;PB-10标准型电化学分析仪/pH计(酸度计),德国赛多利斯公司;ALPHA 1-4/2-4LSC真空冷冻干燥机,德国christ公司;高效液相色谱仪,日本岛津公司LC-20A;色谱柱,Thermo公司(Hypersil BDS)(4.6 mm ×250 mm)。
1.3 实验方法
1.3.1 模拟胃肠液的制备
参照Hussain等[13]的方法配制胃肠液。胃液:称取3.2 g胃蛋白酶和7 mL 37%HCl加入1 L的容量瓶,用超纯水定容;肠液:称取6.8g KH2PO4溶于1 L超纯水,加入3.2 g胰蛋白酶,NaOH调节至pH 6.8。不含胃蛋白酶的模拟胃液:7 mL 37%HCl加入1 L的容量瓶,用超纯水定容;不含肠蛋白酶的模拟肠液:称取6.8 gKH2PO4溶于超纯水中,用1 L容量瓶加入超纯水定容,NaOH调节至pH 6.8。
1.3.2 EGCG测定及葡聚糖对EGCG吸附量计算
游离的EGCG采用HPLC方法测定。色谱柱为Hypersil BDS(4.6 mm×250 mm)。流动相 A为100%甲醇,流动相B为2%乙酸溶液,采用等度洗脱10 min,流动相甲醇(A),2%的乙酸(B),体积比为25∶75,流速0.9 mL/min,检测波长278 nm。葡聚糖对EGCG的吸附量用如下公式表示:Q=(c1V-c2V)/m。
式中:Q表示葡聚糖对 EGCG的吸附量(μg/mg);c1表示吸附前EGCG的浓度(μg/mL);c2表示吸附后EGCG的浓度(μg/mL)(HPLC测定可得);m表示葡聚糖的量(mg);V表示溶液的体积。
1.3.3 胃蛋白酶、胰蛋白酶对β-葡聚糖吸附EGCG的影响
分别称取12.5 mg EGCG和12.5 mg葡聚糖溶于含胃蛋白酶、胰蛋白酶和不含胃蛋白酶、胰蛋白酶的pH 1.5胃液和pH 6.8的肠液中,37℃保温30~180 min,间隔时间30 min。经0.45 μm滤膜后HPLC测定。β-葡聚糖对EGCG的吸附量参照1.3.2计算公式得出。
1.3.4 模拟胃肠液的pH对葡聚糖吸附EGCG的影响
用HCl和NaOH对模拟胃肠液的pH进行调节,使胃液 pH值为1.5~4.0,肠液 pH值5~8,称取12.5 mg EGCG和葡聚糖分别溶于25 mL不同pH值的胃液和肠液配成0.5 mg/mL的溶液,摇匀,于37℃保温180 min,经0.45 μm滤膜过滤后测定游离的EGCG浓度。β-葡聚糖对EGCG的吸附量参照1.3.2计算公式得出。
1.3.5 EGCG浓度对胃肠液中葡聚糖吸附EGCG的影响
分别称取 12.5、15、17.5、20、22.5、25 mg EGCG和12.5 mg葡聚糖溶于25 mL pH 1.5的胃液和25 mL pH 6.8的肠液配制成EGCG浓度为0.5~1.0 mg/mL,葡聚糖浓度为0.5 mg/mL的胃液和肠液,于37℃保温180 min。经0.45 μm滤膜后HPLC测定游离EGCG浓度。β-葡聚糖对EGCG的吸附量参照1.3.2计算公式得出。
1.3.6 数据处理方法
以上试验均重复3次,结果以平均值±标准误来表示。并利用SPSS分析数据软件进行显著性分析,最后运用origin作图软件进行作图。
2 结果与分析
2.1 胃蛋白酶、胰蛋白酶对β-葡聚糖吸附EGCG的影响
由图1可看出,总体而言含胃蛋白酶的胃液中β-葡聚糖对EGCG吸附比不含胃蛋白酶的胃液吸附量大,且随着时间的延长,吸附量均逐渐增大,当时间为120 min时,含胃蛋白酶和不含胃蛋白酶的模拟胃液中的吸附量基本相等。由于多糖与蛋白质在吸附小分子物质方面存在竞争性。所以胃蛋白酶的加入可能与β-葡聚糖竞争性吸附EGCG,胃蛋白酶吸收一部分EGCG,而使得游离EGCG减少,故而显示出β-葡聚糖对EGCG的吸附量增大。

图1 模拟胃液中胃蛋白酶对β-葡聚糖吸附EGCG的影响Fig.1 The influence of pepsin on the adsorption of EGCG onto β-glucan in simulated gastric juice
由图2可看出,含胰蛋白酶的肠液中β-葡聚糖对EGCG吸附比不含胰蛋白酶的肠液吸附明显增大,且随着孵育时间延长吸附量也逐渐增大。可能的原因是胰蛋白酶作为一种蛋白质,它的加入可能与β-葡聚糖竞争性吸附EGCG,使得游离EGCG含量减少,吸附量增大。也有可能是胰蛋白酶的加入使得β-葡聚糖活性位点发生改变,促进了 β-葡聚糖对EGCG的吸附。

图2 模拟肠液中胰蛋白酶对葡聚糖吸附EGCG的影响Fig.2 The influence of trypsin on the adsorption of EGCG onto β-glucan in simulated intestinal juice
由图1和图2可以看出,在含有蛋白酶的胃肠液中β-葡聚糖对于EGCG吸附量高于不含蛋白酶的EGCG吸附量。在进食的情况下,机体分泌胃蛋白酶和肠蛋白酶的量都会增加。所以从蛋白酶对葡聚糖吸附EGCG的影响看,进食会有利于EGCG的吸附。
2.2 模拟胃肠液的pH值对葡聚糖吸附EGCG的影响
如图3所示,在模拟胃液中,随着胃液的pH值逐渐增大,β-葡聚糖对EGCG的吸附量增大。pH值低于3.0时,吸附量处于较低的水平;当pH值高于3.0时,EGCG吸附量增加显著,且在pH值为3.5和4.0时无显著性差异。低pH值时的吸附量较少的原因可能是燕麦β-葡聚糖在酸性环境下容易发生水解以及低pH值导致β-葡聚糖构象发生变化。一般禁食状态下胃液的pH值为1.5左右,由于进食会导致胃液pH值增大[14],所以可以推断进食状态β-葡聚糖对EGCG的吸附量较大。
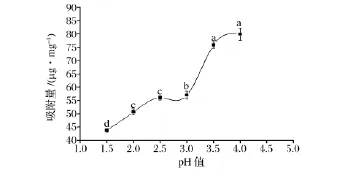
图3 模拟胃液pH对葡聚糖吸附EGCG的影响Fig.3 The effects of the pH of simulated gastric juice on the adsorption of EGCG onto β-glucan
如图4所示,在体外模拟肠液中,随着肠液pH值增大(5.0~7.5),β-葡聚糖对EGCG的吸附逐渐增大,当pH 6.5时吸附量最大,随后降低。分析原因可能是EGCG在偏碱性条件下不稳定,部分EGCG发生氧化而导致响应因子减少,导致吸附量降低[15]。

图4 模拟肠液pH对葡聚糖吸附EGCG的影响Fig.4 The effects of the pH of simulated intestinal juice on the adsorption of EGCG onto β-glucan
由图3和图4可以看出,pH值对胃肠液中β-葡聚糖吸附EGCG有显著影响,这主要是因为pH值的改变会影响β-葡聚糖和EGCG单体的稳定性,导致响应物质含量改变,使得β-葡聚糖-EGCG复合物的生成量产生变化。这为将来研究β-葡聚糖-EGCG复合物包埋后在胃肠道中的释放提供参考。
2.3 模拟胃肠液的EGCG浓度对β-葡聚糖吸附EGCG的影响
如图5所示,β-葡聚糖对EGCG的吸附量随着EGCG的浓度增大而逐渐增大。浓度在低于0.6 mg/mL时,吸附量处于低水平;在高于0.6 mg/mL时,β-葡聚糖对EGCG的吸附量与EGCG浓度呈线性相关。图5中可看出,EGCG浓度对吸附具有较大的影响,故可以通过提高EGCG的浓度来提高β-葡聚糖对EGCG吸附量。

图5 模拟胃液中EGCG浓度对β-葡聚糖吸附EGCG的影响Fig.5 The effect of the EGCG concentration on the adsorption of EGCG onto β-glucan in simulated gastric juice
如图6所示,随着EGCG浓度增大,β-葡聚糖对EGCG的吸附量逐渐增大,浓度在0.7~0.8 mg/mL之间增幅较平缓,但存在显著性差异。可以通过提高EGCG的浓度来提高体外模拟肠液中 β-葡聚糖对EGCG吸附量,为体内研究提供参考。
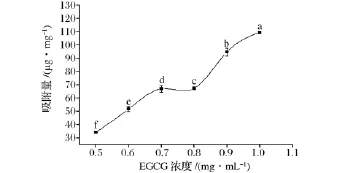
图6 模拟肠液的EGCG浓度对β-葡聚糖吸附EGCG的影响Fig.6 The effect of the EGCG concentration on the adsorption of EGCG onto β-glucan in simulated intestinal juice
由图5和图6可以看出,EGCG浓度的升高与胃液和肠液中的β-葡聚糖对EGCG的吸附量增大呈正相关。原因是可能是β-葡聚糖和EGCG主要通过氢键相结合[11],EGCG浓度的增加,增加了EGCG响应因子的数量,与β-葡聚糖结合机率提高,使得吸附量增大。
3 结论
对体外模拟胃肠液中燕麦β-葡聚糖吸附EGCG的影响因素进行研究,结果表明模拟胃肠液中胃蛋白酶、胰蛋白酶、pH值、EGCG浓度等因素的改变会影响燕麦β-葡聚糖对于EGCG的吸附量。加入胃蛋白酶和胰蛋白酶,由于蛋白酶和燕麦β-葡聚糖存在竞争性结合关系,故使EGCG吸附量增大。pH值的改变,影响燕麦β-葡聚糖和EGCG的结构与构象稳定,对燕麦β-葡聚糖吸附能力产生较大影响:模拟胃液中随pH值升高,β-葡聚糖吸附能力逐渐增强;肠液中随pH升高,吸附能力首先升高然后下降,pH值在6.5时,其吸附能力最大。EGCG浓度的升高,会使得EGCG作为响应因子增多,也使β-葡聚糖对EGCG的吸附能力增强。
[1] Hanlin R L,Hrmova M,Harbertson J F,et al.Condensed tannins and grape cell wall interactions and their impact on tannins extractability into wine[J].Australian Journal of Grape and Wine Research,2010,16(1):173-188.
[2] De Freitas V,Carvalho E,Mateus N.Study of carbohydrate influence on protein-tannin aggregation by nephelometry[J].Food Chemistry,2003,81(4):503 -509.
[3] Rondinin L,Peyrat-Maillard M N,Marsset-Baglieri A,et al.Bound ferulic acid from bran is more bioavailable than the free compound in rat[J].Journal of Agriculture and Food Chemistry,2004,52(13):4 338-4 343.
[4] 李万坤,闫鸿斌,才学鹏,等.β-葡聚糖的免疫增强作用机理研究进展[J].中国畜牧兽医,2007,34(5):151-155.
[5] 申瑞玲,王志瑞,李宏全,等.燕麦β-葡聚糖对高胆固醇血症大鼠血脂和生长的影响[J].中国粮油学报,2009,24(1):44-48.
[6] Chen J Z,Kenneth R.Beta-glucans in the treatment of diabetes and associated cardiovascular risks[J].Vascular Health and Risk Management,2008,4(6):1 265 -1 272.
[7] Wood P J.Cereal β-glucans in diet and health [J].Journal of Cereal Science,2007,46(3):230-238.
[8] Kim H,Hiraishi A,Tsuchiya K,et al.(-)-Epigallocatechin gallate suppresses the differentiation of 3T3-L1 preadipocytes through transcription factors FoxO1 and SREBP1c[J].Cytotechnology,2010,62(3):245-255.
[9] Tai K K,Truong D D.(-)-Epigallocatechin-3-gallate(EGCG),a green tea polyphenol,reduces dichlorodiphenyl-trichloroethane(DDT)-induced cell death in dopaminergic SHSY-5Y cell[J].Neuroscience Letters,2010,482(3):183-187.
[10] 全知怎,苏俭生.EGCG与肿瘤细胞Wnt信号转导通路的研究进展[J].口腔颌面外科杂志,2011,21(3):219-222.
[11] Gao R P,Liu H,Peng Z,et al.Adsorption of(-)-Epigallocatechin-3-gallate(EGCG)onto oat β-Glucan [J].Food Chemistry,2012,132(4):1 936-1 943.
[12] Wu Z,Ming J,Gao R P,et al.Characterization and antioxidant activity of the complex of tea polyphenols and oat β-glucan[J].Journal of Agriculture and Food Chemistry,2011,59(19):10 737-10 746.
[13] Hussain F,Arayne M S,Sultana N.Interactions between sparfloxacin and antacids-dissolution and adsorption studies[J].Pakistan Journal of Pharmaceutical Sciences,2006,19(1):16-21.
[14] Omen A G,Hack A,Minekus M,et al.Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants[J].Environmental Science& Technology,2002,36(15):3 326-3 334.
[15] Frei B,Higdon J V.Antioxidant activity of tea polyphenols in vivo:evidence from animal studies[J].Journal of Nutrition,2003,133(10):3 275-3 284.
