地被菊‘雪公主’的组织培养和快速繁殖
2013-04-25董凤丽刘晨旭周蕴薇
马 欣,董凤丽,刘 杰,刘晨旭,周蕴薇
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
菊花是我国的传统名花,也是世界上重要的切花种类之一。地被菊(Chrysanthemumgrandiflorum)是菊科菊属的多年生宿根草本花卉,是菊花中的一个品种群,具有植株低矮、耐粗放管理、花紧密、花期长等特点[1]。地被菊还具有较强的抗寒性和抗旱性,适合于露地栽植过冬等特点,因而越来越广泛地应用于城市绿化。目前,对于地被菊的组织培养和快速繁殖也有研究,如利用叶片[2]、茎段[3]、花瓣[4]、子房[5]等外植体建立再生体系和对试管苗的生根研究[6]。成功的基因转化首先依赖于良好的植物受体系统的建立,其中外植体的选择以及能产生高再生能力的培养体系的确立是转化体系建立的关键[7]。但地被菊花品种繁多,而其再生受基因型的限制,再生体系没有普遍性,有些品种再生不稳定[8],不同品种叶片的再生能力具有一定的差异,而且不同品种的胚性愈伤组织的诱导差别很大[9]。此外,由于后期基因的遗传转化多采用叶盘法[10],所以,本研究以地被菊‘雪公主’叶片为材料,对外植体消毒,通过设置不同激素配比浓度,筛选出愈伤组织诱导、分化和继代生根的最佳培养基,建立高效、稳定的再生体系,期为基因工程提供良好的受体系统,以及为后期的基因遗传转化和细胞工程育种提供依据。
1 材料与方法
1.1供试材料 选择东北林业大学园林学院花卉研究所内地被菊‘雪公主’的带腋芽茎段为外植体。
1.2试验方法
1.2.1无菌材料的获得 将采集的带腋芽的茎段在洗衣粉水中漂洗5 min,用流水冲洗30~60 min,除去有损伤的部分。在超净工作台上用无菌水冲洗3次,用75%的酒精消毒30 min,无菌水洗3遍,用2%的NaClO分别浸泡灭菌4、5、6、7、8 min,无菌水彻底清洗3遍。用无菌滤纸吸干表面的水分,接种到MS培养基中。7 d左右统计污染率,20 d侧芽长成1 cm左右。
1.2.2叶片愈伤组织的诱导和分化 选择继代20 d左右的嫩苗,将顶端第2-3片叶子除去叶缘,切成5 mm×5 mm的叶盘,随后接种到在MS培养基附加不同浓度6-BA(1.0、1.5、2.0 mg·L-1)和NAA(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mg·L-1)的培养基中诱导愈伤组织及芽分化,使其叶盘近轴面接触培养基,每个处理6个重复。10 d后统计愈伤组织的诱导率,25 d后统计芽的分化率。
1.2.3茎段的增殖 选择继代20 d左右的嫩苗,切取长度约1.5 cm带有两个腋芽的嫩茎段,随后接种到在MS培养基附加不同浓度6-BA(0、0.1、0.2、0.3、0.4 mg·L-1)和NAA(0、0.1、0.2、0.3、0.4 mg·L-1)的培养基中,诱导茎段的增殖。每个三角瓶中接种两棵茎段,每个处理10个重复,20 d后统计增殖系数。
1.2.4继代生根 待不定芽生长至约1.5 cm时自基部剪下,接种至MS培养基中进行继代培养,每20 d左右继代一次。生根培养时,将不定芽接种至分别添加NAA(0、0.1、0.2、0.3、0.4、0.5、0.6 mg·L-1)的MS培养基和1/2MS培养基中培养,每处理3个重复,10 d后统计生根率和平均生根系数。
1.2.5炼苗移栽 将生根后的组培苗炼苗1 d后,取出并洗净根部附着的培养基,移栽至经过高压灭菌的蛭石中,15 d后移栽到沙和土壤的混合壤土中,30 d后统计成活率。
1.3培养条件 培养基均以MS为基本培养,培养基含蔗糖30 mg·L-1、琼脂8~9 g·L-1,培养基在高压灭菌前将pH值调至5.8;1/2MS培养基中大量元素减半,pH值不变。培养温度为(25±2) ℃,光照强度为2 000 lx,光照时间为12 h·d-1。
1.4评价指标
污染率=(污染个数/接种个数)×100%;
萌发率=(萌发个数/存活个数)×100%;
诱导率=(形成愈伤组织的材料/接种个数)×100%;
分化率=(再生不定芽的外植体数/接种个数)×100%;
增殖系数=增殖后的幼苗数/接种的幼苗数;
生根率=(生根的幼苗数/接种的幼苗数)×100%;
平均生根数=根的总数/生根的幼苗数。
2 结果与分析
2.1消毒时间对污染率的影响 外植体自身的生长状况对于再生体系的建立有着重要的影响,所以外植体的消毒也是一个重要过程。本试验选用NaClO进行消毒,不仅消毒效果明显,还不必进行废液回收,相比于升汞更加简便、环保。对消毒时间进行对比表明,随着消毒时间的增加,污染率降低,但是外植体受腐蚀情况严重,导致萌发率降低。消毒8 min时虽然污染率最低(5个),但此时萌发率仅为52.6%(表1)。用2%的NaClO浸泡处理6 min时,污染率为25%,此时消毒效果最佳。
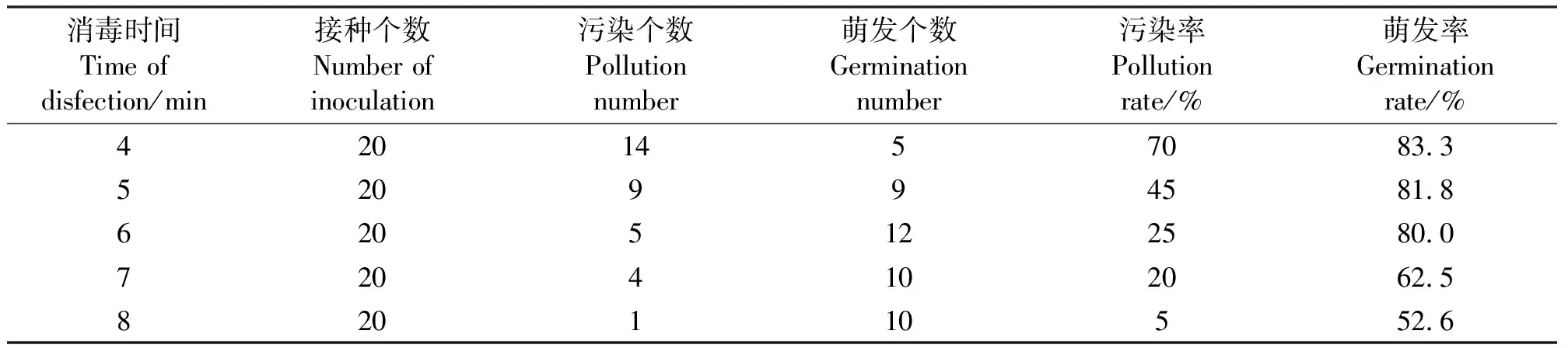
表1 外植体的消毒时间和污染率Table 1 Disinfection time and polluted rate of explants
2.2不同激素浓度的培养基对叶片分化的影响 再生苗的幼嫩叶片再生能力较强。选择大小和营养长势一致的叶片,接种7 d后,叶片在切口处长出嫩绿色的愈伤组织。20 d后,有的愈伤组织边缘开始分化出绿色的芽点。试验表明,叶片基部的分化率高于其他部分。本试验采用菊花组织培养中最常用的植物生长调节剂6-BA和NAA,所设定的培养基所培养愈伤的诱导率均达到100%。当6-BA一定时,叶片的分化率随着NAA浓度的变大而升高;达到一定高度时又出现抑制现象(表2)。当6-BA和NAA的浓度分别为1.0和0.6 mg·L-1时,分化率达最高,即在培养基MS+1.0 mg·L-16-BA+0.6 mg·L-1NAA上,叶片的分化率最高,为63.6%。
2.3不同激素浓度对茎段增殖的影响 将继代25 d左右的嫩苗自基部剪下,接种到附加不同浓度6-BA和NAA的MS培养基中,促进丛生芽形成。25 d后,丛生芽的数量达最高,但随着时间的增加,由于培养基营养的缺乏,丛生芽有萎蔫的趋势。MS培养基不能促进茎段的增殖,随着6-BA和NAA浓度的升高,茎段的增殖系数也逐渐升高,但当6-BA和NAA分别升至0.3和0.2 mg·L-1时达到最高值(表3)。因此,在培养基MS+0.3 mg·L-16-BA+0.2 mg·L-1NAA上,茎段的增殖系数最高(6.73),且丛生芽的生长状态良好。
2.4不同培养基对继代生根的影响 待丛生芽生长约1.5 cm时自基部剪下,接种至MS培养基中进行继代培养。结果表明,MS培养基对于‘雪公主’不仅有较好的继代效果,而且有良好的复壮作用。同瓶培养的苗数以两棵为宜,过多则长势受到明显影响。同时,随着继代次数的增加,组培苗出现了长势变弱的趋势。虽然在MS培养基中,‘雪公主’也有明显的生根现象,但是1/2 MS培养基诱导的根数较多,生根率达100%,平均生根数为8条。在1/2 MS培养基中添加不同浓度的NAA时,其生根系数呈随浓度增加而提高的趋势。但当NAA浓度高于0.5 mg·L-1时,生根系数下降,地上部分的生长势也下降。所以,生根培养基选用1/2MS+0.5 mg·L-1NAA培养基(表4)。
2.5组培苗的驯化及移栽 在生根培养基上培养25 d后,选择生长健壮的无菌苗,经过1 d的炼苗后,取出,并洗净根部附着的培养基,移栽至经过灭菌的蛭石中。注意遮阴处理,通风保湿,15 d后移栽到沙和土壤的混合壤土中。30 d后组培苗的成活率可达100%,而且生长良好(图1)。
3 讨论
在地被菊的组织培养研究中,不同的组织或器官都可以作为外植体,但是由带腋芽的茎段获得无菌苗更加简便,而且比叶片受消毒的影响小,所以本研究选择的外植体为带腋芽的茎段。对于外植体的消毒,采用NaClO能达到良好的效果,相比于以往的试验中采用的升汞消毒法,不仅减少了对人体的毒害作用,也大大降低了环境污染[11]。虽然在以往地被菊的组织培养中生长调节物质有多种,但受基因型影响,6-BA和NAA对‘雪公主’影响显著,所以本研究采用这两种激素进行诱导,建立再生体系。由于叶盘法是菊花基因转化的主要方法,而且转化后的体细胞胚胎发生的再生植株遗传稳定性很强[12],所以以叶片诱导丛生芽的研究比其他组织或器官有更加重要的意义。

表2 不同6-BA和NAA浓度对叶片分化的影响Table 2 Effects of different concentrations of 6-BA and NAA on the differentiation capability of leaf blades

表3 不同6-BA和NAA浓度对茎段增殖的影响Table 3 Effects of different concentrations of 6-BA and NAA on the proliferation of stem segments

表4 基本培养基和不同NAA浓度对丛生芽生根的影响Table 4 Effects of basal medium and different concentrations of NAA on rooting of adventions buds

图1 地被菊再生体系几个连续阶段的培养情况Fig.1 Sequential phases of Chrysanthemum grandiflorum regeneration system
在地被菊的快速繁殖研究中,不仅不同品种的愈伤组织分化差别很大,而且同一品种同一器官的不同部分分化率也存在很大差别。试验中发现,叶片基部的分化能力大于其他部分,这与花瓣[13]的研究结果相似,原因可能是叶脉处的细胞更易于分化出不定芽。所以,对于叶片大小和营养长势的选择也应尽量一致,试验中认为具有20 d左右苗龄的无菌苗中上部幼嫩叶片基部的再生能力高,这与前人的研究相符[14]。
由于每次得到的无菌苗数量有限,不足以为后期的试验提供足够的材料,所以通过继代培养来扩大无菌苗的数量也是必要的。试验中随着继代次数的增加,出现了组培苗长势下降的现象,原因可能是组培苗经过多次继代培养后出现了遗传不稳定性。而且随着同瓶培养的苗数的增加,组培苗的长势明显下降,说明瓶中空间对于组培苗的生长也有很大影响,结果发现同瓶培养的无菌苗数量以2~3株效果最佳。另外,做生根培养时,1/2MS培养基好于MS培养基,这与多数研究结果一致[15]。原因可能是矿质元素浓度较低时有利于生根,较高时有利于发展茎叶,高浓度的无机盐抑制了不定根的生长。
本研究以地被菊‘雪公主’为试验材料,通过设定不同浓度的6-BA和NAA建立再生体系,完成了快速繁殖的过程。由于地被菊花优良品种种源较少,所以通过组织培养可迅速快繁。再生体系的建立不仅为后期的基因转化奠定了基础,而且大大地提高了繁殖系数, 使地被菊‘雪公主’的大规模快速生产成为可能。
[1] Chen J Y,Wang S Q,Wang X C,etal.Thirty years studies on breeding ground-cover Chrysanthemum new cultivars[J].Acta Hort,1995,404:124-135.
[2] Fukai S,De G J,Rademaker W.Agrobacterium-mediated genetic transformation of Chrysanthemum[J].Acta Horticulture,1995,392:147-152.
[3] 蒋细旺,刘国锋,包满珠,等.菊花9个品种叶片和茎段快速高效再生体系的建立[J].华中农业大学学报,2003,22(2):162-166.
[4] 孙淑斌,徐文君,衣艳君,等.地被菊的再生与转化系统的建立[J].植物生理学通讯,2006,42(6):1032-1036.
[5] 李辛雷,陈发棣,王红,等.菊花外植体再生体系的研究[J].上海农业学报,2004,20(2):13-16.
[6] 张瑞麟,范敏.地被菊的组织培养及快速繁殖[J].植物生理学通讯,2001,37(6):531-537.
[7] 高亦珂,丁国勋,张启翔,等.菊花茎叶外植体再生体系的研究[J].北京林业大学学报,2001,23(1):32-33.
[8] De J G,Rademaker W,Van Wordragen M F,etal.Restoring adventitious shoot formation on Chrysanthemum leaf explants following cocultivation withAgrobacteriumtumefaciens[J].Plant Cell,Tissue and Organ Culture,1993,32:263-270.
[9] Mandal A K A,Datta S K.Direct somatic embryogenesis and plant regeneration from ray florets of chrysanthemum[J].Biologia Plantarum,2005,49:29-33.
[10] Nehra N S,Chibbar R N,Kartha K K,etal.Genetic transformation of strawberry by agrobacterium tumefaciens using a leaf disk regeneration system[J].Plant Cell Reports,1999,9:293-298.
[11] 何俊平,涂小云,周艳宝,等.非洲菊品种玲珑再生体系的建立[J].江苏农业科学,2012,40(7):56-58.
[12] 蒋细旺,张启翔.地被菊间接体细胞胚发生途径的转基因受体体系的研究[J].林业科学研究,2007,29(3):62-68.
[13] 毛洪玉,李晓辉,刘志刚,等.地被菊幼嫩花瓣组织培养研究[J].沈阳农业大学学报,2005,36(1):68-71.
[14] 吕晋慧,吴月亮,孙磊,等.菊花叶片不定芽再生体系的研究[J].北京林业大学学报,2005,27(4):97-100.
[15] 晨卉,王艳芳,陈素梅,等.五种菊花近缘植物组织培养研究[J].南京农业大学学报,2009,32(3):30-35.
