青虾咽侧体抑制激素基因全长cDNA序列的克隆及表达分析
2013-04-19卜宪飞李真真乔慧傅洪拓滟龚永生蒋速飞熊贻伟
卜宪飞李真真乔 慧傅洪拓,吴 滟龚永生蒋速飞熊贻伟
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
青虾咽侧体抑制激素基因全长cDNA序列的克隆及表达分析
卜宪飞1李真真2乔 慧2傅洪拓1,2吴 滟2龚永生2蒋速飞2熊贻伟2
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
咽侧体抑制激素(Allatostatin, AST)是一类由几至几十个氨基酸构成的神经肽类激素, 在甲壳动物中刺激下颌器官合成甲基法尼酯, 影响甲壳动物的蜕皮和生殖。然而AST基因在甲壳动物中的克隆和表达却罕见报道。研究克隆了青虾的AST基因全长cDNA序列, 在甲壳动物中使用荧光定量PCR技术检测了AST基因在不同组织中的表达。青虾AST基因cDNA全长2995 bp, 包括242 bp的5′非编码区(UTR), 647 bp的3′UTR, 2106 bp的开放阅读框(ORF)。开放阅读框编码701个氨基酸, 可转录翻译出35个AST多肽, 在C末端都具有相同的 Y/FXFGL-amide结构, 属于A型-AST。氨基酸序列比对显示保守氨基酸为Tyr、Ala、Phe、Gly、Leu。蛋白相似度比对显示, AST多肽在无脊椎动物的进化中是相对保守的。系统进化树分析表明, 青虾AST多肽与罗氏沼虾聚在一起, 具有最近的亲缘关系。荧光定量PCR检测显示, AST基因在所有被检测组织中均有表达, 由高到低依次为: 肝胰脏>肠道>精巢>脑>心脏>卵巢。对青虾AST基因全长cDNA序列克隆和表达的研究为更进一步的了解AST多肽在青虾中的重要功能奠定了基础。
青虾; 咽侧体抑制激素; 基因克隆; 基因表达
咽侧体抑制激素(Allatostatin, AST)是一类由几至几十个氨基酸构成的神经肽, 由脑神经细胞分泌的AST多肽前体水解而来。AST多肽首先在昆虫中被发现, 迄今已在昆虫中分离纯化出70多种。AST多肽通过神经或体液途径到达咽侧体(Corpora allata, CA), 抑制咽侧体的活性, 调节咽侧体对保幼激素(Juvenile hormone, JH)的合成与释放, 是参与昆虫蜕皮和生长发育过程的一类重要激素[1]。除此以外, AST多肽还具有抑制肠道肌肉收缩[2,3]、抑制心脏搏动和输卵管蠕动[4], 并能通过抑制卵黄蛋白原的合成与释放从而抑制卵的形成等多种功能[5,6]。在AST多肽分离鉴定的基础上, 许多编码AST的基因也已经被克隆。在Donly第一次鉴定了折翅蠊的AST基因全长cDNA序列[7]之后, 直翅目(Orthopteran)[8—10]、双翅目(Dipteran)[3,11]、鳞翅目(Lepidoteran)[12,13—16]、网翅目(Dictyopteran)[17,18]中某些昆虫的AST基因全长cDNA序列也相继被确定。
除昆虫以外, AST多肽也广泛存在于甲壳动物(Crustecean)、腔肠动物(Coelenterate)以及软体动物(Mollusk)中。在甲壳动物中, 斑节对虾(Penaeus monodon)、利莫斯螯虾(Orcanectes limosus)和三叶真蟹(Carcinus maenas)中都分离提取到多种AST多肽[19]。神经生理学研究表明, AST多肽在甲壳类动物体内分布广泛, 除了参与神经、肌肉收缩节律以及神经肌肉接头兴奋电位调节之外, 还参与刺激下颌器官(Mandibular organs, MO)甲基法尼酯(Methyl farne-soate, MF)的生物合成, 从而促进蜕皮以及性腺的成熟[20—24]。然而目前有关甲壳动物AST基因的研究却很少有相关报道, 仅见罗氏沼虾(Macrobrachium rosenbergii)、克氏螯虾(Procambarus clarkii)和大海虾(Panulirus interruptus)AST基因全长cDNA序列的克隆。同属无脊椎动物的甲壳动物与昆虫同源性较高, 都具有周期性蜕皮等生命规律, 因此在甲壳动物中开展AST基因的研究对于甲壳动物生长发育机制的研究具有十分重要的意义。
青虾(学名日本沼虾, Macrobrachium nipponense)是我国淡水养殖虾蟹类的重要品种, 然而随着累代养殖规模的扩大, 青虾养殖过程中普遍出现性早熟等品种退化现象。因此, 开展青虾蜕皮及生殖发育相关功能和机制的研究, 对实现青虾产业的可持续性发展, 培育高产高效、品质优良的养殖品种十分必要。本研究拟采用分段克隆法克隆了青虾AST基因全长cDNA序列, 并对其结构特征进行分析探讨,采用荧光定量PCR技术(qRT-PCR)检测了该基因在青虾体内的表达, 以期为青虾蜕皮及生殖发育相关基因的克隆研究奠定基础。 qRT-PCR技术应用于甲壳动物AST基因的研究, 可为甲壳类蜕皮及生殖发育相关研究提供有益借鉴。
1 材料与方法
1.1 材料
实验虾 实验青虾为野生青虾, 采自太湖无锡湖区, 暂养在实验室一周, 24h充氧, 养殖温度维持在26—28℃, 日换水量约为1/2, 每天投喂2次。用于即时RNA提取。
仪器和试剂 RNAiso Plus、cDNA第一链合成试剂盒、3′-Full RACE Kit、5′-Full RACE Kit购自大连宝生物工程有限公司(TaKaRa); iScript cDNA Synthesis Kit、SsoFast EvaGreen Supermix购自伯乐生命医学产品(上海)有限公司(BIO-RAD); RNeasy Mini Kit购自QIAGEN; UNIQ-10柱式DNA胶回收试剂盒和引物合成等其他试剂均购自上海生工生物工程有限公司(Sangon)。冷冻离心机(贝克曼库尔特Microfuge 22R); 凝胶成像系统(法国Vilber Chemismart系列); 紫外分光光度计(艾本德 BioPhotometer); PCR仪(艾本德 Autherized Thermal Cycler);荧光定量PCR仪(伯乐 BIO-RAD iQ5)。
1.2 方法
总RNA的提取及cDNA第一链的合成 取青虾脑、肠道、肝胰脏、心脏、精巢、卵巢6种组织, 按照RNAiso Plus的操作步骤, 研磨、裂解组织后用传统的酚仿抽提法提取总RNA。提取的各组织总RNA均使用RNA-freeDNaseⅠ纯化, 纯化后的RNA用琼脂糖凝胶电泳和紫外分光光度计检测其质量及浓度, 按照TaKaRa cDNA第一链合成试剂盒说明书进行反转, −20℃保存, 用于AST基因全长cDNA序列的克隆。用于荧光定量表达的cDNA由BIO-RAD的iScript cDNA Synthesis Kit合成, −20℃保存。
引物设计 由于已知甲壳类AST基因全长cDNA序列长度都在3000 bp左右, 因此本研究采用分段克隆的方法, 根据大海虾(Panulirus interruptus)、克氏螯虾(Procambarus clarkii)、罗氏沼虾(M. rosenbergii)的氨基酸序列及罗氏沼虾的AST 基因全长cDNA序列的比对结果挑选4段保守序列, 针对这4段保守序列分别设计4组引物(每组2—3对),保证目的片段中相邻的两段上有20个左右的重叠序列, 克隆得到中间序列。
青虾AST基因全长cDNA序列的获得 采用分段克隆方法获得了青虾AST基因全长cDNA序列。
以青虾脑组织cDNA为模板, 用4组引物克隆出了青虾AST基因的中间序列(表1)。PCR反应体系为50 μL, 反应条件为: 94℃ 2min; 94℃ 30s; 56℃30s; 72℃ 30s; 35个循环, 72℃ 5min。PCR产物经1.2%琼脂糖凝胶电泳检测, 回收后与pMD18-T载体连接, 并转化入感受态中。挑取阳性克隆菌落送往上海生工生物公司测序, 将所得AST基因cDNA中间序列于NCBI中进行Blastx同源性分析。
根据已获得的青虾AST基因cDNA中间序列设计3′ RACE引物3ASF1和3ASF2以及5′ RACE引物5ASR1和5ASR2(表1)。根据3′-Full RACE、5′-Full RACE试剂盒操作步骤, 分别扩增AST基因cDNA的3′端和5′端序列。反应循环数为25, 其他条件如前。PCR产物同样经1.2%琼脂糖凝胶电泳检测、回收后, 与pMD18-T载体连接, 并转化入感受态中。挑取阳性克隆菌落送往上海生工生物公司测序, 将所得AST基因cDNA 3′端和5′端序列于NCBI中进行Blastx同源性分析。

表1 本实验所用的引物及其序列Tab.1 Primers and their sequences
序列分析 采用ContigExpress软件将中间序列、3′端序列、5′端序列拼接得到AST基因全长cDNA序列。
在NCBI中对AST基因全长cDNA序列BLAST比对并做同源性分析; 用DNAStar软件寻找开放阅读框并翻译出相应的氨基酸序列; 使用SMART在线软件分析蛋白质的结构及功能; 用ClustalX软件及DNAStar软件包中的MegAlign软件对蛋白序列作比对及同源性分析; 采用MAGE4.0软件以邻接法(Neighbour-Joining)根据不同物种的AST氨基酸序列构建系统进化树。
实时荧光定量PCR (qR T-PCR)的相对表达分析 取青虾精巢、卵巢、心脏、肝胰脏、脑、肠道6种组织的RNA, 用BIO-RAD的iScript cDNA Synthesis Kit合成cDNA。根据获得的AST基因全长cDNA序列设计一对荧光定量特异引物QASF1和QASR1(表1); 根据罗氏沼虾β-actin基因全长cDNA序列设计一对内参引物Actin F和Actin R(表1)。qRT-PCR反应体系为25 μL: 上下游引物各0.5 μL, Super Mix 10 μL, ddH2O 13 μL, 模板cDNA 1 μL (总量为50 ng)。反应条件按照BIO-RAD SsoFast EvaGreen Supermix推荐条件: 95℃ 30s; 95℃ 5s; 60℃ 10s; 35个循环。反应在BIO-RAD iQ5中进行,每种组织cDNA样品做3个重复, 并作3个不加cDNA模板的阴性对照重复。内参基因β-actin基因同样每种组织cDNA样品做3个重复, 并作3个不加cDNA模板的阴性对照重复, 反应条件同上。
用BIO-RAD iQ5自带实时分析软件进行溶解曲线分析, 用2−ΔΔCt法[25,26]计算目的基因mRNA的相对表达量并作图; 使用SPSS13.0软件进行显著性分析; 用Turkey法进行多重比较分析(P<0.05为显著水平)。
2 结果
2.1 青虾AST基因全长cDNA序列的克隆和分析
以青虾脑组织cDNA为模板, 采用分段克隆方法和3′ RACE、5′ RACE法对AST基因全长cDNA序列进行克隆, 得到全部中间序列和3′末端、5′末端。采用ContigExpress软件分析并拼接各片段, 得到AST基因cDNA序列全长2995 bp, 包括242 bp的5′非编码区(Untranslated region, UTR), 2106 bp的开放阅读框(Open reading flame, ORF)以及647 bp的3′ UTR, 并且3′端具有典型的AATAAA加尾信号。开放阅读框含有一个典型的起始密码子ATG及一个终止密码子TAG, 共编码701个氨基酸。这些氨基酸的酶切位点为G-K/R-R, 可转录翻译出35个AST多肽, 这些多肽分别由6—18个氨基酸组成,并且在C末端具有相同的 Y/FXFGL-amide结构,属于A型-AST。青虾AST基因全长cDNA序列已提交GenBank, 序列号为JQ014170。
2.2 青虾AST氨基酸序列比对及系统进化分析
经DNAStar软件分析表明, 青虾AST多肽前体由701个氨基酸组成, 经蛋白酶水解可转录并翻译出35个AST多肽, 分析显示这些多肽共30种。使用clustalx软件将青虾30种多肽与克氏螯虾(Procambarus clarkii)、三叶真蟹(Carcinus maenas)、斑节对虾(Penaeus monodon)、大海虾(Panulirus interruptus)、罗氏沼虾(M. rosenbergii)的AST多肽比对, 得到保守的多肽及氨基酸种类(表2)。
使用clustalx和MEGA4.0软件, 选取昆虫纲的果蝇(Drosophila melanogaster) (AF263923.1)、草地夜蛾(Spodoptera frugiperda) (AJ508906.1)、家蚕(Bombyx mori) (AF309090.1)、德国小蠊(Blattella germanica) (AF068061.1)、太平洋折翅蠊(Diploptera punctata) (U00444.1)、长须蜚蠊(Supella longipalpa) (AF068063.1)、埃及伊蚊(Aedes aegypti) (U66841.1)、散白蚁(Reticulitermes flavipes) (FJ668632.1), 以及甲壳纲的大海虾(Panulirus interruptus) (AB245091.1)、克氏螯虾(Procambarus clarkii) (AB106899.1)、罗氏沼虾(Macrobrachium rosenbergii) (DQ088626.1)11个物种的AST氨基酸序列与青虾的AST氨基酸序列进行比对。分析显示, 青虾AST氨基酸序列与罗氏沼虾相似度为100%, 与大海虾、克氏螯虾相似度在95%以上, 与太平洋折翅蠊、长须蜚蠊、埃及伊蚊、散白蚁的相似度为85%—95%(表3)。使用MEGA4.0软件构建NJ系统进化树[27], 计算方法采用Bootstrap法重复计算1000次。进化树中甲壳纲和昆虫纲分为两支, 青虾与罗氏沼虾具有最近的亲缘关系, 与昆虫纲的进化关系相对远一些(图1)。
2.3 青虾AST基因在不同组织内的表达分析
采用荧光定量PCR技术检测AST基因在青虾体内不同组织的表达情况。结果显示, 青虾AST基因在所有被检测组织中均有表达, 由高到低依次为:肝胰脏>肠道>精巢>脑>心脏>卵巢(图2)。在qRTPCR实验中, 每个组织及其参照基因分别做了三个重复, 对得到的三组数值进行T检验P>0.05, 证明实验结果可靠。通过方差分析, AST基因在肝胰脏中的表达量与其他5 种组织相比存在显著差异(**P<0.01),而在其他5种组织中均无显著差异 (P>0.05)。

表2 青虾AST多肽前体的种类、重复次数及相应的氨基酸序列Tab. 2 AST and amino acid sequences of M. nipponense AST peptides, as well as their copy numbers
3 讨论
3.1 青虾AST多肽
青虾AST基因全长cDNA序列共编码701个氨基酸, 经蛋白酶水解能够转录并翻译出35个AST多肽, 其中AST-14重复了4次, AST-27重复3次,共30种。目前许多甲壳动物的AST多肽已被分离鉴定, 克氏螯虾鉴定出29个, 三叶真蟹鉴定出20个, 利莫斯螯虾鉴定出3个, 斑节对虾鉴定出40个,大海虾鉴定出39个, 罗氏沼虾鉴定出35个。作者推测, 重复次数多的AST多肽可能在AST基因的生理功能中起到某种重要作用, 有待进一步研究。

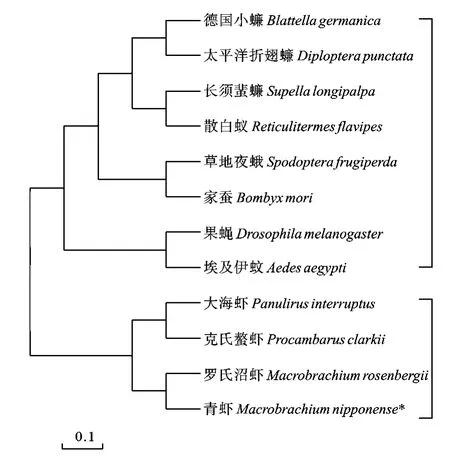
图1 基于青虾及其他甲壳动物和昆虫AST蛋白序列的NJ系统进化树Fig. 1 Neighbor-Joining phylogenetic tree analysis of M. nipponense AST protein with related crusteceans and insectas vertebrate AST proteins

图2 qRT-PCR方法检测AST基因在青虾不同组织内的表达(P>0.05)Fig. 2 Expression of AST mRNA in M. nipponense in different tissues by qRT-PCR (P>0.05)
昆虫AST多肽根据C末端序列不同, 可以分为三种类型[35]: 从蜚蠊中分离纯化出的AST多肽C末端都具有相似的酰胺化的氨基酸序列Y/F-X-F-G-L,称为A型-AST; 从蟋蟀中分离纯化出的AST多肽, C末端都具有另一种酰胺化的氨基酸序列W(X(6)),即B型-AST; 最初由烟草天蛾中分离出的AST多肽, C末端氨基酸未经过酰胺化, 为C型-AST。A型-AST是研究最为广泛的类型, 其Y/F-X-F-G-L序列对于抑制昆虫咽侧体保幼激素的合成是十分必要的[35]。
在本研究中青虾AST多肽的C末端都具有酰胺化的氨基酸序列Y/F-X-F-G-L, 属于典型的A型-AST, 与昆虫中蜚蠊类AST多肽类型特征一致。其他已报道的甲壳类AST多肽也为A型。蛋白质的不同结构决定其多样性的功能。因此作者推测, 甲壳类AST多肽可能具有与蜚蠊类AST多肽相似的某种功能。
AST多肽比对分析得到保守的氨基酸分别为Tyr、Ala、Phe、Gly、Leu 五种。青虾30种AST多肽中, AST-3、8、16、20、24在已知的其他甲壳动物中均未发现, 是青虾所特有的, 其他25种AST多肽与罗氏沼虾共有。其中AST-19, 26为青虾、罗氏沼虾、斑节对虾共同拥有, AST-29为青虾、罗氏沼虾、大海虾共同拥有。青虾特有的AST多肽可能在蜕皮、生殖或者其他生理过程中起到与其他物种不同的作用。
3.2 系统进化
AST氨基酸序列比对和进化树的分支情况显示,青虾与罗氏沼虾的蛋白相似度最高, 此外与克氏螯虾、大海虾也具有较高的蛋白相似度。除了甲壳纲动物之间的AST氨基酸序列比对, 本研究还选取了部分昆虫纲动物与甲壳动物两两比对, 蛋白相似度都在60%以上, 由此推测AST多肽在无脊椎动物的进化上是相对保守的。甲壳动物和昆虫都具有周期性蜕皮、产卵繁殖的特性, 具有高蛋白相似度的AST多肽作为调节这两个重要功能的激素共同存在于甲壳动物和昆虫中, 也说明甲壳动物和昆虫的进化地位相近, 这与分类学上甲壳动物和昆虫同属于节肢动物门的分类结果是一致的。
3.3 组织差异表达
在昆虫中, AST多肽被发现存在于多种组织中。例如检测到在德国小蠊的脑和肠道和太平洋折翅蠊的卵巢中有大量AST多肽的存在[7,36,34]; 在双斑蟋蟀的脑、肠道、卵巢、精巢中均有大量AST多肽的存在[9]。在甲壳动物中, 在罗氏沼虾[37]、利莫斯螯虾[12]、斑节对虾[19]、约拿蟹(Cancer borealis)[22,23]、三叶真蟹[38]的以脑为中心的中枢神经系统中, 都检测到大量AST多肽, 这与AST多肽是由脑神经细胞分泌是密不可分的。此外, 肠道也是AST的主要分布区, 在利莫斯螯虾[12]、约拿蟹[22,23]肠道内分泌细胞中发现的AST多肽具有抑制肠道收缩的频率和幅度的功能[39]。心脏也含有部分AST多肽, 克氏螯虾心包膜中发现的AST多肽, 可以影响心脏收缩的频率[24]。精巢和卵巢含有少量AST多肽, 克氏螯虾性腺AST多肽研究发现AST多肽能促进甲基法尼酯的产生, 起到明显的促进性腺和卵成熟作用[40]。
以上AST多肽在不同组织中的存在情况都是基于免疫化学和神经生理学研究得到的。本研究采用荧光定量PCR技术检测了青虾AST基因在不同组织中的表达情况。青虾AST基因在6种被检测组织中均有表达, 在肝胰脏中表达量最高, 与其他组织表达量均达到极显著差异, 其次在肠道和精巢中也具有较高的表达量, 在脑和心脏中的表达量相对较低,在卵巢的表达量最低, 组织间差异不显著。基因组织分布表达情况可能与基因功能相关联, AST基因在不同组织中具体的作用与功能还有待进一步研究。
本研究采用分段克隆法克隆得到青虾AST基因全长cDNA序列, 并对其结构特征进行了分析和探讨, 采用荧光定量PCR技术检测了该基因在青虾不同组织间的差异表达, 研究结果可为青虾蜕皮及生殖发育相关基因的克隆研究奠定基础。同时为青虾AST基因后续功能的研究提供了参考资料。
[1] Stay B, Woodhead A P, Joshi S. Allatostatins neuropeptide inhibitors of juvenile hormone biosynthesis in brain and corpora allata of the cockroach Diploptera punctata [A]. In: Men J J, Kelly T J, Masler E P (Eds.). Insect Neuropeptdes [C]. ACS Symposium Series 453. Washington DC: American Chemical Society. 1991, 164—176
[2] Duve H, Wren P, Thorpe A. Innervation of the foregut of the cockroach Leucophaea maderae and inhibition of spontaneous contractile activity by allatostatin neuropeptides [J]. Physiologica Entomology, 1995, 20: 33—44
[3] East P, Tregenza K, Duve H, et al. Identification of the dipteran Leuc-allatostatin peptide familiy: characterization of the prohomone gene from Calliphora vomitoria and Lucilia cuprina [J]. Regulatory Peptides, 1996, 67: 1—9
[4] Veelaert D, Devreese B, Schoofs L, et al. Isolation and characterization of eight myoinhibiting peptides from the desert locust Schistocerca gregaria: new members of the cockroach allatostatin family [J]. Molecular and Cell Endocrinology, 1996, 122: 183—190
[5] Martin D, Piulachs M D, Belles X. Allatostatin inhibits vitellogenin release in a cockroach [J]. Annals of the New York Academy of Sciences, 1998, 839: 341—342
[6] Martin D, Piulachs M D, Belles X. Inhibition of vitellogenin production by allatostatin in the German cockroach [J]. Molecular and Cellular Endocrinology, 1996, 121: 191—196
[7] Donly B C, Ding Q, Tobe S S. Molecular cloning of the gene for the allatostatin family of neuropeptides from the cockroach Diploptera punctata [J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90: 807—811
[8] Belles X, Graham L A, Bendena W G, et al. The molecular evolution of the allatostatin precursor in cockroaches [J]. Peptides, 1999, 20: 11—22
[9] Meyering-Vos M, Wu X, Huang J, et al. The allatostatin gene of the cricket Gryllus bimaculatus [J]. Molecular and Cellular Endocrinology, 2001, 184: 103—114
[10] Vanden Broeck J, Veelaert D, Bendena W G, et al. Molecular cloning of the precursor cDNA for Schistostatins locust allatostatin-like peptides with myoinhibiting properties [J]. Molecular and Cellular Endocrinology, 1996, 122: 191—198
[11] Veenstra J A, Noriega F G, Graf R, et al. Identification of three allatostatins and their cDNA from the mosquito Aedes aegypti [J]. Peptides, 1997, 18: 937—942
[12] Dircksen H, Skiebe P, Abel B, et al. Structure, distribution, and biological activity of novel members of the allatostatin familiy in the crayfish Orconectes limosus [J]. Peptides, 1999, 20: 695—712
[13] Abdel-Latief M, Meyering-Vos M, Hoffmann K H. Type-Allatostatin from the fall armyworm Spodoptera frugiperda: molecular cloning, expression and tissue-specific localization [J]. Archives of Insect Biochemistry and Physiology, 2004, 56: 20—32
[14] Davey M, Duve H, Thorpe A, East P. Characterisation of the helicostatin peptide precursor gene from Helicoverpa armigera (Lepidoptera: Noctuidae) [J]. Insect Biochemistry and Molecular Biology, 1999, 29: 1119—1127
[15] Lenz C, Williamson M, Grimmelikhuijzen C J. Molecular cloning and genomic organization of an allatostatin preprohormone from Drosophila melanogaster [J]. Biochemical and Biophysical Research Communications, 2000, 273: 26—31
[16] Secher T, Lenz C, Cazzamali G, et al. Molecular cloning of a functional allatostatin gut/brain receptor and an allatostatin preprohormone from the silkworm Bombyx mori [J]. Biochemical Journal, 2001, 276: 52—60
[17] Belles X, Graham L A, Bendena WG, et al. The molecular evolution of the allatostatin precursor in cockroaches [J]. Peptides, 1999, 20: 11—22
[18] Ding Q, Donly B C, Tobe S S, et al. Comparison of the allatostatin neuropeptide precursors in the distantly related cockroaches Periplaneta americana and Diploptera punctata[J]. European Journal of Biochemistry, 1995, 234: 737—746
[19] Duve H, Johnsen A H, Scott A G, et al. Allatostatins of the tiger prawn Penaeus monodon (Crustacea: Penaeidea) [J]. Peptides, 2002, 23: 1039—1051
[20] Mangerich S, Keller R, Dircksen H. Immunocytochemical identification of structures containing putative red pigmentconcentration hormone in two species of decapod crustaceans [J]. MedSci Entry for Cell and Tissue Research, 1986, 245: 377—386
[21] Mangerich S, Keller R, Dircksen H, et al. Localization of pigment-dispersing hormone (PDH) and coexistence with PMRF-amide immunoreactivity in the eyestalks of two decapod crustaceans [J]. MedSci Entry for Cell and Tissue Research, 1987, 250: 365—375
[22] Skiebe P, Schneider H. Allatostatin peptides in the crab stomatogastric nervous system: inhibition of the pyloric motor pattern and distribution of allatostatin-like immunoreactivity [J]. Experimental Biology and Medicine, 1994, 194: 195—208
[23] Jorge-Rivera J, Marder Y E. Allatostatin decreases stomatogastric neuromuscular transmission in the crab Cancer borealis [J]. Experimental Biology and Medicine, 1997, 200: 37—46
[24] Kwok R, Rui Zhang J, Tobe S S. Regulation of methyl farnesoate production by mandibular organs in the crayfish Procambarus clarkii: a possible role for allatostatins [J]. Journal of Insect Physiology, 2005, 51: 367—378
[25] Peng J X, Yin Q, Cui L. Molecular cloning of litopenaeus vannamei tcp-1-beta gene and analysis on its relationship with cold tolerance [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 604—609 [彭金霞, 殷勤, 崔亮. 凡纳滨对虾TCP-1-Beta 基因的克隆及其与耐寒性状的相关性. 水生生物学报, 2011, 35(4): 604—609]
[26] Liao S, Chen Y, Du F K, et al. Resistance of siGCRV transgenic rare minnow (Gobiocypris rarus) to grass carp reovirus [J]. Acta Hydrobiologica Sinica, 2010, 34(4): 837—842 [廖莎, 陈芸, 杜富宽, 等. 抗草鱼出血病病毒转基因稀有鲫的初步研究. 水生生物学报, 2010, 34(4): 837—842]
[27] Sun Y, Zhang Y C, Liu Y C. Cloning and expression analysis of molt-inhibiting hormone gene (Es-MIH) in eriocheir sinensis [J]. Acta Hydrobiologica Sinica, 2011, 35(2): 210—217 [孙妍, 张亦陈, 刘逸尘. 中华绒螯蟹蜕皮抑制激素基因全长cDNA 克隆和重组表达. 水生生物学报, 2011, 35(2): 210—217]
[28] Duve H, Thorpe A. Distribution and functional significance of Leu-callatostatins in the blowfly Calliphora vomitoria [J]. MedSci Entry for Cell and Tissue Research, 1994, 276(2): 367—379
[29] Lange A B, Chan K K, Stay B. Effect of allatostatin and proctolin on antennal pulsatile organ and hindgut muscle in the cockroach Diploptera punctata [J]. Archives of Insect Biochemistry and Physiology, 1993, 24(2): 87—92
[30] Dircksen H, Skiebe P, Abel B, et al. Structure, distribution, and biological activity of novel members of the allatostatin family in the crayfish Orconectes limosus [J]. Peptides, 1999, 20(6): 695—712
[31] Skiebe P. Allatostatin-like immunoreactivity in the stomatogastric nervous system and the pericardial organs of the crab Cancer pagurus, the lobster Homarus americanus, and the crayfish Cherax destructor and Procambarus clarkii [J]. Journal of Comparative Neurology, 1999, 403(1): 85—105
[32] Stay B, Zhang J R, Tobe S S. Methyl farnesoate and juvenile hormone production in embryos of Diploptera punctata in relation to innervation of corpora allata and their sensitivity to allatostatin [J]. Peptides, 1990, 23: 81—99
[33] Bendena W G, Donly B C, Tobe S S. Allatostatins: a growing family of neuropeptides with structural and functional diversity [J]. Annals of the New York Academy of Science, 1999, 897: 311—329
[34] Garside C S, Koladich P M, Bendena W G, et al. Expression of allatostatin in the oviducts of the cockroach Diploptera punctata [J]. Insect Biochemistry and Molecular Biology, 2002, 32(9): 89—99
[35] Zeng H M, Huang J S. Advances of research on insect neuropeptide allatostatin [J]. Chinese Bulletin of Life Sciences, 2003, 15(3): 168—191 [曾辉明,黄俊生.昆虫神经肽allatostatin的研究进展. 生命科学, 2003, 15(3): 168—191]
[36] Aguilar R, Maestro J L, Vilaplana L, et al. Allatostatin gene expression in brain and midgut, and activity of synthetic allatostatins on feeding-related processes in the cockroach Blattella germanica [J]. Regulatory Peptides, 2003, 115(3): 171—177
[37] Yin G L, Yang J S, Yang W J. Molecular cloning and characterization of FGLamide allatostatin gene from the prawn, Macrobrachium rosenbergii [J]. Peptides, 2006, 27: 1241—1250
[38] Duve H, Johnsen A H, Maestro J L, et al. Isolation and identification of multiple neuropeptides of the allatostatin superfamily in the shore crab Carcinus maenas [J]. European Journal of Biochemistry, 1997, 250(3): 727—734
[39] Francisco Martinez-Perez, Belunda S W Chang, Stephen S Tobe. FGLamide Allatotatin genes in Arhtropoda: Introns early or late? [J]. Peptides, 2009, 30: 1241—1248
[40] Laufer H, Borst D, Baker F C, et al. Identification of a juvenile hormone-like compound in a crustacean [J]. Science, 1987, 235: 202—205
CLONING, CHARACTERIZATION AND EXPRESSION OF FULL LENGTH cDNA ENCODING ALLATOSTATIN (AST) IN MACROBRACHIUM NIPPONENSE
BU Xian-Fei1, LI Zhen-Zhen2, QIAO Hui2, FU Hong-Tuo1,2, WU Yan2, GONG Yong-Sheng2, JIANG Su-Fei2and XIONG Yi-Wei2
(1. Wuxi Fishery College Nanjing Agricultural University, Wuxi 214081, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China)
Allatostatin (AST) is a type of neuropeptide, it is made up of a few to dozens of amino acid. In crustaceans, AST has a significant stimulatory effect on MF synthesis, which involved in moulting and reproduction, so it is suggesting that AST in crustaceans has a positive effect on moulting and reproduction. However, AST gene cloning and expression of crustaceans is rarely reported. To investigate gene cloning and expression of AST cDNA in Macrobrachium nipponense, we cloned AST gene in M. nipponense and used quantitative real-time PCR (qRT-PCR) to detecting the expression of AST gene in various tissues. The cloned AST cDNA was 2995 bp in length containing a 242 bp 5′untranslated region (UTR), a 647 bp 3′ UTR and a 2106 bp open reading flame (ORF). The ORF encoded a AST precursor polypeptide 701 amino acid residues, which can be hydrolyzed into 35 allatostatins at dibasic cleavage sites. These 35 allatostatins had a C-terminal Y/FXFGL-amide in common, which is the characteristics of A type-AST. On the basis the comparison of the amino acid sequences, five amino acids including Tyr, Ala, Phe, Gly and Leu were considered as conserved amino acids during evolution. According to the phylogenetic tree, the insects and crustaceans were divided into two branches through the comparison between different insect and crustaceans. M. nipponense had a closest relationship with M. rosenbergii. The result of qRT-PCR revealed that AST gene was expressed in all the tested tissues. The tissue’ expression levels of AST were in the decreasing order hepatopancreas, intestines, testis, brain, heart, and ovary. Our research on AST gene clone and expression contributes to further researching of the function of AST in M. nipponense.
Macrobrachium nipponense; Allatostatin (AST); Gene clone; Gene expression
Q78
A
1000-3207(2013)01-0116-09
10.7541/2013.116
2011-09-14;
2012-08-17
国家十二五科技支撑计划(2012BAD26B04; 2012BAD25B07); 中央级基本科研业务费专项(2011JBFA02); 农业部农业科技跨越计划(2007年度)资助
卜宪飞(1987—), 女, 吉林人; 硕士; 主要从事水产动物遗传育种研究。E-mail: buxianfei2005@126.com
傅洪拓(1964—), 男, 湖南长沙人; 研究员, 博士生导师; 研究方向为水产动物遗传育种。Tel:0510-85558835; E-mail: fuht@ffrc.cn
