三疣梭子蟹蜕皮周期中MIH基因mRNA水平与蜕皮激素浓度变化
2013-04-19汪春建朱冬发亓一舟胡则辉
汪春建 朱冬发 亓一舟 胡则辉 谢 熙 沈 洁
(宁波大学应用海洋生物技术教育部重点实验室, 宁波 315211)
三疣梭子蟹蜕皮周期中MIH基因mRNA水平与蜕皮激素浓度变化
汪春建 朱冬发 亓一舟 胡则辉 谢 熙 沈 洁
(宁波大学应用海洋生物技术教育部重点实验室, 宁波 315211)
甲壳动物的蜕皮过程被认为是由位于眼柄的X器-窦腺复合体(XO-SG)分泌蜕皮抑制激素(MIH)通过调节Y器(YO)合成蜕皮激素而调控的。通过实时荧光定量PCR(qRT-PCR)发现MIH基因在三疣梭子蟹眼柄X器-窦腺复合体中表达最强。采用qRT-PCR分析了MIH基因在三疣梭子蟹蜕皮周期中的表达变化, 结果表明; A期为(0.42±0.08)倍, B期为(1.09±0.09)倍, C期为(1.35±0.16)倍, D0亚期为(1.00±0.10)倍, D1亚期(0.78±0.07)倍, D2亚期为(0.27±0.08)倍, D3/4亚期为(0.20±0.04)倍。采用高效液相色谱-电喷雾串联质谱(LC-MS/MS)法完成了三疣梭子蟹蜕皮周期中蜕皮激素(20E)浓度变化的测定。A/B期蜕皮激素的浓度较低,低于仪器检测限0.33 pg, C期为(1.666±0.762) ng/mL, D0亚期为(4.047±1.5133) ng/mL, D1亚期为(6.756±4.928) ng/mL, D2亚期为(8.609±3.827) ng/mL, D3亚期为(19.534±4.799) ng/mL, D4亚期为11.616 ng/mL。在三疣梭子蟹蜕皮周期中, MIH基因表达量与血淋巴中蜕皮激素浓度呈现一定拮抗性, 揭示MIH抑制Y器合成蜕皮激素而调控着三疣梭子蟹蜕皮的发生和进行。
三疣梭子蟹; 蜕皮周期; 蜕皮抑制激素; 实时荧光定量PCR; 高效液相色谱-电喷雾串联质谱
蜕皮是甲壳动物蜕去旧的外骨骼并长出新的外骨骼的过程, 是甲壳动物生长和发育的标志特征,它贯穿甲壳动物个体发育的始终, 受神经系统和内分泌系统共同调节[1]。甲壳动物的蜕皮被认为是由位于眼柄的X器-窦腺复合体(X-organ–sinus gland, XO-SG)分泌的MIH (Molt-inhibiting hormone, MIH)通过调节Y-器(Y-organ, YO)蜕皮激素的合成而调控的[2—4]。MIH是在甲壳动物眼柄中的X-器(X-organ, XO)中合成, 并在神经血器官即窦腺(Sinus gland, SG)中储存和释放[5]。一般认为在切除甲壳类动物眼柄后能有效促进蜕壳和性腺的早期发育; 对切除眼柄的动物重新注入眼柄分泌物或合成的MIH后, 血淋巴蜕皮激素浓度就会降低, 同时蜕皮也会推迟; 只有当MIH的分泌量减少或停止时蜕皮才会发生[6,7]。故普遍接受甲壳动物MIH抑制Y器合成蜕皮激素的蜕皮调控理论模式[8,9]。可口美青蟹(Calilnectes sapidus)和凡纳滨对虾(Litopenaeus vanname)蜕皮周期中MIH表达量与血淋巴中蜕皮激素浓度呈现一定拮抗性[10,11], 符合MIH抑制Y器合成蜕皮激素的蜕皮调控理论模式[8,9]。但是, 有研究报道克氏原螯虾(Procambarus clarkii)和三叶真蟹(Carcinus maenas)在蜕皮周期中MIH表达量和血淋巴中蜕皮激素浓度不完全拮抗, 与普遍接受的蜕皮调控理论相违背[12,13]。由此可知, 甲壳动物蜕皮调控理论的完善需要更广泛更深入的研究[14]。
三疣梭子蟹(Portunus trituberculatus)是我国重要经济蟹类之一。人工养殖的三疣梭子蟹与中华绒螯蟹(Eriocheir sinensis)一样, 存在性早熟和蜕皮未遂等问题[15]。这些问题的解决有赖于甲壳类动物蜕皮调控机制的阐明[16]。在克隆获得了三疣梭子蟹MIH基因全长cDNA序列[17]和采用形态观察法对三疣梭子蟹蜕皮周期进行细致分期[18]的基础上, 我们进一步采用实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)技术分析了三疣梭子蟹蜕皮周期中MIH基因mRNA水平变化; 采用高效液相色谱-电喷雾串联质谱(High performance liquid chromatography-e1ectrospray ionization tandem mass spectrometry, LC-MS/MS)法测定了三疣梭子蟹蜕皮周期中蜕皮激素(20-羟基蜕皮酮)(20-hydroxyecdysone, 20E)浓度变化, 为深入探讨三疣梭子蟹蜕皮调控机制和在生产上控制三疣梭子蟹蜕皮和生长奠定基础。
1 材料与方法
1.1 材料与预处理
选取头胸甲宽(CW)为8—12 cm、体重(BW)为45—80 g的野生三疣梭子蟹, 暂养于宁波市宁海县得水育苗场。采用形态观察法将三疣梭子蟹蜕皮周期划分为蜕皮后期(A期和B期), 蜕皮间期(C期),蜕皮前期(D0、D1、D2、D3和D4亚期)和蜕皮期(E期)四个阶段[18]。采集C期三疣梭子蟹眼柄X器-窦腺复合体、胸神经节、精巢、卵巢、肠、脑、Y器和肝胰腺用于组织表达差异分析。采集A期、B期、C期、D0亚期、D1亚期、D2亚期和D3/4亚期三疣梭子蟹眼柄X器-窦腺复合体(液氮保存)用于蜕皮周期中MIH基因表达水平变化测定。采集A期、B期、C期、D0亚期、D1亚期、D2亚期、D3亚期和D4亚期各300 μL血淋巴。预处理过程包括: 在采集的300 μL血淋巴加入1200 μL乙腈和20 μL 100 ng/mL高油菜素内酯, 轻微涡旋震荡; 8500 r/min, 离心15min;吸取上清液1 mL至另外1.5 mL离心管中; −20℃保存, 用于蜕皮激素浓度测定。
1.2 主要试剂
DEPC, Trizol购自Sangon公司(上海); DNase I(RNase Free), PrimeScript RT reagent Kit, SYBR Premix Ex Taq II试剂盒均购自Takara公司(日本); 20-羟基蜕皮酮和高油菜素内酯标准品(纯度>98%),乙酸(色谱纯)购自SIGMA-ALDRICH公司(美国);乙腈(色谱纯)购自TEDIA公司(美国); 引物合成及测序均由上海英骏生物技术有限公司(Invitrogen)完成。
1.3 方法
总RNA提取 按Trizol试剂说明书提取各个样品中的Total RNA, 经1%琼脂糖凝胶电泳检测完整性, 紫外分光光度计进行纯度分析。提取Total RNA后, 再使用DNase I分解混入的基因组DNA,最后进行苯酚/氯仿抽提、乙醇沉淀等纯化Total RNA。
第一链cDNA合成 每个Total RNA样品取1.0 μg, 5×PrimeScript Buffer 2 μL, PrimeScript RT Enzyme Mix I 0.5 μL, Oligo (dT) Primer (50 μmol/L) 0.5 μL, Random 6 mers (100 μmol/L) 0.5 μL, 最后用RNase Free dH2O补足10 μL。引物序列及具体操作参照PrimeScript RT reagent Kit说明书。
qRT-PCR qRT-PCR在Mastercycler ep realplex real-time PCR (Eppendorf)上完成, 25 μL定量PCR反应体系包括; SYBR Premix Ex Taq II (2×)缓冲液 12.5 μL, 正向和反向引物(10 μmol/L)各0.5 μL(表1), cDNA模板 1 μL, dH2O 10.5 μL。程序采用三步法; 先95℃ 30s (1 cycle); 随后进行40个循环,每一循环包括95℃ 15s, 55℃ 30s, 68℃ 30s, 收集荧光信号; 40个循环结束后对扩增产物进行熔解曲线分析, 确保特异性扩增, 95℃ 30 s, 55℃ 30s, 95℃15s(1 cycle), 55—95℃, +0.5℃/cycle, 收集荧光信号。
18S rRNA 将三疣梭子蟹不同组织和蜕皮周期中的cDNA样本按照上述反应体系和反应条件扩增, 测定各个样品的内参基因18S rRNA Ct值。在http://medgen.ugent.be/ ~jvdesomp/genorm/网站下载geNorm程序, 并对18S rRNA内参基因的表达稳定性进行统计学分析, 计算出基因表达稳定性的平均值M和配对变异度V, 通常建议M<1.5, V<0.15为选择阈值, 认为内参基因表达稳定性较好[19,20]。同时进一步采用2−ΔCt[ΔCt=(Cttimex−Cttime0)]法[21,22]分析内参基因18S rRNA表达水平。
相对定量 采用根据Livak, et al[22]提出的相对标准曲线法2−∆∆Ct[ΔΔCt=(Ct目的基因−Ct管家基因)实验组−(Ct目的基因−Ct管家基因)]对照组, 18S rRNA做内参基因;三次生物学重复, 每个生物学重复分析三次]对相对定量的结果进行分析, 获得三疣梭子蟹蜕皮不同组织与周期中MIH基因mRNA的相对表达量。
蜕皮激素浓度测定 血淋巴中蜕皮激素浓度测定在TSQ Quantum Access液相色谱一三重四极杆质谱联用仪(Thermo Finnigan)上完成, 具体操作参照赵鹏等[23]报道高效液相色谱-三重四级杆质谱分析海洋甲壳动物淋巴和肌肉中的20-羟基蜕皮酮(20E)。
数据分析 试验结果表示为平均值±标准差(Mean±SD)。显著性差异用SPSS软件(13.0)中的单因素(One-wayANOVA)方差进行分析, 以P < 0.05为显著性差异, P < 0.01为极显著性差异。
表1 内参基因与目的基因的引物序列Tab. 1 Primer sequences for internal control genes and targeted genes
2 结果
2.1 18S rRNA基因表达稳定性的检测
通过实时荧光定量PCR研究了三疣梭子蟹8个不同组织: 眼柄X器-窦腺复合体、胸神经节、精巢、卵巢、肠、脑、Y器和肝胰腺; 7个蜕皮阶段; A期、B期、C期、D0亚期、D1亚期、D2亚期和D3/4亚期眼柄X器-窦腺复合体中的18S rRNA表达水平。本文测得18S rRNA基因在8个不同组织中的M值为0.762, V值为0.082; 在7个蜕皮阶段中的M值为0.437, V值为0.049, 因此18S rRNA基因在本实验条件下表达水平稳定性较好。以眼柄X器-窦腺复合体为对照组(Cttime0), 采用2−ΔCt法计算另外各个组织(Cttimex)中的18S rRNA相对表达量(图1)。
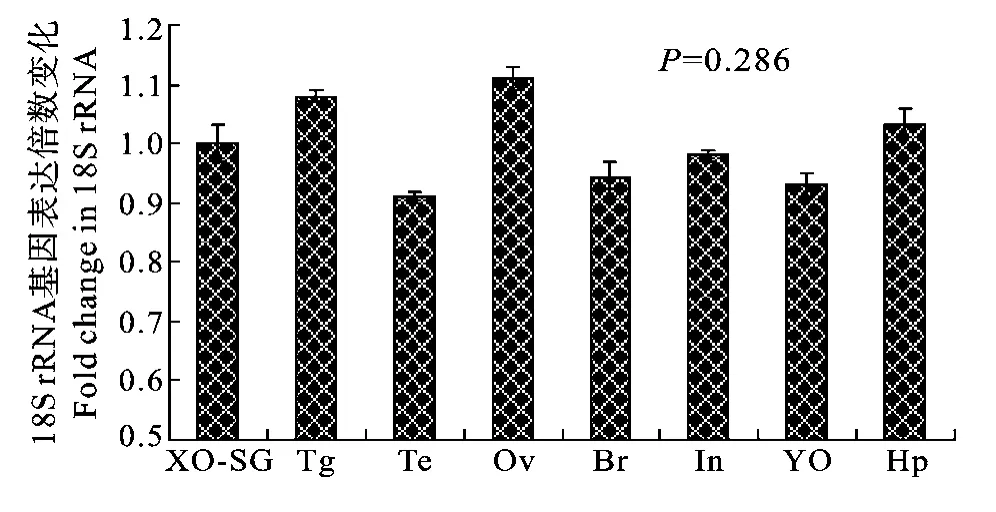
图1 三疣梭子蟹8个不同组织中18S rRNA的表达水平(P>0.05)Fig. 1 Expression levels of 18S rRNA in eight different tissues of P. trituberculatus. The differences were considered as not significant (P>0.05)
同样以D0亚期为对照组, 采用2−ΔCt法计算另外各个蜕皮阶段中的18S rRNA相对表达量(图2)。实验结果表明, 三疣梭子蟹8个不同组织和7个蜕皮阶段中的18S rRNA表达水平无显著差异(P>0.05)。
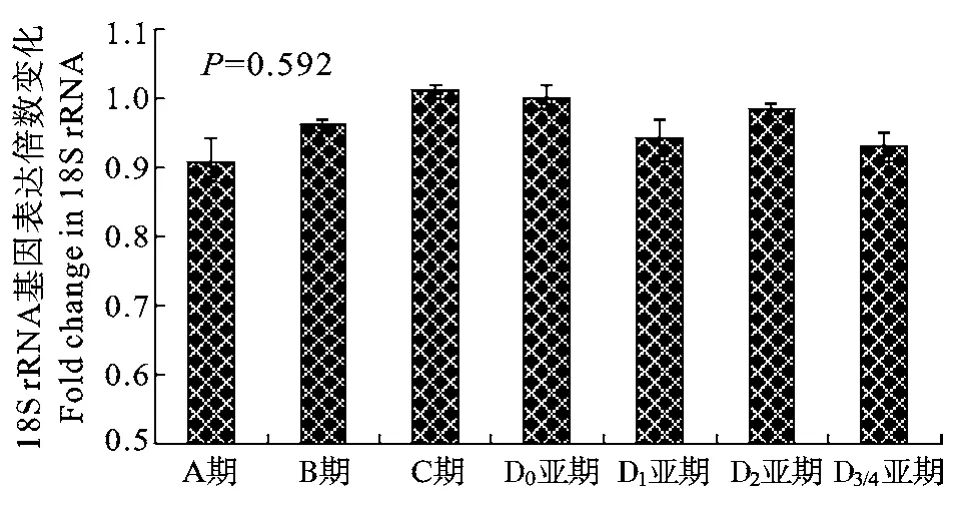
图2 三疣梭子蟹7个蜕皮阶段中18S rRNA的表达水平(P>0.05)Fig. 2 Expression levels of 18S rRNA in seven molting stages of P. trituberculatus. Differences were considered as not significant (P>0.05)
2.2 MIH基因组织表达的相对定量
以18S rRNA做内参基因, 对MIH基因在眼柄X器-窦腺复合体、胸神经节、精巢、卵巢、肠、脑、Y器、肝胰腺等8个组织中的表达差异进行了qRTPCR分析。以眼柄X器-窦腺复合体为对照组, 采用2−ΔΔCt方法计算另外各个组织中的MIH mRNA相对表达量, 结果显示: 眼柄X器-窦腺复合体为(1±0.09)倍;胸神经节为(0.072±0.011)倍; 精巢为(0.012±0.0023)倍; 卵巢为(0.0018±0.00075)倍; 脑为(0.0026±0.00098)倍; 肠为(0.0034±0.00033)倍; Y器为(0.00023± 0.000083)倍; 肝胰腺为(0.00018±0.000023)倍(图3)。
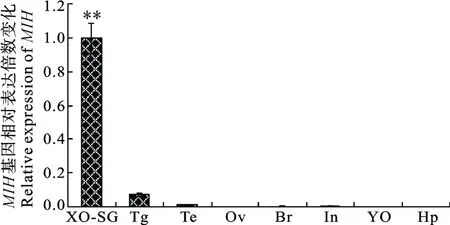
图3 三疣梭子蟹各个组织MIH基因mRNA相对表达量[ “**”为极显著性差异(P < 0.01)]Fig. 3 Relative quantitative expression of MIH mRNA in various tissues from P. trituberculatus [Values with “**” indicate significant differences (P < 0.01)]
由此可见MIH基因在三疣梭子蟹眼柄X器-窦腺复合体中表达最强, 且与其余组织相比差异性极显著(P < 0.01), 胸神经节表达次之, 其他组织表达量均极低。
2.3 蜕皮周期中MIH基因 mRNA水平
由于MIH基因在三疣梭子蟹眼柄X器-窦腺复合体中表达最强, 故以蜕皮周期中各个时期的眼柄X器-窦腺复合体为材料进行qRT-PCR分析。用18S rRNA做内参基因, 以D0亚期为对照, 采用2−ΔΔCt方法计算其他各期MIH基因mRNA相对表达量, 结果显示: A期为(0.42±0.08)倍; B期为(1.09±0.09)倍; C期为(1.35±0.16)倍; D0亚期为(1.00±0.10)倍; D1亚期(0.78±0.07)倍; D2亚期为(0.27±0.08)倍; D3/4亚期为(0.20±0.04)倍(图4)。MIH表达量最高的C期与最低的D3/4亚期相差将近7倍。LSD检验法分析显示,除D2亚期与D3/4亚期间差异不显著外, 蜕皮周期中各个时期的MIH基因表达量间均有显著性差异(P<0.05)。在三疣梭子蟹整个蜕皮周期中, MIH基因表达水平呈一个明显的变化规律: MIH表达量从A期开始上升, 到C期达到顶峰, 然后逐渐下降, 至下一次蜕皮前D3/4亚期达到最低, 完成一个蜕皮周期。
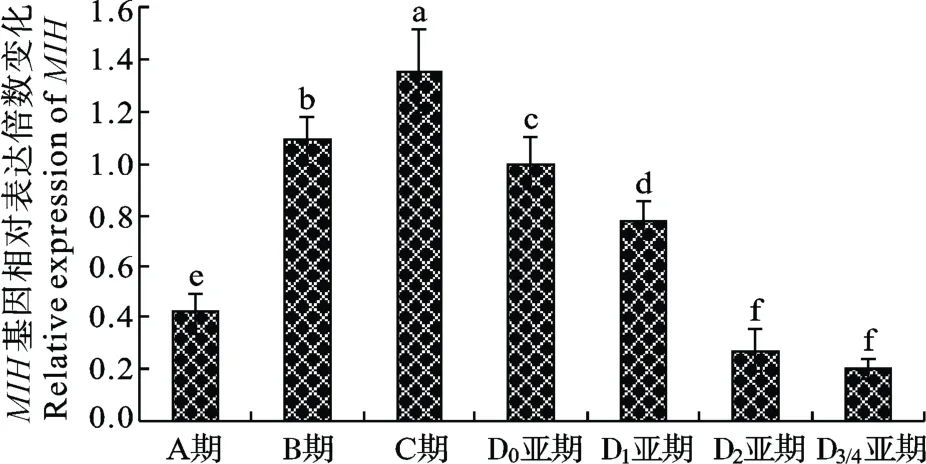
图4 三疣梭子蟹蜕皮周期中MIH基因表达水平变化的qRTPCR分析Fig. 4 qRT-PCR analysis of MIH mRNA levels during the molt cycle of P. trituberculatus and data were analyzed by LSD
2.4 蜕皮周期中蜕皮激素浓度变化
采用LC-MS/MS法完成三疣梭子蟹蜕皮周期中血淋巴蜕皮激素(20E)浓度变化的测定。随着蜕皮周期的运行, 血淋巴蜕皮激素浓度基本处于逐渐升高的趋势, A/B期蜕皮激素的浓度低于仪器检测限0.33 pg。C期蜕皮激素的浓度为(1.666±0.762) ng/mL。进入蜕皮前期蜕皮激素浓度逐渐上升, D0、D1、D2亚期其浓度分别为(4.047±1.5133)、(6.756±4.928)和(8.609±3.827) ng/mL; 在D3亚期达到最高峰(19.534 ± 4.799) ng/mL, D4亚期回落为11.616 ng/mL (图5)。
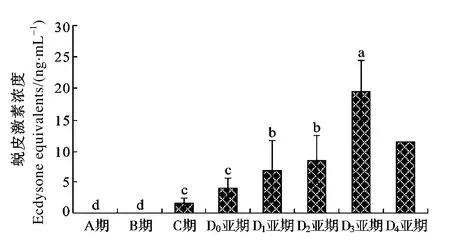
图5 LC-MS/MS法测定三疣梭子蟹蜕皮周期中蜕皮激素(20E)浓度变化Fig. 5 Ecdysteroids (20E) in the hemolymph of individual crabs were quantified by LC-MS/MS, and data were analyzed by LSD
3 讨论
本文分析了MIH基因在三疣梭子蟹8个不同组织中的表达情况, 结果显示, MIH基因在眼柄X器-窦腺复合体中表达量最高, 远高于其他组织; 其次是胸神经节, 再次是精巢, 其余组织中MIH表达量均极低 (图3)。这表明MIH基因在三疣梭子蟹眼柄X器-窦腺复合体中表达最强, 实验数据支持眼柄X器-窦腺复合体分泌MIH抑制Y器合成蜕皮激素的调控观点[8,9], 为进一步精确分析三疣梭子蟹蜕皮周期中MIH基因表达水平变化打下了良好的基础。邱高峰等[24]采用RNA点杂交检测锯缘青蟹(Scylla serrata) MIH在不同组织中的表达, 发现MIH仅在眼柄X器-窦腺复合体和脑中表达; Chen, et al.[11]采用半定量方法分析凡纳滨对虾(L. vanname)2种MIH (Liv-MIH1和Liv-MIH2)的组织表达情况, 发现MIH仅在眼柄X器-窦腺复合体中表达; 孙妍等[25]采用半定量RT-PCR和Northen blot分析了中华绒螯蟹(E. sinensis) MIH在不同组织中的表达, 也发现MIH仅在眼柄X器-窦腺复合体中表达。比较而言, qRT-PCR为检测低丰度mRNA提供更便利和科学的方法[19—22],具有准确、灵敏、简便等优点。这可能是我们能检测到眼柄X器-窦腺复合体MIH基因高表达以外,也检测到其余组织中MIH基因表达的原因。
本文发现在三疣梭子蟹蜕皮周期中MIH表达水平呈一个明显的规律: MIH表达量从蜕皮后期(A期)开始上升, 到蜕皮间期(C期)达到顶峰, 然后逐渐下降, 至下一个蜕皮前期(D3/4亚期)达到最低, 启动新的蜕皮过程(图4)。同时分析了三疣梭子蟹蜕皮周期中血淋巴蜕皮激素(20E)浓度变化趋势: 蜕皮后期(A期和B期)均检测不到蜕皮激素, 蜕皮间期(C期)开始上升, 到蜕皮前期(D3亚期)期达到顶峰, 蜕皮前期(D4亚期)出现回落(图5)。三疣梭子蟹蜕皮周期中MIH表达水平变化趋势与血淋巴中蜕皮激素浓度变化趋势呈现一定拮抗性, 这与已报道的文献相吻合[10,11]。这表明三疣梭子蟹蜕皮调控模式与甲壳动物中普遍接受MIH抑制Y器合成蜕皮激素的蜕皮调控观点基本一致[8,9], 眼柄X器-窦腺复合体分泌MIH抑制Y器合成蜕皮激素调控着三疣梭子蟹蜕皮发生和进行。
蜕皮后期(A期)至蜕皮间期(C期)三疣梭子蟹眼柄X器-窦腺复合体MIH表达量呈显著上升趋势(图4); 而蜕皮后期(A期和B期)血淋巴中蜕皮激素(20E)浓度低于仪器检测限, 进入蜕皮间期(C期), 蜕皮激素的浓度显著上升。Lee, et al.[10]报道可口美青蟹(C. sapidus)眼柄X器-窦腺复合体MIH表达量在蜕皮后期(A/B期)至蜕皮间期(C期)一直处于高水平, 检测到血淋巴中蜕皮激素浓度一直处于低水平。这可能源于种间差异, 更可能由于我们将蜕皮后期细分为A期和B期并分别采样, 而后者把A期和B期合成A/B期进行采样所造成的。A期MIH表达量不到B期一半, 我们推测蜕皮后期(A期, 即软壳期)为眼柄X器-窦腺复合体合成, 分泌MIH活动处于调整的恢复期。血淋巴中蜕皮激素浓度的差异, 我们推测蜕皮后期(A期, 即软壳期; B期, 即薄壳期) 蟹体含水量较高[18]导致检测不到蜕皮激素; 蜕皮间期(C期,即硬壳期)蟹体含水量下降, 身体各个部位甲壳的全部硬化[18], 故能检测到蜕皮激素。
蜕皮前期三疣梭子蟹眼柄X器-窦腺复合体MIH基因表达量呈逐渐下降的趋势 (图4); 血淋巴中蜕皮激素浓度则呈逐渐上升趋势, 仅蜕皮前期(D4亚期)出现下调(图5), 二者表现较强的拮抗作用。这一结果与Lee, et al.[10]研究报道一致, 他们也发现可口美青蟹(C. sapidus) 蜕皮激素浓度在蜕皮前期(D4亚期)出现下调, 而不符合拮抗理论, 并推测可能原因: (1) 蜕皮过程主要是由血淋巴中MIH神经肽与蜕皮激素相互调节而调控的, 而血淋巴中MIH神经肽浓度滞后眼柄X器-窦腺复合体MIH表达水平, MIH表达水平可能不能精确反映血淋巴MIH神经肽浓度。(2) MIH并不是唯一的调控因子。目前已报道的参与蜕皮调控相关因子包括CHH、MOIH、cAMP、cGMP、FaMeT和Ca2+等, 这些调控相关因子都可能直接或间接调控Y器合成蜕皮激素[13,26—29]。
在整个蜕皮周期中三疣梭子蟹MIH基因表达量和血淋巴中蜕皮激素浓度呈现一个起伏波动的变化规律并具有一定拮抗性, 这与已报道的文献相一致[10,11]。但是, Ohira, et al.[30]分析了日本囊对虾(Marsupenaeus japonicus)蜕皮周期中眼柄X器-窦腺复合体MIH表达水平变化, 发现在整个蜕皮周期中MIH表达水平无显著变化, 并提出MIH的合成以及分泌属于转录后调控机制这一假设; Chung, et al.[13]报道了三叶真蟹(C. maenas) 蜕皮周期中眼柄X器-窦腺复合体MIH和CHH表达水平变化, 发现MIH表达量在蜕皮间期(C4)和蜕皮蜕皮前期(D2)也无显著变化, 认为CHH也参与蜕皮调控; Nakatsuji, et al.[12]在研究克氏螯虾(P. clarkii) MIH表达水平时发现MIH表达量在蜕皮前期的中期和后期都增加了,且Y器蜕皮激素合成也同样增加了, 分析认为蜕皮前期的中期和后期Y器对MIH的应答迟钝, 故蜕皮的发生不仅仅是由MIH表达水平调控的, 且与Y器对MIH的应答有关。根据我们得出的实验数据和文献报道[10—13,30], 我们推测虾蟹类蜕皮周期中MIH表达水平变化与蜕皮激素浓度变化趋势是否具有起伏波动性且呈现一定拮抗性作用可能不完全一致。我们认为种间差异是一方面原因, 不是所有的虾蟹类蜕皮调控理论都符合普遍接受的甲壳动物蜕皮理论是另一方面原因。本研究为更广泛和更深入地研究甲壳动物蜕皮调控机制提供基础资料, 为研究人工养殖三疣梭子蟹过程中, 解决性早熟和蜕皮未遂等问题提供了准确的数据基础。
[1] Buchholz F, Buchholz C. Growth and Moulting in Northern Krill (Meganyctiphanes norvegica Sars) [M]. Advances in Marine Biology-Biology of Northern Krill-57, the Netherlands: Elsevier. 2010, 173—197
[2] De Kleijn DP, Van Herp F. Molecular biology of neurohormone precursors in the eyestalk of crustacean [J]. Compara-tive Biochemistry and Physiology. Part B, Biochemistry & Molecular, 1995, 112(4): 573—579
[3] Zhu X M, Li S J. Regulation of molting in crustacean larvae [J]. Journal of Fisheries of China, 2001, 25(4): 379—384 [朱小明, 李少菁. 甲壳动物幼体蜕皮的调控. 水产学报, 2001, 25(4): 379—384]
[4] Lachaise F, Roux A L, Huber M, et al. The molting gland of crustaceans: localization, activity, and endocrine control (a review) [J]. Journal of Crustacean Biology, 1993, 13(2): 198—234
[5] Asazuma H, Nagata S, Katayama H, et al. Characterization of a molt-inhibiting hormone (MIH) receptor in the Y-organ of the kuruma prawn, Marsupenaeus japonicus [J]. Annals of the New York Academy of Sciences, 2005, 1040(1): 215—218
[6] Gu Z M, He L G. Effect of unilateral eyestalk enncleation on ecdysis, growth and maturation of mitten crab (Erlocheir sinensis) [J]. Freshwater Fisheries, 1991, 5(1): 10—13 [顾志敏, 何林岗. 切除单侧眼柄对中华绒螯蟹蜕壳、生长、成熟的影响. 淡水渔业, 1991, 5(1): 10—13]
[7] Lee K J, Kim H W, Gomez A M, et al. Molt-inhibiting hormone from the tropical land crab, Gecarcinus lateralis: cloning, tissue expression and expression of biologically active recombinant peptide in yeast [J]. General and Comparative Endocrinology, 2007, 150(3): 505—513
[8] Watson R D, Spaziani E, Bollenbacher W E. Regulation of Ecdysone Biosynthesis in Insects and Crustaceans: a Comparison. In Ecdysone. From Chemistry to Mode of Action [M]. Georg Thieme Verlag: Stuttgart. 1989, 188—203
[9] Baldaia L, Porcheron P, Coimbra J, et al. Ecdysteroids in the shrimp Palaemon serratus: relations with molt cycle [J]. General and Comparative Eendocrinology, 1984, 55(3): 437—443
[10] Lee K J, Watson R D, Roer R D. Molt-inhibiting hormone mRNA Levels and ecdysteroid titer during a molt cycle of the blue crab, Callinectes sapidus [J]. Biochemical and Biophysical Research Communication, 1998, 249(3): 624—627
[11] Chen H Y, Watson R D, Chen J C, et al. Molecular characterization and gene expression pattern of two putative molt-inhibiting hormones from Litopenaeus vannamei [J]. General and Comparative Endocrinology, 2007, 151(1): 72—81
[12] Nakatsuji T, Sonobe H. Regulation of ecdysteroid secretion from the Y-organ by molt-inhibiting hormone in the American crayfish, Procambarus clarkiip [J]. General and Comparative Endocrinology, 2004, 135(3): 358—364
[13] Chung J S, Webster S G. Moult cycle-related changes in biological activity of moult-inhibiting hormone (MIH) and crustacean hyperglycaemic hormone (CHH) in the crab, Carcinus maenas from target to transcript [J]. European Journal of Biochemistry, 2003, 270(15): 3280—3288
[14] Nakatsuji T, Lee C Y, Watson R D. Crustacean molt-inhibiting hormone: Structure, function, and cellular mode of action [J]. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2009, 152(2): 139—148
[15] Li X, Li Z, Liu J, et al. Advances in precocity research of the mitten crab Eriocheir sinensis [J]. Journal of the European Aquaculture Society, 2010, 19(2): 251—267
[16] Chang E S. The Crustacean Endocrine System and Pleiotropic Chemical Messengers [M]. Chemical Communication in Crustaceans, Germany: Springer. 2011, 413—430
[17] Zhu D F, Shen J M, Yang J F, et al. Molecular cloning and sequence analysis of cDNA encoding molt-inhibiting hormone from Portunus trituberculatus [J]. Acta Zoologica Sinica, 2008, 54(6): 1112—1118 [朱冬发, 沈建明, 杨济芬,等. 三疣梭子蟹蜕皮抑制激素cDNA的克隆与序列分析.动物学报, 2008, 54(6): 1112—1118]
[18] Shen J, Zhu D F, Hu Z H, et al. Molt staging in the swimming crab Portunus trituberculatus [J]. Journal of Fisheries of China, 2011, 35(10): 1481—1487 [沈洁, 朱冬发, 胡则辉, 等. 三疣梭子蟹蜕皮周期的分期. 水产学报, 2011, 35(10): 1481—1487]
[19] Kidd M, Nadler B, Mane S, et al. GeneChip, geNorm, and gastrointestinal tumors: novel reference genes for real-time PCR [J]. Physiological Genomics, 2007, 30(3): 363—370
[20] Vandesompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J]. Genome Biology, 2002, 3(7): 34
[21] Schmittgen T D, Zakrajsek B A. Effect of experimental treatment on housekeeping gene expression: validation by real-time quantitative RT-PCR [J]. Journal of Biochemical and Biophysical Methods, 2000, 46(1): 69—81
[22] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402—408
[23] Zhao P, Xu J L D, Qi Y Z, et al. Determination of 20-Hydoroxyecdyson in several marine crustaceans by Liquid chromatography-Mass spectrometry [J]. Chinese Journal Analytical Chemistry, 2011, 39(1): 57—61 [赵鹏, 徐继林,亓一舟, 等. 高效液相色谱-三重四级杆质谱分析海洋甲壳动物淋巴和肌肉中的20-羟基蜕皮酮. 分析化学, 2011, 39(1): 57—61]
[24] Qiu G F, Zhang A P, Lou Y D. cDNA cloning and expression analysis of molt-inhibiting hormone in the mud crab Scylla serrata [J]. Journal of Fisheries of China, 2003, 27(3): 207—212 [邱高峰, 张爱萍, 楼允东. 锯缘青蟹蜕皮抑制激素cDNA的分子克隆及其表达分析. 水产学报, 2003, 27(3): 207—212]
[25] Sun Y, Zhang Y C, Liu Y C, et al. Cloning and expression analysis of molt-inhibiting hormone gene (Es-MIH) in Eriocheir sinensis [J]. Acta Hydrobiologica Sinica, 2011, 35(2):210—217 [孙妍, 张亦陈, 刘逸尘, 等. 中华绒螯蟹蜕皮抑制激素基因全长cDNA克隆和重组表达. 水生生物学报, 2011, 35(2): 210—217]
[26] Covi J A, Chang E S, Mykles D L. Conserved role of cyclic nucleotides in the regulation of ecdysteroidogenesis by the crustacean molting gland [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 152(4): 470—477
[27] Asazuma H, Nagata S, Nagasawa H. Inhibitory effect of molt-inhibiting hormone on phantom expression in the Y-organ of the kuruma prawn, Marsupenaeus japonicus [J]. Archives of Insect Biochemistry and Physiology, 2009, 72(4): 220—233
[28] Kuballa A V, Holton T A, Paterson B, et al. Moult cycle specific differential gene expression profiling of the crab Portunus pelagicus [J]. BMC Genomics, 2011, 12(1): 147—166
[29] Sainath S B, Reddy P S. Evidence for the involvement of selected biogenic amines (serotonin and melatonin) in the regulation of molting of the edible crab, Oziotelphusa senex senex Fabricius [J]. Aquaculture, 2010, 302(3—4): 261—264
[30] Ohira T, Watanabe T, Nagasawa H, et al. Molecular cloning of a molt-inhibiting hormone cDNA from the kuruma prawn Penaeus japonicus [J]. Zoological Science, 1997, 14(5): 785—789
MOLT-INHIBITING HORMONE LEVELS AND ECDYSTEROID TITER DURING A MOLT CYCLE OF PORTUNUS TRITUBERCULATUS
WANG Chun-Jian, ZHU Dong-Fa, QI Yi-Zhou, HU Ze-Hui, XIE Xi and SHEN Jie
(Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo University, Ningbo 315211, China)
Portunus trituberculatus as a popular table delicacy is one of the most important fishery and aquaculture species of crab around the coast of China. In crustaceans, molt-inhibiting hormone (MIH), a polypeptide secreted by the X-organ–sinus gland (XO-SG) of the eyestalks, had been proposed to regulate molting by inhibiting the synthesis of ecdysteroids from Y-organs (YO). The method for determining the levels of MIH mRNA in the swimming crab had been developed using relative quantification of quantitative real-time PCR (qRT-PCR). We found the expression level of MIH mRNA was the highest in the XO-SG. By taking surstage D0as the control group, the levels of MIH mRNA were analyzed by 2−ΔΔCtin a molt cycle, and the results showed that MIH transcripts down-regulated 0.42±0.08, increased (1.09±0.09, increased 1.35±0.16 fold in stage A, B, C, respectively, and down-regulated 0.78±0.07, down-regulated 0.27±0.08, down-regulated 0.20±0.04 fold in surstage D1, D2, D3/4, respectively. In addition, we used the method of high performance liquid chromatography-e1ectrospray ionization tandem mass spectrometry (LC-MS/MS) to complete the process of measuring the consistency of portunus molting ecdysteroid (20-hydroxyecdysone, 20E) in hemolymph. The results showed that the consistency of ecdysone was below the instrument detection limit of 0.33 pg in the post molt stage (A/B). In the inter-molt period (C), the consistency of ecdysone gradually returned to (1.666±0.762) ng/mL. In the pre-molt ecdysteroid titer increased gradually to (4.047±1.5133), (6.756±4.928) and (8.609±3.827) ng/mL in surstage D0, D1and D2, respectively. The ecdysteroid titer increased steadily to a peak of (19.534±4.799) ng/mL in the surstage D3, then dropped to 11.616 ng/mL in surstage D4. These stage-specific expression changes in MIH mRNA levels were accompanied by significant fluctuations in hemolymph ecdysteroid titer. During a molt cycle of the swimming crab, the expression of MIH exhibited a negative correlation with ecdysone in hemolymph, and this correlationindicated that MIH regulated the occurrence and advance of molt by inhibiting the ecdysteroid synthesis from YO.
Portunus trituberculatus; Molt cycle; MIH; qRT-PCR; LC-MS/MS
Q344
A
1000-3207(2013)01-0022-07
10.7541/2013.22
2011-11-08;
2012-10-18
国家自然科学基金项目(40976098); 国家科技富民强县专项行动计划项目(2011F012); 宁波市科技局科研项目(2012A610137, 2011B81003)资助
汪春建(1985—), 男, 浙江富阳人; 硕士研究生; 主要从事甲壳动物发育生物学研究。E-mail: bluesnail330@163.com
朱冬发, E-mail: zhudongfa@nbu.edu.cn
