噬藻体PaV-LD主要衣壳蛋白、穿孔素和内肽酶基因的克隆及表达分析
2013-04-19李三华高恶斌欧铜张奇亚
李三华高恶斌欧 铜张奇亚
(1.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049)
噬藻体PaV-LD主要衣壳蛋白、穿孔素和内肽酶基因的克隆及表达分析
李三华1,2高恶斌1欧 铜1,2张奇亚1,2
(1.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049)
最近阐明了水华蓝藻噬藻体PaV-LD (Planktothrix agardhiiVirus isolated from Lake Donghu)的全基因组序列, 这是一个含有142个ORF的双链DNA噬藻体。在此, 我们对其主要衣壳蛋白基因073R, 内肽酶和穿孔素基因123L-124L(PaV-LD基因组中两个相邻的ORF)进行了基因克隆与表达分析。将073R克隆后构建原核表达质粒pET-32a-073R, 并用IPTG进行诱导表达, 073R融合蛋白经纯化后, 进行免疫小鼠制备抗体;通过Western blot检测经噬藻体感染宿主细胞后073R的表达时序, 结果显示在宿主细胞裂解之初, 即PaV-LD感染48h以后073R开始表达, 表明073R是一个晚期基因; 同时073R推导的氨基酸序列与34株噬藻(菌)体及2株藻病毒(感染真核藻的病毒)的主要衣壳蛋白的氨基酸序列进行序列比对, 显示073R与无尾的藻病毒衣壳蛋白亲缘关系更近。PCR扩增内肽酶和穿孔素基因123L-124L, 并构建质粒pOP123L-124L, 将其转入模式藻集胞藻PCC6803细胞中, 质粒pOP123L-124L与藻集胞藻PCC6803基因组发生重组, 形成重组藻; 测定了重组藻与野生藻的生长速率, 并绘制生长曲线; 制备超薄切片, 进一步比较和观察重组藻与野生藻的超微结构的变化。结果显示重组藻与野生藻存在生长速率与超微形态的显著差异。
水华蓝藻噬藻体PaV-LD; 主要衣壳蛋白基因(073R); 内肽酶基因(123L); 穿孔素基因(124L)
据报道, 浮游病毒是水生态环境中丰度最高的微生物, 它们有丰富的遗传多样性和广泛的地域分布[1—9]。噬藻体是感染蓝藻(蓝细菌)的病毒, 作为浮游病毒的一个类群, 国内外相关领域的学者已对其开展了广泛研究[10—14]。
尤其是近些年, 关于我国最大的城中浅水型湖泊—武汉东湖中的浮游病毒形态多样性、季节分布及宏基因组分析等已有系列报道[15—17]。经多次分离和较长时间培养, 我们从东湖水样中分离获得了一株能够感染水华蓝藻的无尾噬藻体PaV-LD, 与已知有尾噬藻体目中的长尾科(Siphoviridae)、肌尾科(Myoviridae)和短尾科(Podoviridae) 成员不相同, PaV-LD缺少尾部结构, 呈多面体形态, 这也是无尾噬藻体的第一次报道[18]。从噬藻体PaV-LD全基因组序列中, 可知该噬藻体有142个潜在基因, 其中包括编码主要衣壳蛋白基因073R、内肽酶基因123L和穿孔素基因124L[19]。
通常病毒的主要衣壳蛋白基因是保守的结构蛋白基因, 并且其决定了病毒的形态, 在病毒颗粒的组装及病毒侵染等过程中起着重要的作用[20—22]。已知内肽酶是一种水解细菌(包括蓝藻)细胞壁肽聚糖中间部分肽链的酶[23,24]; 而穿孔素是一种溶细胞素,能使细胞膜形成小孔, 从而引起细胞的裂解[25]。现已知在PaV-LD基因组中, 内肽酶基因与穿孔素基因是连接在一起的, 形成 123L-124L。为深入认识PaV-LD的结构特征及基因功能, 我们对该噬藻体的073R、123L-124L分别进行了克隆和表达; 通过073R的原核表达及其抗体制备, 测定了噬藻体PaV-LD感染宿主细胞后主要衣壳蛋白基因的表达时序; 并进一步分析了123L-124L表达产物对宿主细胞的生长速率和超微形态的影响。
1 材料与方法
1.1 材料
噬藻体、菌株及载体质粒 噬藻体PaV-LD是由本实验室从武汉东湖水样中分离得到并保存[18]。噬藻体PaV-LD的扩增、提纯及基因组核酸的制备、以及感受态大肠杆菌(Escherichia coli) DH5α、BL21(DE3)的制备, 均采用常规方法[18,19]。pMD18-T克隆载体为TAKARA公司产品; 原核表达载体pET-32a(+)为Novagen公司产品。
酶和生化试剂 KpnⅠ和Hind III 限制性内切酶、T4 DNA 连接酶、T4 DNA聚合酶购自TAKARA公司; DNA Marker、Taq DNA 聚合酶购自北京全式金生物技术有限公司; 蛋白分子量Marker购自Fermentas公司; 醋酸纤维膜购自MILIPORE公司; 碱性磷酸酶标记的抗鼠IgG 二抗购自VECTOR公司。PCR 凝胶回收试剂盒、质粒提取试剂盒购自TIAN GEN公司; 其余试剂均为国产分析纯。
1.2 方法
073R的克隆及原核表达载体的构建 利用引物073R-F/R(引物序列见表 1), 以噬藻体PaV-LD基因组作为模板进行PCR扩增073R, PCR 反应体系: 灭菌双蒸水17 μL, 10×Taq Buffer (不含 Mg2+) 2.5 μL, 25mmol/L MgCl22.5 μL, dNTP混合物0.5 μL,上下游引物各0.5 μL, Taq 聚合酶 0.5 μL, PaV-LD基因组核酸1 μL。PCR 反应程序: 94℃预变性4min, (94℃ 30s, 53℃ 30s, 72℃ 90s, 30个循环), 最后72℃延伸10min。
扩增产物经1%琼脂糖凝胶进行电泳, 将回收后的目的基因片段与克隆载体pMD18-T连接, 构成重组质粒pMD18-T-073R, 再对大肠杆菌DH5α感受态细胞进行转化后, 用质粒提取试剂盒提取重组质粒, 并对其进行PCR鉴定和基因全长测序。重组质粒pMD18-T-073R中主要衣壳蛋白基因片段经KpnⅠ和Hind III 双酶切, 回收后定向插入经同样双酶切过的原核表达载体pET-32a(+)中, 构建原核表达质粒pET-32a-073R, 再转化大肠杆菌BL21 (DE3)感受态细胞。用质粒提取试剂盒提取质粒, 经双酶切后, 电泳验证。
073R原核诱导表达、蛋白纯化及抗血清制备将验证后正确的阳性克隆接种至200 mL Amp+LB培养基中37℃(225rpm/min)培养至A600约为0.6时,加入IPTG(使终浓度为1 mmol/L)诱导, 5h后, 经超声波破碎, 然后利用 Ni-NTA树脂亲和层析纯化融合蛋白[26]。
将纯化的融合蛋白免疫BALB/C小鼠制备抗体,先取纯化蛋白400 μL(约240 μg)与400 μL完全佐剂充分混匀乳化, 腹腔注射; 7d后加强免疫, 共4次,每次间隔7d, 均取纯化蛋白400 μL与等体积的不完全佐剂混合乳化, 腹腔注射; 第5次免疫后一周取血, 将血于室温放置30min或4℃静置6h, 2000 r/min离心2min, 吸取上层, 分装后于−80℃保存备用。
073R表达时序的Western blotting分析 先取对数期藻置于细胞六板孔内, 然后接种PaV-LD病毒悬液(按体积比1∶5), 同时以等体积的BG11培养基取代病毒悬液设为对照, 于25℃光照培养[27]。分别在0h、12h、24h、36h、48h、60h、72h、84h、96h收集感染PaV-LD的藻液, 经28000 r/min 离心1h,沉淀用50 μL TE(pH 8.0)重悬, 加50 μL 蛋白上样缓冲液, 沸水煮5min, 用5%的浓缩胶, 12%的分离胶进行SDS-PAGE电泳, 转膜后用含5%脱脂奶粉的TBS (0.02 mol/L Tris-HCl pH 7.4; 154 mmol/L NaCl)孵育1h, 然后用含有0.1%吐温−20的TBS-T洗3次后, 分别用制备的小鼠血清(PBS 1∶500稀释)、碱性磷酸酶标记的羊抗兔IgG(PBS 1∶1000稀释)孵育1h, 用TBS-T洗三次后, 采用NBT/BCIP显色试剂盒进行显色, 随时观察显色情况, 最后用双蒸水终止反应[28]。
073R的进化分析 采用软件DNA Star Lasergene 7.1, 对073R推导的氨基酸序列与来自GeneBank数据库的34株噬藻(菌)体及2株藻病毒的主要衣壳蛋白基因进行序列比对分析, 利用MEGA4软件作进化分析和构建进化树。
124L-123L的PCR扩增、重组与转染质粒的构建及模式藻转化 利用引物124L-F和123L-R(引物序列见表1)以PaV-LD核酸为模板, 扩增124L-123L, PCR反应体系及反应程序参见前面所述(稍有变动: 54℃退火30s, 72℃延伸1min);电泳回收后将上述两个基因插入到pMD18-T载体中, 构成质粒pT-124L-123L。然后将含有壮观霉素抗性基因(Omega)和启动子(PpetE)的核酸片段Omega-PpetE组装到质粒pT-124L-123L中, 位于124L上游, 构成重组质粒pT-Omega-PpetE-124L-123L。然后利用EcoRⅠ和Hind Ⅲ从重组质粒中切下Omega-PpetE- 124L-123L片段, 补平后定点插入到载体质粒pKW1188所携带的基因slr0168中间, 构成转化质粒pOP124L-123L。
集胞藻PCC6803的转化: 收集A730为0.8左右的藻细胞, 重悬后与转染质粒pOP124L-123L混合,于光照条件下25℃孵育4h, 然后均匀涂布在覆有硝酸纤维素滤膜的BG11平板上; 光照培养24h后, 将滤膜转移至含有10 μg/mL 壮观霉素和50 mmol/L葡萄糖的BG11平板上再培养[29]。转染质粒进入藻后, 与之基因组发生重组形成重组藻, 从长出的重组藻中, 筛选克隆, 继续培养并进一步分析。
重组藻的检测与分析 (1)PCR扩增。先制备作为模板的野生藻核酸、重组藻核酸及重组质粒pOP124L-123L[18,19], 用启动子PpetE上游引物PpetE-F与124L下游引物124L-R、123L基因下游引物 123L-R和slr0168基因上游引物slr0168-F分别组成的三对检测引物(引物序列见表1), 通过PCR扩增, PCR产物经1%琼脂糖电泳分析。(2)生长速率测定。配制缺铜的BG11液体培养基, 分别用该培养基将野生藻及重组藻初始浓度调至A730为0.009; 然后在25℃、光照[~35μE/(m2·s)]条件下添加400 nmol/L Cu2+诱导, 另外, 在重组藻培养基中加入10 μg/mL 壮观霉素, 以抑制野生藻的生长。随后每天取样(共培养测定22d), 并通过分光光度计测定其A730值, 指示藻细胞的浓度; 以时间为横坐标, 以A730值为纵坐标绘制生长曲线。(3)透射电镜观察。分别收集培养20d的野生及重组藻细胞, 用2.5%戊二醛固定后按照实验室常规方法制备超薄切片[18];利用JEOL 1230型透射电镜于80kV条件下进行超微观察。

表1 本研究所用引物及序列(5′—3′)Tab.1 Sequences of the primers used in this study (5′—3′)
2 结果
2.1 获得073R 的克隆与原核表达质粒pET-32a-073R
以PaV-LD基因组为模板, 使用引物073R-F/R通过PCR的方法扩增到特异的073R, 其分子量大小约1 kb。将这条核酸带切胶回收后, 连接到克隆载体pMD18-T上, 经PCR和双酶切鉴定, 得到阳性克隆。序列测定表明pMD18-T-073R中插入基因的序列与PaV-LD 073R 序列一致。
原核表达质粒pET-32a-073R经KpnⅠ和Hind III双酶切验证。同时对PCR检测的阳性克隆作进一步测序分析, 结果质粒pET-32a-073R中插入的基因序列与073R的序列完全一致, 显示已成功构建PaV-LD 073R的原核表达质粒。
2.2 073R原核表达产物
将诱导pET-32a-073R表达的样品进行SDSPAGE电泳分析。出现一条较高浓度的诱导表达融合蛋白带(53 kD), 其中包括载体表达蛋白约17 kD及073R约36 kD, 但在未诱导的样品中没有相应的蛋白带, 经离子交换树脂亲和层析柱后,得到纯化的53 kD融合蛋白带(图1)。提纯的融合蛋白用于免疫小鼠,制备鼠抗 PaV-LD 073R血清。
2.3 073R表达时序
利用上述制备的抗血清, 对感染PaV-LD后不同时间制备的藻细胞蛋白进行Western blotting 分析, 检测感染过程中 PaV-LD 073R 在宿主细胞内的表达时序。结果显示: 在PaV-LD感染48h后, 36 kD的特异条带开始有微弱表达; 60h至84h, 其表达量显著增强; 而在96h有所减弱(图2A)。
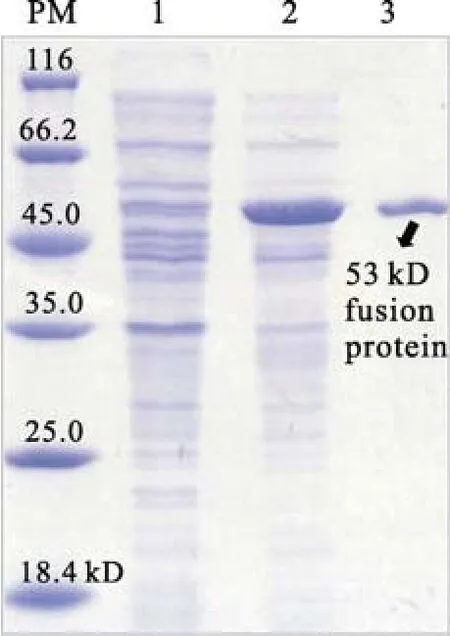
图 1 PaV-LD 073R 原核表达产物SDS-PAGE分析Fig.1 Analysis the prokaryotic expression of PaV-LD 073R gene by SDS-PAGE
另外, 利用显微镜观察感染噬藻体后宿主藻的形态变化, 可见在PaV-LD感染48h后, 宿主藻的丝状体断裂增多, 并且随着感染时间的延长, 裂解量和裂解程度不断增加, 至96h丝状体完全断裂消失(图2B)。可见073R是在宿主藻细胞发生裂解时才表达, 这显示073R是在PaV-LD的感染晚期表达。
2.4 073R序列进化地位
073R全长954 bp,共编码317个氨基酸, 与其他的34株噬藻(菌)体及2株藻病毒(感染真核藻的病毒)的主要衣壳蛋白氨基酸进行序列比对, 并借助软件MEGA4构建Neighbor-Joining系统进化树。结果显示噬藻体PaV-LD 073R与有尾噬藻(菌)体 Siphoviridae, Myoviridae, Podoviridae成员的同源性不高,而与无尾藻病毒PBCV-1, EhV86的亲缘关系相距较近(图 3)。
2.5 重组质粒pOP124L-123L与重组藻的鉴定
对重组藻与野生藻进行PCR检测, PCR产物电泳结果如图4A所示, 条带大小与预期一致, 除在转化质粒pOP124L-123L中检测到启动子PpetE、123L、124L、基因slr0168的N端外, 在重组藻也能检测到上述基因片段的存在, 而在野生藻中则没有检测到,说明片段Omega-PpetE-124L-123L成功经同源重组定向插入到集胞藻PCC6803基因组slr0168基因中;另外, 引物PpetE-F、124L-R、123L-R和slr0168-F的位置如图4B所示, PCR扩增结果也说明片段插入方向正确, 即PpetE启动子和Omega在基因124L的上游。图4B显示了将转化质粒pOP124L-123L转入野生藻发生同源重组后的重组藻染色体结构示意图。
2.6 重组藻的生长速率与超微形态发生变化
通过测定, 野生藻从培养第6天开始生长迅速加快, 在第6至第18天期间A730近乎呈直线上升,从0.204上升到1.181, 直至第19天达到最大值1.225, 其后生长速度减缓, 趋于平稳。而同时重组藻从第6天开始虽然生长速度也明显加快, 但在第6至第18天期间A730仅从0.167升到0.698, 直至第21天才达到其最大值0.737, 显然重组藻较之野生藻生长速度明显变慢(图5)。

图2 Western blot 分析 073R 的表达时序及宿主藻感染PaV-LD后不同时间显微图Fig.2 Analysis of the temporal expression of the 073R gene by Western blot and optical microphotographs of host algae cultures after infected by PaV-LD

图3 073R编码蛋白 (星号, PaV-LD) 与有尾噬藻(菌)体及无尾藻病毒主要衣壳蛋白(MCP)的系统进化分析Fig.3 Phylogenetic analysis of 073R encoding proteins (star, PaV-LD), MCP of tailed cyanophages (or phages) and tailless phycovirus
超微观察显示, 野生藻细胞外周呈现电子密度较低的细胞壁是清晰完整的(图6 Wt); 而重组藻部分细胞壁则很模糊甚至消失, 且细胞原生质体局部肿胀, 细胞内容物有溢出趋势(图6 Re中箭头所示)。表明重组藻这部分细胞壁已受损或溶解。
3 讨论

图4 PCR鉴定重组藻的电泳图和重组藻染色体结构示意图Fig.4 Confirmation of recombinant Synechocystis sp.PCC6803 by PCR and chromosome structure of the recombinant
衣壳是病毒的蛋白质外壳, 由于主要衣壳蛋白基因具有结构的相对稳定性和序列的保守性, 使人们一直将其作为病毒分类的重要参考[30]。近年来,由于主要衣壳蛋白基因在噬藻体进化关系和多样性分析方面的灵敏和可靠性, 常被作为标志基因[31,32]。本研究对PaV-LD 073R的进化分析显示, PaV-LD与已知有尾噬藻(菌)体亲缘关系较远, 而与无尾藻病毒的亲缘关系相对较近, 这与电镜观察到的无尾形态学特征相吻合。这表明PaV-LD的进化地位居于原核噬藻体与真核藻病毒之间, 且推测衣壳蛋白基因的进化可能与噬藻体有无尾巴关系密切。
病毒感染宿主后, 要通过基因组的表达完成自身所需生物大分子的合成, 且基因表达按一定时间程序展现, 因此了解噬藻体基因的表达时序有助于揭示这类病毒生命周期及与宿主的相互作用[33,34]。在原核表达073R并制备抗体的基础上, 我们采用Western blotting与显微观察相结合的方法, 明确了073R起始表达的时间与宿主藻丝的裂解时间同步,即073R在其宿主藻丝状体断裂后才能检测到有所表达, 显示073R是PaV-LD的晚期表达基因。
一般认为, 噬菌体要感染细胞就要穿过细胞壁将其核酸注入宿主细胞内, 这个过程需要具有肽聚糖水解活性的酶及穿孔素等发挥作用[23], 而大多数噬菌体至少需要细胞内溶素和穿孔素两种蛋白才能裂解宿主细胞[35], 使子代噬菌体能顺利释放。有证据表明, 来源于噬菌体P22的细胞溶解素和穿孔素能成功裂解集胞藻PCC6803[36]。由于PaVLD的自然宿主藻尚无现成的遗传操作系统,在此借用模式蓝藻集胞藻PCC6803表达PaV-LD 的基因。在获得含123L-124L重组藻的基础上, 分析结果显示, 与野生藻相比,重组藻的生长速率及细胞壁的超微形态都发生显著变化。已有报道介绍, 在实验室条件下, 当外源基因插入slr0168基因中, 检测不到其对集胞藻PCC6803有影响[29]。这就表明重组藻细胞壁受损是由于转入了噬藻体PaV-LD 的123L-124L所致, 且这两个基因确实发挥了内肽酶与穿孔素的作用, 从而导致重组藻细胞壁损伤或溶解, 并使重组藻细胞生长速率减缓。
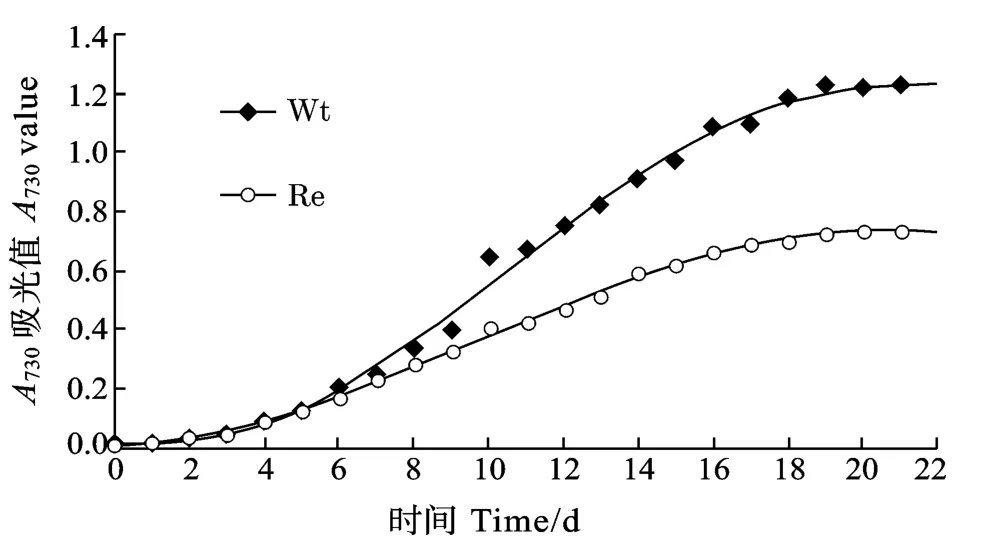
图5 野生藻和重组藻的生长速率Fig.5 Growth curves of wild type and the Recombinant of Synechocystis sp.PCC6803

图 6 野生藻和重组藻的生长速率及超微形态Fig.6 Growth curves and ultramicroscopic morphology of Wild type and the Recombinant of Synechocystis sp.PCC6803
水生病毒学研究的对象包括水生动物病毒和蓝藻病毒 (噬藻体) 等。近期, 有专家指出, 我国水产动物病毒病原基因组及其功能基因的研究快速发展,因此为获得水产动物抗病性状和候选抗病相关基因奠定了基础[37]。尽管与水产动物病毒学研究相比,我国噬藻体基因组及功能基因的相关研究尚在起步阶段, 但本研究提示: 通过基因组及功能基因研究,不仅有益于人们了解噬藻体的侵染机制, 也将有助于噬藻体重要功能基因的发现, 并就此可进一步研发噬藻体控藻技术。
致谢:
质粒T-Omega-PpetE 和pKW1188由中国科学院水生生物研究所徐旭东研究员实验室惠赠, 谨致谢忱。
[1] Zhang Q Y.Virioplankton [J].Acta Hydrobiologica Sinica, 2002, 26(6): 691—696 [张奇亚.浮游病毒.水生生物学报, 2002, 26(6): 691—696]
[2] Sullivan M B, Waterbury J B, Chisholm S W.Cyanophages infecting the oceanic cyanobacterium Prochlorococcus [J].Nature, 2003, 424(6952): 1047—1051
[3] Hambly E, Suttle C A.The viriosphere, diversity, and genetic exchange within phage communities [J].Current Opinion in Microbiology, 2005, 8(4): 444—450
[4] Suttle C A.Marine viruses—major players in the global ecosystem [J].Nature Reviews Microbiology, 2007, 5(10): 801—812
[5] Zhang Q Y, Gui J F.A kind of strategic bio-resource not to be neglected—freshwater and marine viruses and their roles in the global ecosystem [J].Bulletin of the Chinese Academy of Sciences, 2009, 24(4): 414—420 [张奇亚, 桂建芳.一类不可忽视的战略生物资源——淡水与海水中的病毒及其在生态系统中的作用.中国科学院院刊, 2009, 24(4): 414—420]
[6] Liu X, Zhang Q, Murata K, et al.Structural changes in a marine podovirus associated with viral genome release into Prochlorococcus [J].Nature Structural & Molecular Biology, 2010, 17(7): 830—836
[7] Fischer M G, Suttle C A.A virophage at the origin of large DNA transposons [J].Science, 2011, 332(6026): 231—234
[8] Pope W H, Jacobs-Sera D, Russell D A, et al.Expanding the Diversity of Mycobacteriophages: Insights into Genome Architecture and Evolution [J].PloS One, 2011, 6(1): e16329
[9] Thompson L R, Zeng Q, Kelly L, et al.Phage auxiliary metabolic genes and the redirection of cyanobacterial host carbon metabolism [J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(39): E757—E764
[10] Zhao Y J, Cheng K, Shi Z L, et al.Isolation and identification of the first cyanophage in China [J].Progress in Nature Science, 2002, 12(9): 923—927 [赵以军, 程凯, 石正丽, 等.我国首株噬藻体(蓝藻病毒)的分离与鉴定.自然科学进展, 2002, 12(9): 923—927]
[11] Yoshida M, Yoshida T, Kashima A, et al.Ecological dynamics of the toxic bloom-forming cyanobacterium Microcystis aeruginosa and its cyanophages in freshwater [J].Applied and Environmental Microbiology, 2008, 74(10): 3269—3273
[12] Gao E B, Li S H, Lü B, et al.Analysis of the cyanophage (PaV-LD) infection in host cyanobacteria under different culture conditions [J].Acta Hydrobiologica Sinica, 2012, 36(3): 420—425 [高恶斌, 李三华, 吕波, 等.水华蓝藻噬藻体对不同条件培养的宿主细胞感染性分析.水生生物学报, 2012, 36(3): 420—425]
[13] Sabehi G, Shaulov L, Silver D H, et al.A novel lineage of myoviruses infecting cyanobacteria is widespread in the oceans [J].Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(6): 2037-2042
[14] Liu L, Guo Z L, Huang P, et al.Isolation and identification of a cyanophage in Lake Taihu [J].Acta Hydrobiologica Sinica, 2012, 36(2): 339—343 [刘露, 郭宗楼, 黄朴, 等.一株太湖水域蓝藻噬藻体的分离与鉴定.水生生物学报, 2012, 36(2): 339—343]
[15] Liu Y M, Zhang Q Y, Yuan X P.Studies on abundance and morphological diversity of virioplankton in the Donghu Lake, Wuhan [J].Acta Hydrobiologica Sinica, 2005, 29(1): 1—6 [刘艳鸣, 张奇亚, 袁秀平.武汉东湖浮游病毒的丰度及多样性.水生生物学报, 2005, 29(1): 1—6]
[16] Liu Y M, Zhang Q Y, Yuan X P, et al.Seasonal variation of virioplankton in a eutrophic shallow lake [J].Hydrobiologia, 2006, 560(1): 323—334
[17] Liu Y M, Yuan X P, Zhang Q Y.Spatial distribution and morphologic diversity of virioplankton in Lake Donghu, China [J].Acta Oecologica-International Journal of Ecology, 2006, 29: 328—334
[18] Gao E B, Yuan X P, Li R H, et al.Isolation of a novel cyanophage infectious to the filamentous cyanobacterium Planktothrix agardhii (Cyanophyceae) from Lake Donghu, China [J].Aquatic Microbial Ecology, 2009, 54(2): 163—170
[19] Gao E B, Gui J F, Zhang Q Y.A Novel Cyanophage with a Cyanobacterial Nonbleaching Protein A Gene in the Genome [J].Journal of Virology, 2012, 86(1): 236—245
[20] Bowman B R, Baker M L, Rixon F J, et al.Structure of the herpesvirus major capsid protein [J].The EMBO Journal, 2003, 22(2): 757—765
[21] Chen R, Neill J D, Noel J S, et al.Inter-and intragenus structural variations in calicivimses and their functional implications [J].Journal of Virology, 2004, 78(12): 6469—6479
[22] Pope W H, Weigele P R, Chang J, et al.Genome Sequence, Structural Proteins, and Capsid Organization of the Cyanophage Syn5: A “Horned” Bacteriophage of Marine Synechococcus [J].Journal of Molecular Biology, 2007, 368(4): 966—981
[23] Moak M, Molineux I J.Peptidoglycan hydrolytic activities associated with bacteriophage virions [J].Molecular Microbiology, 2004, 51(4): 1169—1183
[24] Liu X, Kong S, Shi M, et al.Genomic analysis of freshwater cyanophage Pf-WMP3 infecting cyanobacterium Phormidium foveolarum: the conserved elements for a phage [J].Microbial Ecology, 2008, 56(4): 671—680
[25] Gründling A, Manson M D, Young R.Holins kill without warning [J].Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(16): 9348— 9352
[26] He L B, Ke F, Zhang Q Y.Cloning, expression and localization analysis of a sequence conserved gene (RGV-12L) from Rana grylio virus [J].Acta Hydrobiologica Sinica, 2010, 34(6): 1166—1171 [何利波, 柯飞, 张奇亚.蛙虹彩病毒一个序列保守基因(RGV-12L)的克隆表达及定位分析.水生生物学报, 2010, 34(6): 1166—1171]
[27] Gao E B, Li S H, Lü B, et al.The analysis of the cyanophage (PaV-LD) infection in host cyanobacteria under different culture conditions [J].Acta Hydrobiologica Sinica, 2012, 36(3): 420—425 [高恶斌, 李三华, 吕波, 等.水华蓝藻噬藻体对不同条件培养的宿主细胞感染性分析.水生生物学报, 2012, 36(3): 420—425]
[28] Chen Z Y, Liu H, Li Z Q, et al.Development and characterization of monoclonal antibodies to spring viraemia of carp virus [J].Veterinary Immunology and Immunopathology, 2008, 123 (3-4): 266—276
[29] Gao H, Tang Q, Xu X D.Construction of copper-induced gene expression platform in Synechocystis sp.6803 [J].Acta Hydrobiologica Sinica, 2007, 31(2): 240—243 [高宏, 唐蜻,徐旭东.集胞藻 PCC6803 铜离子诱导表达平台的构建.水生生物学报, 2007, 31(2): 240—243]
[30] Zhan Q Y, Xiao F, Li Z Q, et al.Characterization of an iridovirus from the cultured pig frog Rana grylio with lethal syndrome [J].Diseases of Aquatic Organisms, 2001, 48(1): 27—36
[31] Larsen J B, Larsen A, Bratbak G, et al.Phylogenetic analysis of members of the phycodnaviridae virus family, using amplified fragments of the Major Capsid Protein gene [J].Applied and Environmental Microbiology, 2008, 74(10): 3048—3057
[32] Rowe J M, Fabre M F, Gobena D, et al.Application of the major capsid protein as a marker of the phylogenetic diversity of Emiliania huxleyi viruses [J].FEMS Microbiology Ecology, 2011, 76(2): 373—390
[33] Lindell D, Jaffe J D, Johnson Z I, et al.Photosynthesis genes in marine viruses yield proteins during host infection [J].Nature, 2005, 438(7064): 86—89
[34] Ferrer M D, Quiles-Puchalt N, Harwich M D, et al.RinA controls phage-mediated packaging and transfer of virulence genes in Gram-positive bacteria [J].Nucleic Acids Research, 2011, 39(14): 5866—5878
[35] Wang I N, Smith D L, Young R.Holins: The protein clocks of bacteriophage infections [J].Annual Review Microbiology, 2000, 54(1): 799—825
[36] Liu X, Curtiss R 3rd.Nickel-inducible lysis system in Synechocystis sp.PCC6803 [J].Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(51): 21550—21554
[37] Gui J F, Zhu Z Y, Molecular basis and genetic improvement of economically important traits in aquaculture animals [J].Chinese Science Bulletin, 2012, 57(15): 1751—1760
CLONING AND EXPRESSION ANALYSIS OF MAJOR CAPSID PROTEIN GENE, ENDOPEPTIDASE AND HOLIN GENE OF CYANOPHAGE PAV-LD
LI San-Hua1,2, GAO E-Bin1, OU Tong1,2and ZHANG Qi-Ya1,2
(1.State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2.University of Chinese Academy of Sciences, Beijing 100049, China)
he 142 open reading frame (ORF) of the genome of cyanophage, PaV-LD (Planktothrix agardhiivirus isolated from the Lake Donghu), was elucidated recently.However, the characteristic of genomic, phylogenetic position, and mechanism of infection remained to be examined on PaV-LD, a novel tailless caynophage.With the relatively stable structure and evolutionarily conserved sequence, the major capsid protein (MCP) gene has been an important reference in the classification of these viruses.Endopeptidase and holin were considered to play an important role in the progress of invasion and release of viruses.The MCP gene (073R), endopeptidase gene (123L), and holin gene (124L) of cyanophage PaV-LD were cloned and the expressions were analysed.PaV-LD073Rwas amplified and cloned, and the prokaryotic expression plasmid pET-32a-073R was constructed.The prokaryotic expression products of PaV-LD073Rwas analyzed by SDS-PAGE after being induced with isopropyl beta-D-thiogalactopyranoside (IPTG).The fusion protein was purified via affinity chromatography and was then used to immunize BALB/C mice to prepare the antiserum against PaV-LD 073R.Next the antiserum was used for Western blotting analysis and the temporal expression pattern of PaV-LD073Rwas characterized during PaV-LD infection at different times.The results of western blotting indicated that the MCP was initially expressed at 48h post-infection (p.i.) and developed into particularly enhanced from 60h p.i.to 84h p.i.The data also demonstrated that073Rwas a late expression gene of the tailless cyanophage genome.To further investigate the phylogenetic position of PaV-LD, a phylogenetic tree was constructed using the Neighbor-Joining method with 34 tailed cyanophages and 2 phycoviruses (viruses that infect eukaryotic algae).The analysis of the phylogenetic tree revealed that the amino acid sequences in PaV-LD 073R grouped more closely with tailless phycoviruses instead of the tailed cyanophages, indicating that PaV-LD had the morphological characteristics of the tailless phycoviruses.PaV-LD endopeptidase gene and holin gene (two adjacent ORFs in the genome of PaV-LD,123L-124L) were amplified using polymerase chain reaction (PCR) and the plasmid contained a spectinomycin resistance gene, then the promoter genes pPetE and 123L-124L were constructed and integrated into the genome of Synechocystis sp.PCC6803 via homologous recombination.The growth curves of the recombinant and the wild type of Synechocystis sp.PCC 6803 were drawn, and the growth rate of the recombinant was found to be significantly slower than the wild type.Ultrastructural morphology observation with transmission electron microscopy showed that the cell wall of recombinant was damaged partly or fully, causing protoplast swelling and the leakage of cell contents.Results suggested that PaV-LD 123L-124L could express the functional proteins that played a role in dissolving cell wall and slowing down cell growth in the recombinant Synechocystis sp.PCC 6803.
Cyanophage infecting bloom-forming cyanobacteria PaV-LD; Major capsid protein gene (073R); Endopeptidase gene (123L); Holin gene (124L)
X179
A
1000-3207(2013)02-0252-09
10.7541/2013.12
2012-03-27;
2012-10-09
中国科学院先导专项项目(KSCX2-EW-Z-3); 国家自然科学基金项目(31072239); 淡水生态与生物技术国家重点实验室基金(2011FBZ12)资助
李三华(1987—), 男, 山西人; 硕士研究生; 从事水生病毒及分子生物学研究。E-mail: lisanhua1987@163.com
张奇亚, Tel: +86-027-68780792; E-mail: zhangqy@ihb.ac.cn
