饲料蛋氨酸水平对异育银鲫幼鱼生长性能影响的研究
2013-04-19鹏薛敏朱选刘海燕吴秀峰王嘉郑银桦徐美娜
贾 鹏薛 敏朱 选刘海燕吴秀峰王 嘉郑银桦徐美娜
(1.河北师范大学生命科学学院, 石家庄 050024; 2.中国农业科学院饲料研究所国家水产饲料安全评价基地,北京 100081; 3.赢创德固赛(中国)投资有限公司, 北京 100026)
饲料蛋氨酸水平对异育银鲫幼鱼生长性能影响的研究
贾 鹏1,2薛 敏2朱 选3刘海燕1吴秀峰2王 嘉2郑银桦2徐美娜2
(1.河北师范大学生命科学学院, 石家庄 050024; 2.中国农业科学院饲料研究所国家水产饲料安全评价基地,北京 100081; 3.赢创德固赛(中国)投资有限公司, 北京 100026)
研究通过8周的生长实验, 研究饲料中不同蛋氨酸水平对异育银鲫(Carassius auratus gibelio)幼鱼生长性能、体成分、氨基酸沉积率的影响。实验以鱼粉、豌豆浓缩蛋白、喷雾干燥血球粉为蛋白源, 设计低蛋氨酸(0.57%)实用基础饲料, 并在此基础上分别添加0、0.08%、0.16%、0.24%、0.32%、0.40%的DL-蛋氨酸配成蛋氨酸含量分别为0.57%、0.64%、0.74%、0.81%、0.88%、0.95%(干物质基础, 实测值)的6种等氮等能(粗蛋白质: 37.22%, 总能: 17.61 MJ/kg)的配合饲料。选取初始体重为2.60 g的异育银鲫幼鱼为实验对象,每个处理3个重复, 每个重复50尾鱼, 养殖系统为室内循环水养殖系统, 每天表观饱食投喂4次。结果显示在饲料中补充DL-蛋氨酸会显著提高异育银鲫幼鱼的特定生长率和蛋白质沉积率(P<0.05), 表明异育银鲫可有效利用外源DL-蛋氨酸。各处理组实验鱼肥满度、肝体比、脏体比差异不显著(P>0.05), 不同蛋氨酸水平对全鱼水分、粗脂肪、能量没有产生显著影响(P>0.05), 补充DL-蛋氨酸显著提高鱼体的粗蛋白质含量, 灰分含量显著降低(P<0.05)。随着饲料中蛋氨酸水平的提高, 全鱼蛋氨酸沉积率显著降低, 之后再升高(P< 0.05)。补充DL-蛋氨酸可以有效促进其他必需氨基酸在鱼体内的沉积。在饲料中胱氨酸水平为0.42%时, 通过折线模型回归分析, 以蛋氨酸沉积率得到的异育银鲫幼鱼蛋氨酸需求量为占饲料干物质的0.89%, 即占饲料蛋白的2.17%。
蛋氨酸; 异育银鲫; 生长
蛋白质是水生动物饲料中最重要的营养成分,也是饲料中成本最高的部分。鱼类对蛋白质的需求实际上就是对必需氨基酸的需求, 所以渔用饲料中的氨基酸平衡, 尤其是必需氨基酸的平衡是提高饲料利用率的的重要途径[1]。蛋氨酸是水生动物的含硫必需氨基酸。在许多植物性蛋白源中(豆粕、花生粕等), 蛋氨酸是第一限制性氨基酸[2,3]。蛋氨酸参与蛋白质的合成, 以S-腺苷甲硫氨酸的形式作为各种化合物甲基化的供体参与机体的众多代谢过程, 同时也是合成胱氨酸、胆碱的前体[4,5]。因此, 只有当饲料中的蛋氨酸水平满足鱼类生长的需求量时, 才能够使其获得最大生长并同时提高饲料利用率[6]。目前, 国内外已经开展了大量在渔用饲料中添加晶体蛋氨酸的研究, 并确定了包括印度鲮(Cirrhinus mrigala H.)[7]、鲤鱼(Cyprinus carpio L.)[8]、草鱼(Ctenopharngodon idella)[9]、大黄鱼(Pseudosciaena crocea R)[10]和大口黑鲈(Micropterus salmoides)[11]等众多鱼类的蛋氨酸需求量。
异育银鲫(Carassius auratus gibelio)是中国科学院水生生物研究所20世纪80年代利用雌核发育生物技术, 以兴国红鲤(Cyprinus carpio var.singuonensis)的精子刺激方正银鲫(Carassius auratus gibe-lio Bloch.)的卵细胞培育的新品系。由于它保留了鲫鱼肉质鲜美、细嫩的特点, 同时具有食性广、生长快、病害少、养殖周期短、子代不分离等优势, 目前已经成为我国鲫鱼养殖中的主要品系, 是目前鲤科鱼类的主要养殖品种之一[12]。迄今为止, 已有大量有关异育银鲫的营养需求的研究, 已经确定了如蛋白质、脂肪[13]、碳水化合物、必需脂肪酸、几种维生素[14]等需求量。在蛋氨酸需求量方面, 周贤君以鱼粉、酪蛋白、豆粕为蛋白源, 部分蛋白以晶体氨基酸混合物替代制成半精制饲料, 以初均重1.67 g的异育银鲫为实验对象研究了异育银鲫幼鱼的蛋氨酸需求量为占饲料干物质的0.69%(胱氨酸含量为0.42%), 占饲料蛋白的1.68%[15]。本实验以实用饲料为基础, 旨在探讨饲料中不同水平蛋氨酸对异育银鲫的影响, 验证并确定异育银鲫对饲料中蛋氨酸的需求量, 为异育银鲫配合饲料的配制提供更为准确的理论依据。
1 材料与方法
1.1 实验饲料
实验用DL-蛋氨酸由赢创德固赛(中国)投资有限公司提供。本研究以鱼粉、豌豆浓缩蛋白、喷雾干燥血球粉为主要蛋白源, 豆油为脂肪源, 配制低蛋氨酸实用基础饲料, 并设定为对照组。在基础饲料中分别添加0、0.08%、0.16%、0.24%、0.32%和0.40%的DL-蛋氨酸, 同时通过调节饲料中L-谷氨酸的含量, 设计6种等氮等能的实验饲料, 分别将其命名为DLM0、DLM1、DLM2、DLM3、DLM4、DLM5。饲料原料粉碎后全部通过100目筛, 按照添加量从小到大的顺序逐级搅拌混匀, 制成直径1 mm的硬颗粒料, 自然晾干后于−20℃保存。实验基础饲料配方和化学组成(表1), 各实验饲料氨基酸成分分析(表2)。
1.2 实验用鱼与饲养条件
实验用异育银鲫购自天津市水产科学研究所鱼苗场, 正式实验前进行为期2周的驯养, 以适应环境。养殖实验在中国农业科学院饲料研究所国家水产饲料安全评价基地室内循环水养殖系统中进行。该系统每桶水体容积为256 L, 实验用水为曝气地下水, 水流速度约为0.4 L/s。实验采用体质健康、个体大小均匀的异育银鲫(2.60±0.00)g, 随机分为6个处理组, 每个处理组3个重复, 每个重复50尾鱼。饲养周期56d, 实验开始和停止前24h停止投喂。每天表观饱食投喂4次, 时间分别为9:00、12:00、15:00、18:00。每天测定一次水质, 溶氧保持在7.0 mg/L左右, 氨氮≤0.4 mg/L, 亚硝酸盐≤0.15 mg/L, pH7.5—8.5, 水温26—28℃。光照周期为自然光照周期。
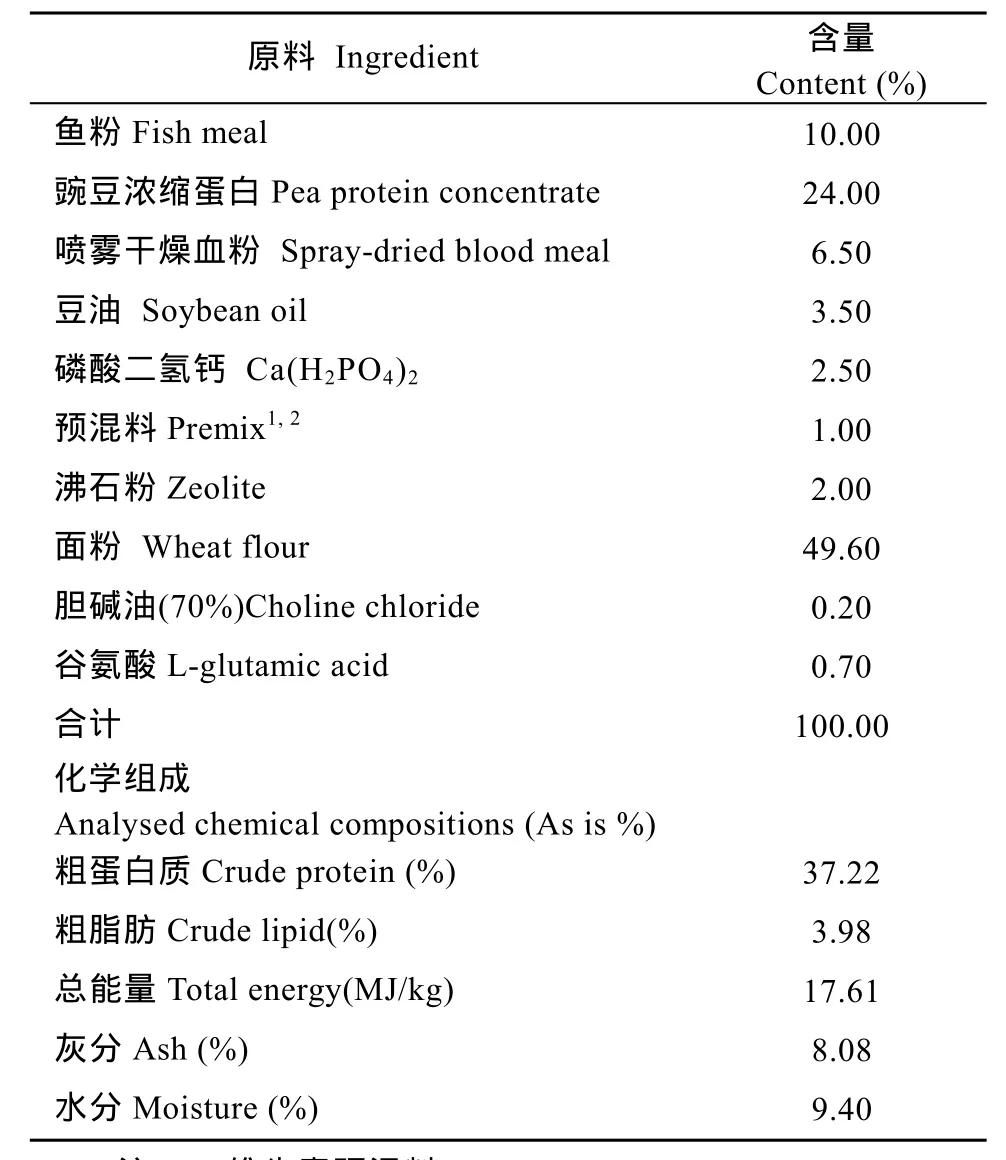
表1 基础饲料配方和化学组成(风干基础)Tab.1 Formulation and chemical compositions of the basal diet(air-dry basis)
1.3 取样及分析检测
养殖实验开始时, 取200 g初始鱼样品于−20℃保存。养殖实验结束前1天, 鱼体禁食24h后称量每桶鱼总重。并从每桶取20尾鱼作终末全鱼样品。每桶随机取4尾鱼, 分别测量其体重、体长、然后解剖, 称量其内脏重和肝脏重。初始和实验结束后采集的全鱼样品, 用组织匀浆机匀浆, 于75℃烘干,将烘干样品粉碎后, 留作体成分分析。饲料和全鱼的粗蛋白质(凯氏定氮法)、粗脂肪(酸水解全脂肪测定法)、总能(氧弹测热法)、水分和灰分采用 AOAC方法进行(AOAC, 1997)。饲料及全鱼氨基酸组成的测定, 参照国标测定方法(GB/T5009.124-2003), 16种氨基酸(色氨酸和酪氨酸被分解)采用酸水解和氧化水解两种方法分别处理用于测定其中14种和2种含硫氨基酸, 用日立L-8900型氨基酸分析仪测定。

表2 实验饲料氨基酸组成分析 (%干物质)Tab.2 Analyzed amino acid composition of the experimental diets (% dry matter)
1.4 计算公式及数据统计
存活率(Survival rate, SR, %)=100×成活鱼尾数/投放鱼尾数
特定生长率(Specific growth rate, SGR, %/d)=100× [ln末均重−ln初均重]/实验天数
摄食率(Feed intake, FI, %/d)=100×总摄食量/[(初总重+终总重)/2]/实验天数
饲料系数(Feed conversion ratio, FCR)=总摄食量/鱼体净增重
蛋白质沉积率(Protein productive value, PPV, %)=100×(末总重×末鱼体蛋白质含量−初总重×初鱼体蛋白质含量)/(总摄食量×饲料蛋白质含量)
能量沉积率(Energy productive value, EPV, %) = 100×(末总重×末鱼体能量含量-初总重×初鱼体能量含量)/(总摄食量×饲料能量含量)
氨基酸沉积率(Amino acid productive value, APV, %)=100×(末总重×末鱼体氨基酸含量−初总重×初鱼体氨基酸含量)/(总摄食量×饲料氨基酸含量)
肥满度(Condition factor, CF, %)=100×体重/体长3
脏体比(Viscerasomatic index, VSI, %)= 100×内脏重/体重
肝体比(Hepaticsomatic index, HSI, %)=100×肝脏重/体重
实验数据采用“平均值±标准误”表示, 使用统计软件STATISTICA6.0对实验数据进行单因素方差分析(One-way ANOVA), 差异显著时通过Duncan’s方法进行多重比较, 以P<0.05为差异显著性标准。蛋氨酸需求量以特定生长率和蛋氨酸沉积率为指标进行折线模型(Broken-line model)回归分析。
2 结果
2.1 蛋氨酸水平对异育银鲫幼鱼生长性能的影响
从表3可以看出, 饲料中蛋氨酸水平显著影响了异育银鲫的生长(P<0.05)。DLM5组终末体重显著高于其他组; DLM5组SGR显著高于除DLM3组之外的其他组, PPV显著高于DLM0、DLM1和DLM2组, 和DLM3、DLM4组没有显著差异。DLM5组FCR显著低于除DLM3组之外的其他组(P<0.05)。
2.2 蛋氨酸水平对异育银鲫幼鱼形体指标的影响
由表4可知, 不同蛋氨酸水平的饲料对异育银鲫幼鱼的肥满度, 脏体比, 肝体比均未产生显著影响。
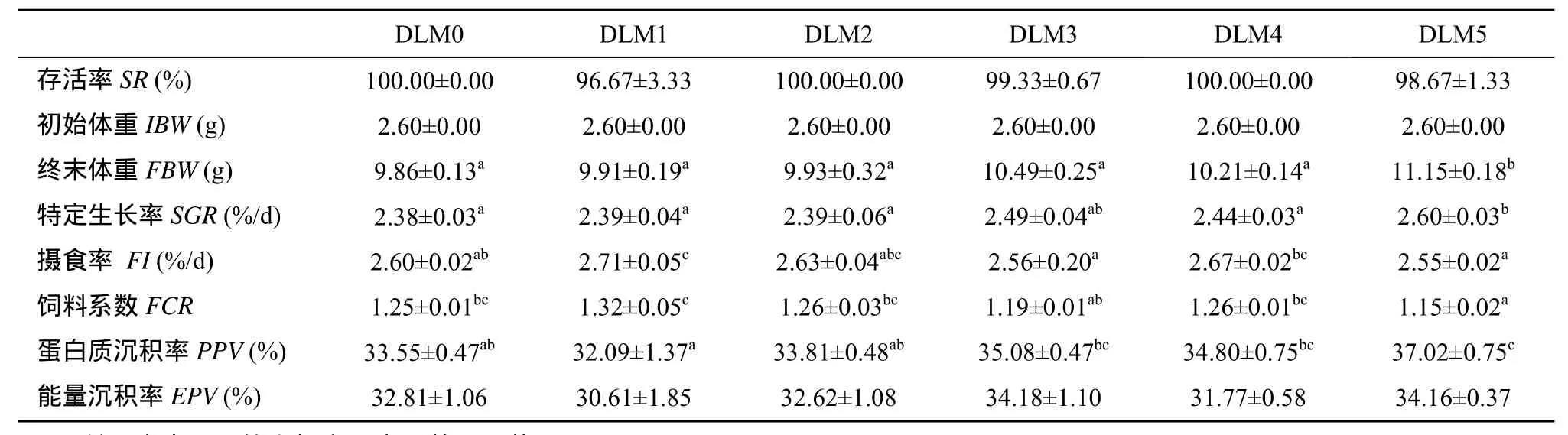
表3 蛋氨酸水平对异育银鲫幼鱼生长性能的影响(平均值±标准误)Tab.3 Effect of dietary methionine levels on the growth performance of juvenile gibel carp (Mean ± SE)
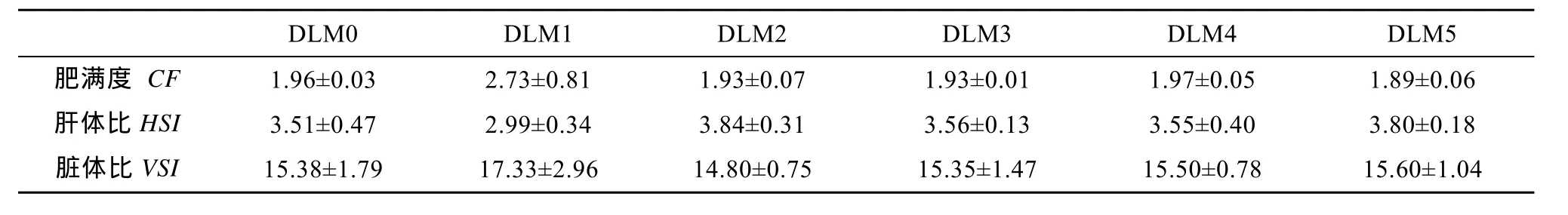
表4 蛋氨酸水平对异育银鲫幼鱼形体指标的影响(平均值±标准误)Tab.4 Effect of dietary methionine levels on morphometric parameters of juvenile gibel carp (Mean ± SE)
2.3 蛋氨酸水平对异育银鲫幼鱼体成分的影响
从表5中可以看出, 各实验组的鱼体粗蛋白质含量均高于对照组, 且DLM4组显著高于对照组(P<0.05)。各实验组鱼体灰分均低于对照组, 且DLM2组显著低于其他各组(P<0.05)。各组鱼体水分、粗脂肪、能量均没有显著差异。
2.4 蛋氨酸水平对异育银鲫幼鱼氨基酸沉积率的影响
由表6可以看出, 随着蛋氨酸水平的增加, 异育银鲫的蛋氨酸沉积率逐渐降低, 其中DLM4组和DLM5组显著低于对照组(P<0.05), 并于DLM4组达到最低蛋氨酸沉积率, DLM5组开始上升。而胱氨酸沉积率随蛋氨酸水平的增高呈现上升趋势。实验组各组谷氨酸沉积率均高于对照组, 且在DLM5组显著高于对照组(P<0.05)。其他各种氨基酸沉积率均无显著差异, 但实验组的氨基酸沉积率均高于对照组,且随着蛋氨酸水平的增加呈上升趋势。
2.5 异育银鲫幼鱼蛋氨酸需求量
通过异育银鲫的特定生长率数据对饲料中蛋氨酸水平进行三次回归分析, 得到特定生长率与蛋氨酸水平的三次多项式关系为y = 7.5494x3−15.436x2+ 10.659x−0.0807(R²= 0.8397)。三次多项式曲线(图1)显示蛋氨酸对促进异育银鲫幼鱼的生长性能还有一定空间。可以预测, 若继续增加饲料中蛋氨酸含量,可能获得更佳的生长性能。
通过折线模型回归分析, 得到蛋氨酸沉积率(Methionine productive value, MPV)对饲料中蛋氨酸含量的关系(图2), 曲线的拐点对应的蛋氨酸含量即为异育银鲫的蛋氨酸需求量。由图2可知, 饲料中胱氨酸含量为0.415%时, 通过蛋氨酸沉积率所得到的异育银鲫蛋氨酸需求量为占饲料干物质的0.89%,或占饲料蛋白的2.17%。

表5 蛋氨酸水平对异育银鲫体成分的影响Tab.5 Effect of dietary methionine levels on body compositions of juvenile gibel carp (Mean ± SE)

表6 蛋氨酸水平对异育银鲫氨基酸沉积率的影响Tab.6 Effect of dietary methionine levels on amino acid retention rate of juvenile gibel carp (Mean ± SE, %)
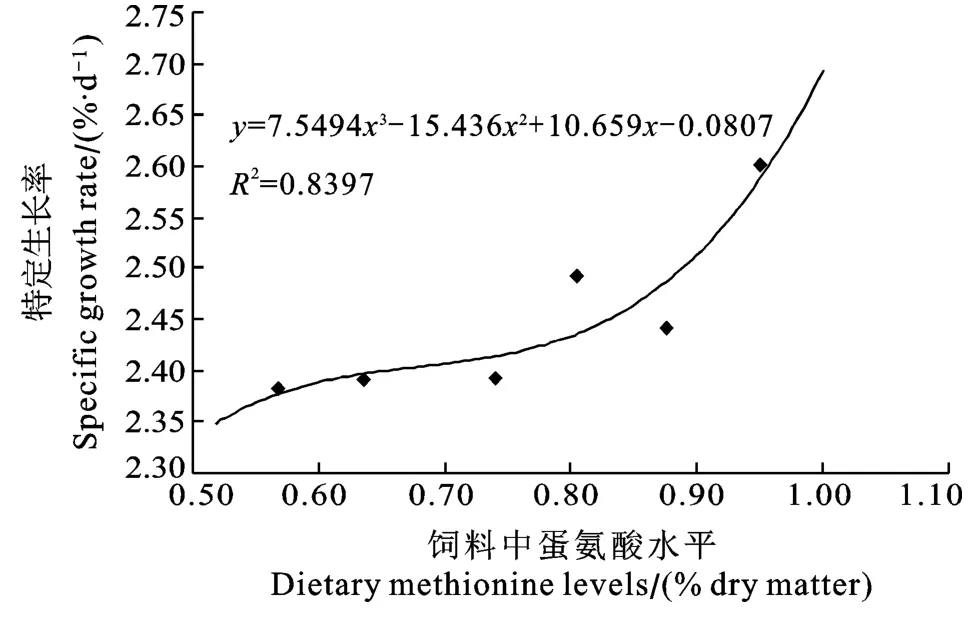
图1 异育银鲫特定生长率与饲料蛋氨酸水平的三次多项式关系Fig.1 Third-order polynomial relationship between SGR of gibel carp and dietary methionine level
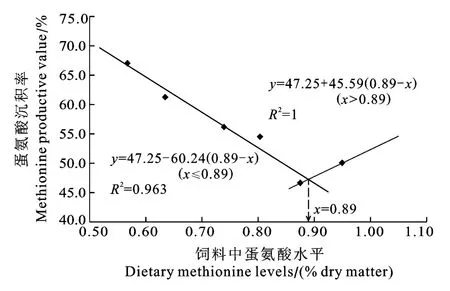
图2 异银鲫蛋氨酸沉积率与饲料蛋氨酸水平的折线关系Fig.2 Break-line relationship between methionine retention rate of gibel carp and dietary methionine level
3 讨论
3.1 蛋氨酸水平对异育银鲫幼鱼生长性能的影响
蛋氨酸是许多鱼类生长的第一限制性氨基酸,尤其当饲料中植物蛋白用量较高时[2,3]。大量研究表明, 在缺乏蛋氨酸的饲料中补充外源晶体蛋氨酸可以显著提高鱼类的生长性能。在南亚野鲮(Labeo rohita H.)上, Sardar, et al.以豆粕作为蛋白源, 在饲料中添加1.16%(占干物质)的DL-蛋氨酸, 显著提高了南亚野鲮的生长性能和蛋白质效率[3]。Eduardo, et al.在细鳞巨脂鲤(Piaractus mesopotamicus)上, 使用豆粕和玉米蛋白粉为主要蛋白源, 添加0.14%(占干物质)晶体DL-蛋氨酸, 显著提高了生长性能和饲料利用效率[2]。林仕梅等在罗非鱼植物蛋白饲料中补充D-蛋氨酸也有类似结果[16]。异育银鲫属于鲤科鱼类, 由于鲤科鱼类没有胃, 肠道排空速度较快, 所以关于其能否有效利用晶体氨基酸一直存在争议[1]。在本实验中, 随着饲料蛋氨酸水平的增加, 特定生长率和相对增重率均逐渐升高, 于DLM3组达到平台期, 并于DLM5组达到最大值, 显著高于对照组(P<0.05)。这表明异育银鲫可以有效利用晶体蛋氨酸, 从而达到促生长的效果。这与目前在其他鲤科鱼类如印度鲮[7]、鲤鱼[8]、草鱼[9]、建鲤[17]、南亚野鲮(Labeo rohita)[18]的研究结果一致。
大量研究表明, 鱼类的生长性能随饲料中蛋氨酸含量的增加呈现出两种不同的变化趋势。一种是随着饲料蛋氨酸含量增加, 鱼类的生长速度相应加快, 一旦饲料中蛋氨酸含量满足了鱼类需求量的时候, 即使提高饲料中蛋氨酸的含量, 鱼类的生长也保持在相对稳定的水平[6,19—21]。另一种则是随饲料中蛋氨酸含量增加鱼类生长速度也提高, 但当饲料蛋氨酸水平超过需求量时, 其生长速度出现下降的现象[10,22]。在本实验中, SGR随着饲料中蛋氨酸含量的增加呈现不断上升的趋势, 若继续增加饲料中蛋氨酸含量, 应该仍旧会促进其生长。造成这一现象的原因这可能是由于异育银鲫幼鱼的生长速度快,对氨基酸需求量较大导致的。目前在鲤科鱼类上,王胜[9]以相对增重率为评价指标, 根据二次回归模型得出当饲料中胱氨酸含量(占干物质)为0.11%时,草鱼对饲料中蛋氨酸需求量为占饲料干物质的1.10%, 占饲料蛋白的2.97%。Ahmed, et al.以相对增重率为评价指标, 采用二次回归模型得出饲料中胱氨酸含量为1%时, 印度鲮的蛋氨酸需求量为占饲料干物质的1%, 占饲料蛋白的2.88%[7]。TANG, et al.以相对增重率为评价指标, 采用二次回归分析得出当饲料中胱氨酸含量为3%时, 幼建鲤的最适蛋氨酸水平为占干物质的1.2%, 占饲料蛋白的3.6%[17]。Scharwz, et al.以末均重为评价指标, 得出鲤鱼饲料中胱氨酸含量为0.42%时, 蛋氨酸需求量为占饲料干物质的0.86%, 饲料蛋白的2.2%[8]。周贤君以半精制饲料为基础, 以特定生长率为评价指标, 采用折线模型得到当饲料中胱氨酸含量为0.42%时, 异育银鲫的蛋氨酸需求量为占饲料的0.69%, 占饲料蛋白的1.68%[15]。不同品种鱼类的蛋氨酸需求量存在差异, 不同研究方法对于同一品种的蛋氨酸需求量也会得到不同的结果。本研究采用实用饲料各组异育银鲫的生长性能显著高于周贤君[15]的结果。半精制饲料适口性差, 相对实用饲料可能低估鱼类营养需求[23]。对各个研究结果整理后发现,大部分水产动物的蛋氨酸需求量在2%—4%(占饲料蛋白)这一范围[24]。本实验通过MPV所得到的结果也印证了这一结论。同时, 与其他鲤科鱼类相比, 如印度鲮2.88%[7]、草鱼2.97%[9]、建鲤3.6%[17]、南亚野鲮2.9%[18](占饲料蛋白), 异育银鲫的蛋氨酸需求量相对较低, 而和鲤鱼的2.2 %[8]的蛋氨酸需求量非常接近。不同鱼类对于蛋氨酸需求量的差异可能是由于不同种属之间的差异[25], 也可能是由于鱼的规格、年龄、水温、投喂策略、养殖密度、 氨基酸模式和饲料中其他营养物的含量, 特别是蛋白源的种类和含量所造成的[21,26,27]。
3.2 蛋氨酸水平对异育银鲫幼鱼蛋白质和氨基酸沉积率的影响
在饲料中添加晶体氨基酸, 改善饲料蛋白质中各种氨基酸的平衡情况, 可以提高蛋白质的生物学效价, 提高饲料中氮的利用率, 减少氮的排泄量。这样既可节省天然蛋白质饲料资源, 又可减轻集约化水产养殖对环境的氮污染问题。蛋白质沉积率不仅反应鱼类蛋白质合成和利用能力, 还能间接反应氮的排放, 是重要的水产养殖环境安全指标。本研究发现, 在饲料中添加DL-蛋氨酸提高了异育银鲫的蛋白质沉积率, 这在鲤鱼[7]、点带石斑鱼[6]、大口黑鲈[11]、黑鲷(Sparus macrocephalus)[28]等也有相同的报道。
水产动物的生长主要是对饲料中蛋白质的积累过程, 蛋白质的积累又是通过氨基酸的合成来实现的。由于氨基酸检测的成本较高, 目前大多数研究较少考虑氨基酸沉积率, 本研究发现在饲料中添加DL-蛋氨酸尽管降低了鱼体蛋氨酸沉积率, 但提高了其他如赖氨酸、精氨酸和苏氨酸等氨基酸的沉积率。并且发现必需氨基酸中蛋氨酸、苏氨酸、组氨酸、赖氨酸、异亮氨酸的沉积率均高于43%, 远大于异育银鲫的蛋白质沉积率。相比之下, 非必需氨基酸的沉积率大多与蛋白质沉积率水平较为接近,甚至低于蛋白质沉积率。这表明异育银鲫幼鱼对于饲料中必需氨基酸的利用率较高, 可以推断异育银鲫幼鱼会优先利用饲料中必需氨基酸来满足其生长需求。高贵琴等使用双低菜籽粕替代饲料中的鱼粉和豆粕实验中发现, 随着双低菜籽粕的替代比例升高, 异育银鲫的必需氨基酸沉积率呈现下降趋势[29]。Luo, et al.在使用大豆浓缩蛋白和晶体氨基酸混合物替代鱼粉的实验中发现, 添加L-蛋氨酸可以显著提高石斑鱼肌肉的必需氨基酸含量[6]。本实验的结果表明, 在使用植物性蛋白源替代鱼粉时添加DL-蛋氨酸可以有效提高必需氨基酸的沉积率, 进而促进异育银鲫的生长。
本研究发现, 随着饲料中DL-蛋氨酸添加量的不断升高, 异育银鲫幼鱼蛋氨酸沉积率出现了先下降后上升的趋势。被消化吸收的蛋氨酸在进入机体后, 一部分参与机体蛋白质的合成, 另外一部分被分解用于供能。研究发现饲料中必需氨基酸在鱼体的沉积率随饲料中氨基酸含量的增加而减少[30]。叶元土指出必需氨基酸的平衡性是配合饲料蛋白质质量的决定性因素之一[31], 王爱民等指出氨基酸平衡饲料对异育银鲫的生产性能具有显著改善作用[32]。在本研究中, 在满足异育银鲫蛋氨酸需求量之前,饲料中的氨基酸比例不平衡, 限制了鱼体蛋白质的合成, 导致摄入的大量蛋氨酸流失浪费, 从而出现随着蛋氨酸添加量增加, 蛋氨酸沉积率下降的现象;而当蛋氨酸的含量满足鱼体需求之后, 饲料氨基酸达到平衡, 鱼体蛋白质合成速度提高, 进而使异育银鲫幼鱼蛋氨酸沉积率出现了上升的趋势。
鱼类对于蛋氨酸的需求量实际上是对于总的含硫氨基酸的需求量[33], 当蛋氨酸被摄入体内, 仅有一部分直接用于合成蛋白质, 而另一部分则转化成胱氨酸参与蛋白质的合成, 因此饲料中胱氨酸能够节约蛋氨酸的比例。目前研究发现饲料中胱氨酸部分替代蛋氨酸的比例为斑点叉尾(Ictalurus punctatus)60%[34]、黄鲈(Perca flavescens)51%[35]、尼罗罗非鱼(Oreochromis niloticus)49%[21]、虹鳟(Oncorhynchus mykiss)42%[36]、美国红鱼(Sciaenops ocellatus)40%[37]、杂交条纹鲈(Morone chrysops×M.saxatilis)40%[38]。在本实验饲料中胱氨酸水平为0.415%(占干物质), 所以异育银鲫幼鱼总含硫氨基酸的需求量为占饲料干物质的1.31%(MPV), 占饲料蛋白的3.19% (MPV)。该结果与周贤君测定异育银鲫蛋氨酸需求量使用的胱氨酸水平一致, 但通过实验得到的蛋氨酸需求量却高于其研究结果(占饲料的0.69%, 占饲料蛋白的1.68%; 总含硫氨基酸需求量为占饲料干物质1.11%, 占饲料蛋白的2.71%;胱氨酸占饲料干物质的0.42%[15]。造成这一结果差异的原因可能是由于饲料配方, 投喂策略, 养殖密度的不同。周贤君采用的饲料为半精制饲料, 适口性较差, 是导致其各组生长性能偏低的原因之一。另外, 有研究表明, 当异育银鲫的日投喂频率为24次时, 获得最大生长速度[39]。周贤君采用每天过量投喂2次的方法进行养殖实验[15], 而本实验采取每日4次饱食投喂的策略。这可能导致其所得到的蛋氨酸需求量相对偏高的原因之一。
3.3 蛋氨酸水平对异育银鲫幼鱼体成分、形体指标的影响
在本实验中, 饲料中蛋氨酸水平对异育银鲫幼鱼的肥满度、脏体比、肝体比均没有产生显著影响, 这与在军曹鱼饲料中添加L-蛋氨酸得到的结果一致[40]。在黑鲷的研究中发现, 饲料中蛋氨酸水平对肥满度没有显著影响, 当蛋氨酸水平高于需求量时, 肝体比有小幅的升高[27]。吉红等的研究表明饲料成分对于鱼体肥满度、肝体比、脏体比影响不大[41], 叶元土等在草鱼饲料中使用豆粕、菜粕等植物性蛋白源替代鱼粉的实验中也发现类似结果[42]。在本实验中,全鱼灰分均低于对照组, 这一现象与Ahmed, et al.在印度鲮上发现的一致[7]。全鱼粗蛋白质含量均高于对照组, 且DLM4组最高, 显著高于对照组(P< 0.05)。这可能是由于在蛋氨酸缺乏的情况下, 饲料中氨基酸不平衡导致鱼体蛋白质合成率下降, 随着蛋氨酸的添加, 饲料中氨基酸达到平衡, 进而促进了鱼体蛋白质合成[43]。在本实验中, 饲料蛋氨酸水平未对全鱼的脂肪和能量产生显著影响, 这与在大黄鱼、军曹鱼、大口黑鲈和黑鲷的研究结果一致[10,11,27,39]。
[1] Wang Y F, Zhou W R, Zhang S Y, et al.Effect of amino acids balance and exogenous enzymes on the growth performance and nitrogenous metabolism of Allogynogenetic crucian carp [J].Jiangsu Journal of Agricultural Sciences, 2010, 26(1): 130—135 [汪益峰, 周维仁, 章世元, 等.氨基酸平衡和外源酶对异育银鲫的生长、氮代谢及血液生化指标的影响.江苏农业学报, 2010, 26(1): 130—135]
[2] Eduardo G A, Gisele C F, Danila C, et al.Dietary supplementation of lysine and/or methionine on performance, nitrogen retention and excretion in pacu Piaractus mesopotamicus reared in cages [J].Aquaculture, 2009, 295: 266—270
[3] Sardar P, Abid M, Randhawa H S, et al.Effect of dietary lysine and methionine supplementation on growth, nutrient utilization, carcass compositions and haemato-biochemical status in Indian Major Carp, Rohu (Labeo rohita H.) fed soy protein-based diet [J].Aquaculture Nutrition, 2009, 15: 339—346
[4] Kasper C S, White M R, Brawn P B.Choline is required by tilapia when methionine is not in excess [J].The Journal of Nutrition, 2000, 130: 238—244
[5] Jonathan B, Goff D M, GATLIN III.Evaluation of different sulfur amino acid compounds in the diet of red drum (Sciaenops ocellatus) and sparing value of cystine for methionine [J].Aquaculture, 2004, 241: 465—477
[6] Luo Z, Liu Y J, Mai K S, et al.Dietary L-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level [J].Aquaculture, 2005, 249: 409—418
[7] Ahmed I, Khan M A, Jafri A K.Dietary methionine requirement of fingerling Indian major carp, Cirrhinus mrigala (Hamilton) [J].Aquaculture International, 2003, 11: 449—462
[8] Schwara F J, Kirchgessner M, Deuringer U.Studies on the methionine requirement of carp (Cyprinus carpio L) [J].Aquaculture, 1998, 161: 121—129
[9] Wang S.Studies on protein and essential amino acid requirements of grass carp, Ctenopharyngodon idella [D].Thesis for Doctor of Science.Sun Yat-Sen University, Guangzhou.2006 [王胜.草鱼幼鱼蛋白质和主要必需氨基酸需求的研究.博士学位论文, 中山大学, 广州.2006]
[10] Mai K S, Wan J L, Ai Q H, et al.Dietary methionine requirement of large yellow croaker, Pseudosciaena crocea R [J].Aquaculture, 2006, 253: 564—572
[11] Chen N S, Ma J Z, Zhou H Y, et al.Assessment of dietary methionine requirement in largemouth bass, Micropterus salmoides [J].Journal of Fisheries of China, 2010, 34(8): 1244—1253 [陈乃松, 马建忠, 周恒永, 等.大口黑鲈对饲料中蛋氨酸需求量的评定.水产学报, 2010, 34(8): 1244—1253]
[12] Xue M, Cui Y B.Effect of several feeding stimulants on diet preference by juvenile gibel carp (Carassius auratus gibelio), fed with diets with or without partial replacement of fish meal by meat and bone meal [J].Aquaculture, 2001, 198: 281—292
[13] Chen J L, Han D, Zhu X M, et al.Dietary lipid sources for gibel carp Carassius auratus gibelio: growth performance, tissue composition and muscle fatty acid profiles [J].Acta Hydrobiologica Sinica, 35(6): 988—997 [陈家林, 韩冬, 朱晓鸣, 等.不同脂肪源对异育银鲫的生长、体组成和肌肉脂肪酸的影响.水生生物学报, 2011, 35(6): 988—997]
[14] Wang J L, Zhu X M, Lei W, et al.Dietary vitamin B6requirement of juvenile gibel carp, Carassius auratus gibelio [J].Acta Hydrobiologica Sinica, 2011, 35(1): 98—104 [王锦林, 朱晓鸣, 雷武, 等.异育银鲫幼鱼对饲料中维生素B6需求量的研究.水生生物学报, 2011, 35(1): 98—104]
[15] Zhou X J.Utilization of dietary crystalline lysine and methionine and the requirements for gibel carp [D].Thesis for Master of Science.Huazhong Agricultural University, Wuhan.2005 [周贤君.异育银鲫对晶体赖氨酸和蛋氨酸的利用及需要量研究.硕士学位论文, 华中农业大学, 武汉, 2005]
[16] Lin S M, Mai K S, Tan B P.Influence of practical diet supplementation the free D-methionine on the growth and body composition in tilapia, Oreochromis niloticus × O.aureus [J].Acta Hydrobiologica Sinica, 2008, 32(5): 741—749 [林仕梅,麦康森, 谭北平.实用饲料中添加结晶蛋氨酸对罗非鱼生长、体组成的影响.水生生物学报, 2008, 32 (5): 741—749]
[17] Tang L, Wang G X, Jiang J, et al.Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp (Cyprinus carpio var.Jian) [J].Aquaculture Nutrition, 2009, 15: 477—483
[18] Murthy H S, Varghese T J.Total sulphur amino acid requirement of the Indian major carp, Labeo rohita (Hamilton) [J].Aquaculture Nutrition, 1998, 4: 61—65
[19] Coloso R M, Murillo-Gurre D P, Borlongan I G, et al.Sulphur amino acid requirement of juvenile Asian sea bass Lates calvarifer [J].Journal of Applied Ichthyology, 1999, 15: 54—58
[20] Alam M S, Teshima M, Ishikawa M, et al.Methionine requirement of juvenile Japanese flounder Paralichthys olivaceus estimated by the oxidation of radioactive methionine [J].Aquaculture Nutrition, 2001, 7: 201—209
[21] Nguyen T N, Davis D A.Methionine requirement in practical diets of juvenile Nile tilapia, Oreochromis niloticus [J].Journal of the World Aquaculture Society, 2009, 40: 410—416
[22] Yan Q, Xie S, Zhu X, et al.Dietary methionine requirement for juvenile rockfish, Sebastes schlegeli [J].Aquaculture Nutrition, 2007, 13: 163—169
[23] Wang L M, Wang J, Xue M, et al.Effects of dietary copper-vitamin C interaction affects the growth performance, copper accumulation in the liver and immune function of Lateolabrax japonicas [J].Chinese Journal of Animal Nutrition, 2011, 23(3): 395—402 [王兰梅, 王嘉, 薛敏, 等.铜和维生素C交互作用对花鲈生长性能、肝脏铜积累量、免疫功能的影响.动物营养学报, 2011, 23(3): 395—402]
[24] Kaushik S J, Seiliez I.Protein and amino acid nutrition and metabolism in fish: current knowledge and future needs [J].Aquaculture Research, 2010, 41: 322—332
[25] Akiyama T, Oohara I, Yamamoto T.Comparison of essential amino acid requirements with A/E ratio among fish species [J].Fisheries Science, 1997, 63: 963—970
[26] Tacon A G J, Cowey C B.Protein and amino acid requirements [A].In: Calow P, Tytler P (Eds.), Fish Energetics: New Perspectives [C].London: Croom Helm.1985, 155—183
[27] Forster I P, Dominy W G.Efficacy of three methionine sources in diets for Pacific white shrimp, Litopenaeus vannamei [J].Journal of the World Aquaculture Society, 2006, 37: 474—480
[28] Zhou F, Xiao J X, Hua Y.Dietary L-methionine requirement of juvenile black sea bream (Sparus macrocephalus) at a constant dietary cystine level [J].Aquaculture Nutrition, 2011, 17: 469—481
[29] Gao G Q, Xiong B X, Zhao Z S, et al.The effect of dietary double-low rapeseed meal protein on essential amino acids deposit rate of Gibel carp and Wuchang fish [J].Freshwater Fisheries, 2004, 34(6): 19—22 [高贵琴, 熊邦喜, 赵振山,等.饲料中双低菜粕蛋白对异育银鲫和团头鲂必需氨基酸沉积率的影响.淡水渔业, 2004, 34(6): 19—22]
[30] Zhao Z S, Lin K J.Effect of formulated feed quality on the deposit rate of essential amino acid in common carp [J].Fisheries Science & Technology Information, 1995, 22(1):10—13 [赵振山, 林可椒.配合饲料品质对鲤鱼体内必需氨基酸沉积率的影响.水产科技情报, 1995, 22(1): 10—13]
[31] Ye Y T.Analysis of development trend and existent problems on limnetic fish nutrition and feed formulating technology (1) [J].Feed China, 2005, 9: 32—34 [叶元土.淡水鱼类营养与饲料配制技术发展趋势与存在问题分析(上).饲料广角, 2005, 9: 32—34]
[32] Wang A M, Li C X, Lv L L, et al.Study on the application of the mode of balance of amino acid in the feed of allogynogenetic crucian carp fingerlings [J].Feed Industry, 2006, 27(16): 24—27 [王爱民, 李朝霞, 吕林兰, 等.氨基酸平衡模式在异育银鲫饲料中的应用研究.饲料工业, 2006, 27(16): 24—27]
[33] Wilson R P.Amino acid requirement of finfish and crustaceans [A].In: D’Mello J P F (Eds.), Amino Acids in Animal Nutrition, 2nded.[C].Oxon: CAB International.2003, 427—447
[34] Harding D E, Allen O W, Wilson R P.Sulfur amino acid requirement of channel catfish: L-methionine and L-cystine [J].Journal of Animal Science, 1977, 107: 2031—2035
[35] Twibell R G, Brown P B.Dietary sulfur amino acid requirement of juvenile yellow perch fed the maximum cystine replacement value for methionine [J].The Journal of Nutrition, 2000, 130: 612—616
[36] Kim K I, Terrence B K, Clyde H A, et al.Requirements for sulfur amino acids and utilization of D-methionine by rainbow trout (Oncorhynchus mykiss) [J].Aquaculture, 1992, 101: 95—103
[37] Moon H Y, Gatlin D M III.Total sulphur amino acid requirement of juvenile red drum Sciaenops ocellatus [J].Aquaculture, 1991, 95: 97—106
[38] Griffin M E, White M R, Brown P B.Total sulfur amino acid requirement and cystein replacement value for juvenile hybrid striped bass (Morone chrysops×M.saxatilis) [J].Comparative Biochemistry and Physiology, 1994, 108A: 423—429 [39] Zhou Z G, Xie S Q, Cui Y B.Study on feeding regime of fishes [J].China Animal Husbandry & Veterinary Medicine, 2003, 30(5): 15—17 [周志刚, 解绶启, 崔亦波.鱼类投喂系统的研究.中国畜牧兽医, 2003, 30(5): 15—17]
[40] Zhou Q C, Wu Z H, Tan B P.Optimal dietary methionine requirement for Juvenile Cobia (Rachycentron canadum) [J].Aquaculture, 2006, 2: 1—7
[41] Ji H, Zhu T H, Zhou J S.Effect of dietary fishmeal amount on growth performance, biological characteristics and serum biochemical parameters in common carp, Cypinus carpio [J].Journal of Northwest A & F University (Natural Science Edition), 2008, 36(7): 33—39 [吉红, 朱天和, 周继术.日粮中鱼粉添加量对鲤鱼种生长、生物学性状及血清生化指标的影响.西北农林科技大学学报, 2008, 36(7): 33—39]
[42] Ye Y T, Cai C F, Jiang R, et al.Effects of fish meal, soybean meal, rapeseed meal, cottonseed meal, peanut meal on the growth and physiology function of grass carp [J].Feed Industry, 2005, 26(12): 17—22 [叶元土, 蔡春峰, 蒋蓉, 等.鱼粉、豆粕、菜粕、棉粕、花生粕对草鱼生长和生理机能的影响.饲料工业, 2005, 26(12): 17—22]
[43] Gerd M B, Bente R, Torbjørn A.Conjugated linoleic acid in diets for juvenile Atlantic salmon (Salmo salar); effects on fish performance, proximate composition, fatty acid and mineral content [J].Aquaculture, 2004, 237: 365—380
EFFECTS OF DIETARY METHIONINE LEVELS ON THE GROWTH PERFORMANCE OF JUVENILE GIBEL CARP (CARASSIUS AURATUS GIBELIO)
JIA Peng1,2, XUE Min2, ZHU Xuan3, LIU Hai-Yan1,WU Xiu-Feng2, WANG Jia2, ZHENG Yin-Hua2and XU Mei-Na2
(1.Life Science College, Hebei Normal University, Shijiazhuang 050024, China; 2.The National Aquatic Feed Safety Assessment Center, Feed Institute Research, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3.Evonik Degussa (China) Co., Ltd., Beijing 100026, China)
Methionine is usually the first limiting amino acid in many fish diets, especially those containing high levels of plant protein sources, such as soybean meal, peanut meal, and cottonseed meal.In the present study, an 8-week growth trial was conducted to evaluate the effects of dietary methionine (Met) levels on growth performance, nutrients retentions of gibel carp (Carassius auratus gibelio) with the initial weight of 2.60 g based on practical diets.Six isonitrogenous (crude protein content 37.22%) and isoenergetic (gross energy 17.61KJ/kg) diets were formulated with different levels of DL-methionine, i.e., 0, 0.08%, 0.16%, 0.24%, 0.32%, 0.40%.The determined Met levels were 0.57%, 0.64%, 0.74%, 0.81%, 0.88% and 0.95% and then defined as DLM0 (basal diet), DLM1, DLM2, DLM3, DLM4, and DLM5, respectively.Fifty fish were batch weighted and put into each tank and each treatment had triplicate tanks.All the experimental fish were stocked in a flow-through system, fed four times a day (9:00, 12:00, 15:00, 18:00).The water temperature fluctuated from 26 to 28°C and dissolved oxygen was maintained at ~7.0 mg/L.The results indicated that specific growth rate (SGR) and protein productive value (PPV) significantly increased with the DL-Methionine supplemented diets (P<0.05), indicating that gibel carp could utilize crystallized DL-Met.Maximum final body weight (FBW, 11.15 g), highest specific growth rate (2.60%/d), and protein productive value (37.02%) were observed in fish fed with diet containing methionine at 0.951% level (DLM5).There were no significantly differences on morphometric parameters and whole body nutrients compositions except crude protein and ash (P>0.05).Whole body crude protein of fish fed with Met supplemented diets were higher than that of the control group, while ash content of the control group was significantly lower than those of all other groups (P<0.05).The methionine productive value (MPV) was reduced with increasing levels of methionine up to 0.876% of diet (DLM4) (P<0.05), and then increased in the DLM5 group.While other essential amino acid productive values increased with the higher methionine levels in diets, a third-order polynomial regression analysis of specific growth rate indicated that the growth performance of juvenile gibel carp might be improved if the methionine levels enhanced subsequently.Broken-line model of MPV indicated that optimum Met level in the diet of juvenile gibel carp was 0.89% of diet (dry matter basis), or 2.17% in terms of dietary protein with cystine level at 0.42%.
Methionine; Carassius auratus gibelio; Growth
S963
A
1000-3207(2013)02-0217-10
10.7541/2013.7
2012-03-15;
2012-12-01
公益性行业(农业)科技专项(201003020; 201203015); 十二五国家科技支撑计划项目(20113AD26B04); 河北师范大学科研基金(L2008B08); 河北师范大学研究生科研基金(201002022)资助
贾鹏(1987—), 男, 河北省邢台人; 硕士研究生; 主要从事水产动物营养与饲料研究。E-mail: alexander6264@hotmail.com
薛敏, 研究员, 硕士生导师; Tel: 010- 82106095; E-mail: xuemin@caas.cn
