青钱柳多糖对高脂血症小鼠脂肪酸合成酶(FAS)表达影响
2013-04-11陈婷婷傅凌韵叶振南王文君
刘 姚,陈婷婷,傅凌韵,叶振南,李 楠,王文君
(江西农业大学 江西省天然产物与功能食品重点实验室,江西 南昌 330045)
脂肪是所有生物生长和发育的重要营养素,能够为机体提供能量,而且是生物膜的重要组成成分。膳食脂肪能够直接或间接对多个基因的表达进行调节,这种营养素基因之间的作用对代谢、生长发育以及细胞分化产生重要的影响。由于脂肪在慢性病的发生和发展过程中发挥了重要的作用,因此阐明膳食脂肪作用于基因组的分子机制对于了解脂肪在人类健康中的作用很重要。
本实验在青钱柳多糖降脂动物实验的基础上,应用分子生物学技术,通过观察青钱柳多糖对实验性高脂血症小鼠肝脏和脂肪组织中与脂代谢相关的基因脂肪酸合成酶(FAS)mRNA和蛋白质表达的影响,旨在探讨青钱柳多糖降血脂的机制。
1 材料与方法
1.1 实验动物
健康雌性昆明种小白鼠,购自南昌大学医学院动物室(合格证号:021-9601)。
1.2 实验试剂
DNA Marker、10×loading buffer、Trizol试剂盒、RT-PCR试剂盒,北京全式金生物技术有限公司;RNase喷雾清除剂,北京百泰克生物技术有限公司;琼脂糖、焦碳酸二乙酯(DEPC),美国Promega公司;Western及IP细胞裂解液100mL、SDS-PAGE凝胶配制试剂盒,碧云天生物技术研究所;考马斯亮蓝蛋白测定试剂盒,南京建成生物工程研究所;脂肪酸合成酶(FAS)(一抗)(兔抗大鼠)(H-300)SC-20140,Santa Cruz公司;小鼠β-actin单克隆抗体(一抗)、辣根过氧化物酶标记山羊抗兔IgG(二抗)、辣根过氧化物酶标记山羊抗小鼠IgG(二抗)北京中杉生物公司;PVDF膜,美国Mllipore公司。
1.3 实验仪器
高温电热干燥箱(UFE500),Memmert公司;Centrifuge高速冷冻离心机,德国Eppendorf公司;电泳仪,Bio-Rad公司;凝胶成像系统,英国SynGene公司;超微量紫外分光光度计、酶标仪,Thermo公司;PTC-200 PCR仪、电泳仪、垂直电泳槽,Bio-Rad公司。
1.4 实验方法
1.4.1 建立高脂血症小鼠模型 选择健康昆明种小鼠200只,体质量18~22 g,正常适应性饲养1周,期间自由饮水饮食,饲养温度为(20±2)℃,相对湿度(60±5)%,光照时间(12 h/12 h)。其中12只作为空白对照组,每日灌喂等体积的无菌水;将高脂小鼠平均分成6组,分别为高血脂模型对照组,辛伐他汀阳性对照组,辛伐他汀+青钱柳多糖中剂量组,青钱柳多糖低剂量组,青钱柳多糖中剂量组,青钱柳多糖高剂量组[1]。实验结束后,取各小鼠肝脏、脂肪组织于-80℃保存备用。
1.4.2 肝脏和脂肪组织FAS mRNA表达 组织中mRNA的表达采用半定量PCR法检测。根据Gen-Bank FAS基因(GenBank accession No.NM-007987)和 β -actin基因(GenBank accession No.NM-007393)设计FAS和β-actin引物。FAS上游引物:5'-CATCCAAGACACAGCTGAGCA -3',FAS下游引物:5'-CCAGGAGTTGCCAATGTCAA -3';β-actin上游引物:5'-CAGGGTGTGATGGTGGGAA-3',β-actin下游引物:5'-CGGTTGGCCTTAGGGTTC A-3'。参照试剂盒说明书,反应体系为25μL,含上游引物(10 μM)0.5μL,下游引物(10 μM)0.5μL,2×TransTaqTM PCR SuperMix Ⅱ 12.5μL,cDNA 1μL,ddH2O 至终体积 25μL。PCR 反应程序为:95 ℃预变性 3min,59.3 ℃退火30 s,72 ℃ 延伸 40 s,1 cycle;94 ℃变性30 s,59.3 ℃退火30 s,72 ℃延伸40 s,30 cycles;94 ℃变性30 s,59.3 ℃退火30 s,72℃延伸10min,1 cycle;4℃,2 h。PCR反应结束后,取各组织FAS、β-actin PCR产物,上样于质量分数1%琼脂糖凝胶(含0.05%EB),1×TAE电泳缓冲液,160 V电泳15min,紫外灯下观察,凝胶成像分析系统(SynGene)拍照。
1.4.3 肝脏和脂肪组织FAS蛋白表达 按照Western及IP细胞裂解液试剂盒说明书,提取肝脏和脂肪组织中的总蛋白,考马斯亮蓝法测定总蛋白浓度,调整到同一水平,采用不连续电压进行电泳;电泳结束后,用考马斯亮蓝检测蛋白质的完整性;采用半干电转移法转膜,抗体检测并显色,将PVDF膜吸干,拍照封存。
1.5 统计分析
用凝胶图像分析软件(Gene Tools Analysis)进行光密度扫描半定量分析。计算FAS mRNA和蛋白的相对密度比值。采用DPS统计软件进行分析与显著性检测。
2 结果与分析
2.1 小鼠肝脏和脂肪组织总RNA提取

图1 组织总RNA提取结果Fig.1 Results of tissue total RNA

图2 总蛋白Fig.2 The total Protein
所提取的小鼠肝脏和脂肪组织总RNA经紫外分析,每组样品 OD260/OD280比值在 1.8 ~2.0,说明提取的总RNA中没有蛋白质等大分子污染;由图1电泳分析每组均可见18 S和28 S两条较深的电泳条带,表明所提的组织总RNA纯度符合分析要求。组织总蛋白凝胶电泳如图2所示,蛋白条带浓度均一并且数量基本一致,表明提取蛋白未发生降解,完整性较好符合下一步试验要求。

图3 肝脏组织中FAS mRNA表达的RT-PCR电泳Fig.3 The RT-PCR result of the expression of FAS mRNA in liver

表1 青钱柳多糖对肝脏和脂肪组织中FAS mRNA表达的影响Tab.1 Effect of Cyclocarya paliurus(Batal)Iljinskaja polysaccharide on the expression of FAS mRNA in liver and adipose
2.2 青钱柳多糖对实验性高脂血症小鼠肝脏和脂肪组织脂肪酸合成酶(FAS)mRNA表达的影响
由图3可知,以空白对照组小鼠组织FAS mRNA表达光密度值设为1作参考,各组小鼠肝脏组织FAS mRNA表达相对光密度值(表1)分别为:模型组与空白组相比,FAS mRNA表达水平上升0.5%,差异不显著;给药各组(辛伐他汀组、辛+中剂量组、低剂量组、中剂量组、高剂量组)与空白组相比,FAS mRNA 表达水平下降10.9%、12%、3.4%、7.7%、16.9%,差异不显著。实验结果表明,给药组均能轻微抑制小鼠肝脏组织中FAS mRNA表达,其中多糖高剂量组抑制效果最佳,优于辛伐他汀+中剂量组。各组小鼠脂肪组织FAS mRNA表达相对光密度值分别为:模型对照组与空白对照组相比,下降28.1%,FAS mRNA表达水平差异不显著;给药各组(辛伐他汀组、辛+中剂量组、低剂量组、中剂量组、高剂量组)与空白对照组相比,分别下降 19.8%、14.7%、19.4%、上升 19.5%、6.2%,FAS mRNA 表达水平差异不显著。
2.3 青钱柳多糖对实验性高脂血症小鼠肝脏和脂肪组织脂肪酸合成酶(FAS)蛋白表达的影响
由图4可知,以空白对照组小鼠肝脏和脂肪组织FAS蛋白表达光密度值设为1作参考,各组小鼠肝脏组织FAS蛋白表达相对光密度值(表2)分别为:模型组与空白组相比,FAS蛋白表达水平上升53.8%,差异极显著(P<0.01);青钱柳多糖高剂量组与空白组相比,FAS蛋白表达差异不显著(P>0.05),但与高脂模型组FAS蛋白表达水平相比显著下降,差异极显著(P<0.01)。高脂模型组小鼠在高脂饮食诱导下,其肝脏FAS蛋白表达明显上升,给药组相比高脂模型组均能抑制小鼠肝脏组织中FAS蛋白表达,其中多糖高剂量组抑制效果最佳。各组小鼠脂肪组织FAS蛋白表达相对光密度值分别为:模型对照组与空白对照组相比,上升17.9%,FAS蛋白表达水平差异不显著(P>0.05);给药各组(除低剂量组外)与空白对照组相比FAS蛋白表达水平均有一定程度的下降,但差异不显著(P>0.05)。实验结果表明,辛伐他汀组、辛伐他汀+中剂量组、青钱柳高、中剂量组均能轻微下调小鼠脂肪组织FAS蛋白表达水平,但差异不显著。

图4 脂肪组织中FAS基因蛋白质表达Fig.4 Result of the expression of FAS protein in adipose
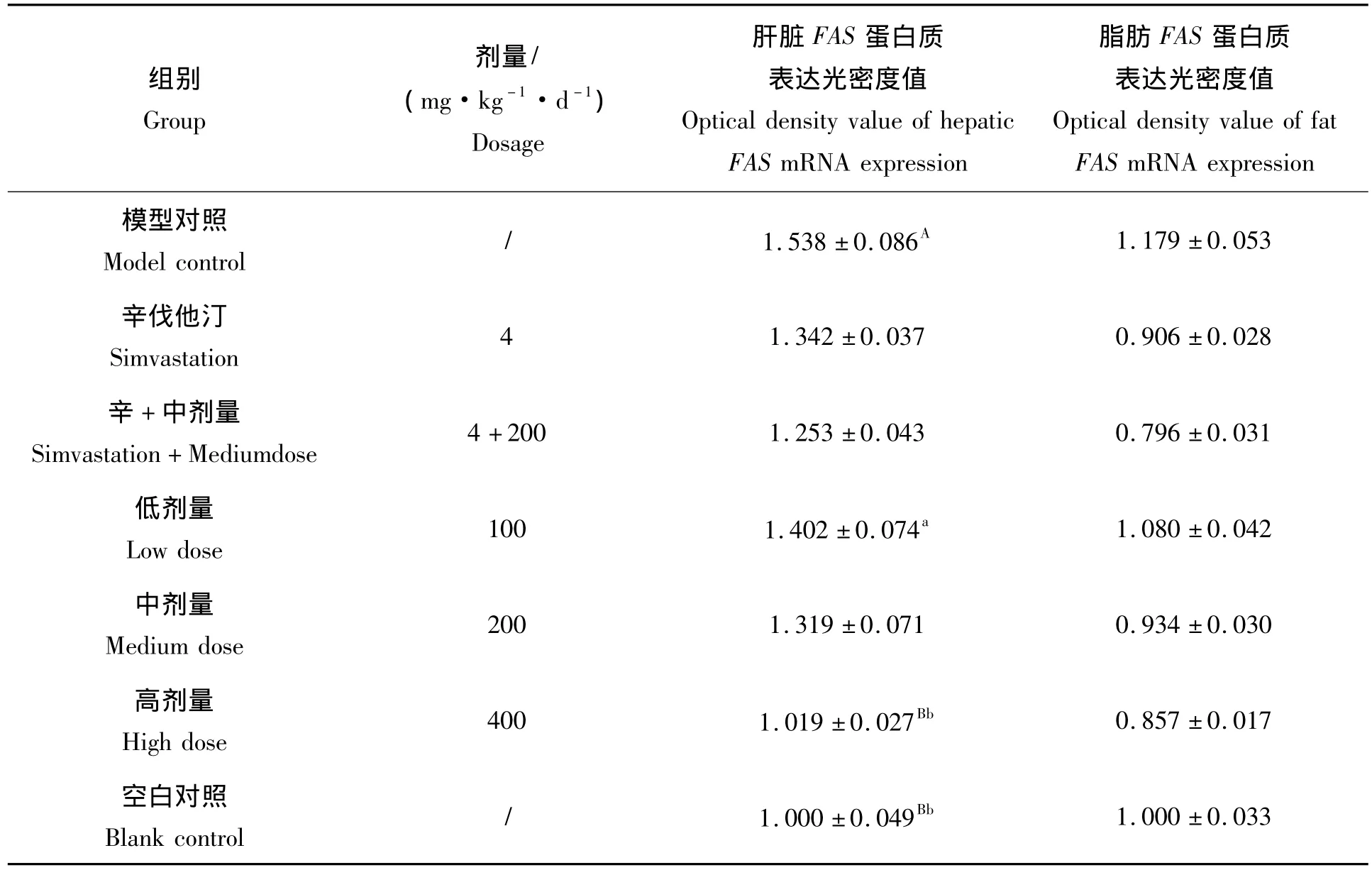
表2 青钱柳多糖对肝脏和脂肪组织中FAS蛋白质表达的影响Tab.2 Effect of Cyclocarya paliurus(Batal)Iljinskaja polysaccharide on the expression of FAS protein in liver and adipose
3 讨论与结论
脂肪酸合成酶(FAS)由乙酰基转移酶(AT)、丙二酰基转移酶(MT)、β-酮脂酰合酶(KS)、β-酮脂酰还原酶(KR)、β-羟脂酰脱水酶(HD)、烯脂酰还原酶(ER)及硫酯酶(TE)等7个功能域所组成,可分为I型和Ⅱ型两种亚型。细菌和植物中的FAS属Ⅱ型,人类及其他哺乳类动物的FAS属I型,两种亚型都是由包括以上7个功能域组成的一个单链多功能酶,为单基因所编码,相对分子质量为250 ku[2]。脂肪酸合成酶(FAS)是生物体内源性脂肪酸合成过程的关键酶,它通过催化乙酰辅酶A和丙二酰辅酶A而生成长链脂肪酸[3],FAS基因的表达直接影响着脂肪酸合成酶的多寡。FAS基因在多种组织和器官中都有表达,其中在肝脏,肺脏和腹腔脂肪组织中表达较高。在正常的生理状态下,饮食和激素可调节FAS的表达和含量[4-5]。近年来,对脂肪酸生物合成途经进行了大量研究,初步阐明了脂肪酸合成规律和脂肪酸合成酶在动物体脂生成、沉积中发挥重要作用[6]。
脂肪酸合成酶(FAS)作为细胞脂肪代谢的主要的酶,参与了很多疾病的发生和发展。Loftus等[7]给小鼠腹腔注射FAS抑制剂,能降低小鼠食欲、减少能量摄入,显著减轻小鼠体重,说明FAS与脂肪调控之间存在重要联系。曾凡勇等[8]探讨了高脂饮食诱导下肥胖易感(OP)与肥胖抗性(OR)大鼠白色脂肪组织中脂肪酸合成酶的表达差异,发现OP与OR大鼠的白色脂肪组织中存在FAS基因表达差异,其差异与大鼠发生肥胖的易感程度有关。在普洱茶的降脂减肥的作用机理方面,Chiang CT等[9]报道,灌喂普洱茶的大鼠肝脏内脂肪酸合成酶的表达量得到显著抑制,人肝肿瘤HepG2细胞在加入普洱茶提取物后,在蛋白和mRNA水平上,脂肪酸合成酶表达都得到抑制。孙悦等[10]在高甘油三酯高血糖血症大鼠脂糖代谢相关酶活性变化的实验研究中得出模型组动物肝中FAS活性显著升高,提示FAS活性升高可能是模型动物出现高甘油三酯高血糖血症的原因之一。本研究也发现,青钱柳多糖具有抑制高脂血症小鼠不同组织中FAS mRNA的丰度。但青钱柳多糖对肝脏和脂肪组织中FAS mRNA表达的影响不显著,其可能原因是试验中所给的多糖剂量少;或者是在试验后期小鼠的体重变化较小有关。
卢辰等[11]在研究脂肪酸合成酶在糖尿病SD大鼠视网膜中的表达情况时发现,糖尿病组大鼠视网膜FAS的mRNA和蛋白质表达水平比对照组明显增高,说明FAS在糖尿病视网膜病变形成过程中可能有重要作用,如果能在糖尿病视网膜病变背景期通过抑制FAS的表达,就可能在一定程度上减缓糖尿病的发展,为脂肪酸合成酶在糖尿病发病机制中的作用提供基因表达和免疫组织化学方面证据。Kuo等[12]发现普洱茶提取物能抑制HepG2细胞FAS蛋白表达,PI3K抑制剂和JNK抑制剂也能抑制FAS蛋白表达,推测作用可能是通过下调PI3K/Akt和JNK信号途径实现的。他们还发现绿茶提取物虽然能显著抑制肝脏FAS mRNA表达,但对FAS蛋白水平无显著作用。这表明对FAS的调节可能是转录后水平。袁华兵等[13]发现普洱茶提取物能适度下调脂肪组织FAS mRNA表达,抑制脂肪合成,减少脂肪量。
本实验采用Western Blot方法研究不同剂量青钱柳多糖对实验性高脂血症小鼠肝脏组织,脂肪组织中FAS基因蛋白质表达的影响,发现高脂饮食诱导的模型组小鼠肝脏、脂肪组织中FAS蛋白水平均上升,青钱柳多糖均能抑制小鼠肝脏组织和脂肪组织中FAS蛋白表达水平,但青钱柳多糖调节小鼠肝脏和脂肪组织中FAS蛋白表达水平呈现一定的差异性,推测可能与肝脏和脂肪组织中FAS活性相关,进而反馈为FAS蛋白表达水平上的差异。Clarke[14]研究发现,饲喂高蛋白日粮可降低脂肪组织脂肪酸合成酶的mRNA的数量,但不影响肝脏组织脂肪酸合成酶的mRNA数量,这就会使体脂肪的沉积减少,这与本研究结果类似;同时,也可能是由于RNA稳性差,易降解,从而导致RNA表达降低,而蛋白表达并没有发生变化所致。杨钦河等[15]探讨了疏肝健脾方药对非酒精性脂肪性肝病(NAFLD)大鼠肝组织脂肪酸合成酶(FAS)mRNA及蛋白表达的影响。结果显示,与模型组相比,各用药组FAS mRNA表达水平和FAS蛋白表达水平均有下降。表明疏肝健脾方药可能通过降低FAS mRNA及蛋白表达水平而改善NAFLD大鼠肝脏脂质代谢紊乱,减轻肝损伤。
青钱柳是我国一种特有的珍稀植物,前期实验研究结果表明,青钱柳多糖具有一定的降血脂和降血糖作用,但对于其作用机理的探讨较少。本研究初步发现,青钱柳多糖具有抑制高脂血症小鼠FAS基因和蛋白质表达的作用,但对其他与脂质代谢相关基因表达的影响并未作探讨,这有待深入的研究,以揭示青钱柳降血脂的分子机制。
[1]黄明圈,上官新晨,徐明生,等.青钱柳多糖降血脂作用的研究[J].江西农业大学学报,2011,33(1):157-161.
[2]Smith S.The animal fatty acid synthase:one gene,one polypeptide,seven enzymes[J].FASEB J,1994,8(15):1248 -1259.
[3]Simith S,Wikowski A,Joshi A K.Structural and functional organization of the animal fatty acid synthase[J].Progress in Lipid Research.2003,40:289 -317 .
[4]Chirala S S,Wakil S J.Structure and function of animal fatty acid synthase[J].Lipids,2004,39(11):1045 -1053.
[5]Rosebrough R W,Poch S M.Dietary protein regulates in vitro lipogenesis and lipogenic gene expression in broilers[J].Comparative Biochemistry and Physiology.Part A,2002,132:423 -431.
[6]Wakil S J,Porter J W,Gibson D M.Studies on the mechanism of fatty acid synthesis.I.Preparation and purification of an enzymes system forreconstruction of fatty acid synthase[J].Biochimica et Biophysica Acta,1957,24(3):453 -461.
[7]Loftus T M,Jaworsky D E,Frehywot G L,et al.Reduced food intake and body weight in mice treated with fatty acid synthase inhibitors[J].Science,2000,288(5475):2379 -2381.
[8]曾凡勇,秦锐,郭锡熔.脂肪酸合成酶在高脂饮食诱导的肥胖易感和肥胖抗性大鼠白色脂肪组织中的表达差异[J].临床儿科杂志,2007,1(25):54 -57.
[9]Chiang C T,Weng M S,Lin-shiau S Y,et al.Pu-erh tea supplementation suppresses fatty acid synthase expression in the rat liver through down regulating Akt and JNK signals as demonstrated in human hepatoma HepG2 cells[J].Oncology Research.2005,16(3):119 -128.
[10]马慧敏,刘昌奇.脂肪酸合成酶(FAS)基因的研究进展以及日粮成分对其表达的调控[J].饲料工业,2007,28(22):59-64.
[11]卢辰,李华,刘源劫,等.糖尿病大鼠视网膜脂肪酸合成酶表达水平的研究[J].四川解剖学杂志,2007,l5(1):38-41.
[12]Kuo K L,Wang M S,Chiang C T,et al.Comparative studies on the hypolipidemic and growth suppressive effects of oolong,black,Pu-erh,and green tea leaves in rats[J].Journal of Agriculture and Food Chemistry,2005,53:480 -489.
[13]袁华兵,钟婕,易娟,等.普洱茶提取物对饮食诱导肥胖大鼠脂质合成相关基因表达的影响[J].营养学报,2009,31(2):167 -171,176.
[14]Clarke S D.Regulation of fatty acid synthase gene expression:An approach for reducing fat accumulation[J].Journal of Animal Science,1993,71:1957 -1965.
[15]杨钦河,顾常霖,陈同炎,等.疏肝健脾方药对非酒精性脂肪性肝病大鼠肝组织脂肪酸合成酶mRNA及蛋白表达的影响[J].中华中医药杂志,2011,26(4):843 -846.
