脂肪酸合成酶基因多态性与诱导性高血脂症小鼠血脂性状的相关性分析
2013-04-11王文君陈婷婷叶振南傅凌韵
王文君,刘 姚,陈婷婷,叶振南,傅凌韵
(江西农业大学 江西省天然产物与功能食品重点实验室,江西 南昌 330045)
随着人们生活水平的不断提高和饮食结构的改变,高血脂症悄然地挤身于富贵文明病行列当中,严重者发展为心脑血管方面的疾病[1]。进一步的研究表明,个体遗传背景的不同可能会导致部分个体对引起高脂血症的某些环境因素(如饮食)更加易感,高脂血症的发生是营养素与基因相互作用的结果。膳食对高脂血症的影响可通过影响相关基因表达,包括基因转录和翻译后修饰的影响而实现,但人们高度重视该过程的具体调控细节还不清楚[2]。通过营养与遗传基因互作的研究可加深对慢性疾病更深层次的认识[3]。
脂肪酸合成酶(FAS)是一个由单基因编码多肽的单链多功能酶,包括丙二酰基转移酶(MT)、β-酮脂酰合酶(KS)、β-酮脂酰还原酶(KR)、乙酰基转移酶(AT)、β-羟脂酰脱水酶(HD)、烯脂酰还原酶(ER)及硫酯酶(TE)等7个功能域,它可分为I型和Ⅱ型两种亚型。人类及其他哺乳类动物的FAS属I型,是由包括以上7个功能域组成,相对分子质量为250 ku[4]。FAS是生物体内源性脂肪酸合成过程的关键酶,它通过催化乙酰辅酶A和丙二酰辅酶A而生成长链脂肪酸[5],FAS基因的表达直接影响着脂肪酸合成酶的多寡。
FAS基因在多种组织和器官中都有表达,其中在肝脏、肺脏和腹腔脂肪组织中表达较高。其功能是将碳水化合物合成脂肪酸,以甘油三酯的形式储存。在正常的生理状态下,环境因素如饮食和激素可调节FAS的表达和含量。碳水化合物的摄取,甲状腺、胰岛素、糖皮质激素均可提高FAS的表达和脂肪酸合成,而不饱和脂肪酸、cAMP、胰高血糖素则会下调FAS和脂肪酸合成[6]。为了探讨环境因素(如饮食)和基因互相作用对个体的影响,本文研究了FAS基因多态与高脂乳剂互作对昆明种小鼠与脂质代谢相关性状的影响。
1 材料与方法
1.1 材料
高脂乳剂(胆固醇10%,猪油89%,胆酸钠1%,适量吐温-80,高速组织匀浆机捣碎);120只2月龄昆明种小鼠(江西医学院动物实验部提供,合格证号:021-9601)。
1.2 方法
1.2.1 动物实验 小鼠适应性饲养1周,期间自由饮水饮食,饲养室温度为(23±2)℃,相对湿度(55±5)%,光照时间(12 hr/24 hr),于第7天(D0)测定基础血脂指标总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、游离脂肪酸(FFA)和脂肪酶(LPS)。随后取20只小鼠作为对照组,只喂基础日粮;另外200只作为试验组,采取灌胃法,每日对小鼠灌喂适量高脂乳剂,连续一个月后(D30),测定血脂指标(TC、TG、HDL、LDL、FFA、LPS),比较对照组和试验组TC值,发现两组TC值差异显著(结果未列出),证明高血脂小鼠建模成功。采集小鼠尾组织,浸泡于体积分数为75%乙醇,-70℃保存备用。采集小鼠心、肝、脾、肾、肺,脂肪并称重。
1.2.2 血脂性状的测定 小鼠空腹眼眶静脉采血后收集血浆于离心管中,4℃,3500 rpm离心10min,分离血清。除立即检测指标外,其余血清样品分装于1.5mL EP管中,-20℃冰箱冷贮待检相关生化指标。TC含量测定采用酶比色法,参照总胆固醇试剂盒(CHO)测定方法;TG含量测定采用酶比色法,参照甘油三脂试剂盒(TG)测定方法;LDL-C含量测定采用聚乙烯硫酸沉淀法,参照低密度脂蛋白胆固醇试剂盒(LDL-C)测定方法;HDL-C含量测定采用磷钨酸-镁沉淀法,参照高密度脂蛋白胆固醇试剂盒(HDL-C)测定方法;NFFA含量测定采用比色法,参照游离脂肪酸测试盒(NFFA)测定方法;LPS含量测定采用比色法,参照脂肪酶测试盒(LPS)测定方法。所有试剂盒都购自中生北控生物科技股份有限公司。
1.2.3 基因组DNA的提取 于小鼠尾组织提取基因组DNA,提取方法参照实验室此前建立的方法[7]。
1.2.4 PCR-RFLP 过程 (1)引物:引物设计根据 FAS 序列(GenBank accession No.ref|NT_039687.7),采用DNAman(version 3.0)设计引物,所扩增的目的片段长度550 bp(GenBank accession ref NT_039687.7),引物由上海生工合成,序列为:
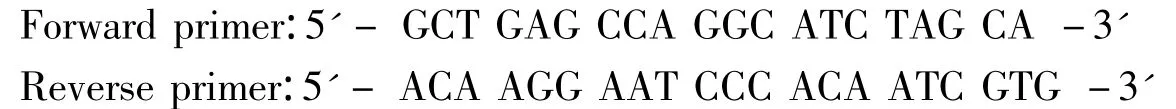
(2)PCR 扩增:25μL PCR 扩增体系为:灭菌双蒸水17.7μL,10 ×PCR buffer(含 MgCl2)2.5μL,2mmol/L dNTPs 1.8μL,引物1.0μL,5 U/μL Taq 酶1.0μL,DNA 模板1.0μL。PCR 程序为:94 ℃ 5min;94 ℃变性45 s,59.7℃退火45 s;延伸72℃ 45 s,共36个循环;72℃延伸8min,4℃保存。PCR产物在质量分数2%琼脂糖凝胶中电泳,紫外透射仪检测结果。
(3)PCR 产物的酶切:取8μL PCR 产物,加入0.3μL 限制性内切酶 Af1Ⅱ,0.6μL 10 ×Loading buffer,补足超纯水至终体积为15μL,37℃温浴5~7 h或过夜。
酶切产物的电泳检测:向每管反应体系中加2μL酶试剂盒附带的10×Loading buffer,混匀,于2.5%琼脂糖凝胶电泳。紫外透照台观察结果并在凝胶成像系统中拍照保存。
1.2.5 数据统计分析 采用x2检验分析了在所试群体中基因型频率分布是否处于Hardy-Weinberg平衡。并采用下列固定模型进行基因型与血脂性状的相关性分析

式中:Yij是个体的观察值,μ是群体的均值,Gi基因型的估计效应,eij是残差效应。采用SAS统计软件(version 6.01)中的LSM法进行基因型与性状的相关分析,并采用Duncan’s法进行多重比较。
2 结果
2.1 PCR-RFLP 分析结果
用所设计的引物以基因组DNA为模板进行PCR特异性扩增获得了较好的结果,片段长度(图1)与预期大小一致,且没有非特异性条带。根据NCBI网站(http://www.ncbi.nlm.nih.gov)已知的小鼠SNP数据库(rs52586864 mouse FAS)可知,27486082处有一个突变(T→C),该突变存在Af1Ⅱ酶切位点,可以进行RFLP分析。将PCR产物进行RFLP分析,产生T/T、T/C和C/C 3种基因型(图2)。

图1 PCR扩增结果Fig.1 Results of PCR
2.2 不同基因型与血脂水平的关联性分析
经统计,在所分析的200只小鼠群体中,CC基因型小鼠145只,占72.5%,CT基因型小鼠44只,占22%,TT基因型小鼠11只,占5.5%(表1);C等位基因的频率为83.5%,T等位基因的频率为16.5%。x2检验分析表明,基因型频率分布显著偏离Hardy-Weinberg平衡(x2=68.41>x20.01=9.21,P <0.01)
在对血脂性状的相关性影响的统计分析表明,不同基因型对血液中TC、TG、LDL、HDL、FFA和LPS浓度的影响存在一定的差异(表1)。D0天,3种基因型小鼠的TC和TG水平均不存在差异,但在D30天,TT基因型小鼠的TC和TG水平均高于CC基因型,差异显著(P<0.05);LDL-C的水平在饲喂高脂日粮后均没有3种基因型间均不存在显著差异,但TT基因型小鼠的LDL-C水平仍高于CC基因型小鼠。相反,在对HDL的影响中,D0天,CC基因型小鼠的HDL水平高于CT和TT基因型,但无显著性差异;D30天,CC和CT基因型小鼠的HDL水平高于TT基因型的小鼠,差异显著(P<0.05)。而不同基因型在D30天对血清FFA也有显著的影响,其中CC基因型小鼠血清FFA水平显著低于CT和TT基因型,差异极显著(P<0.01);但不同基因型对脂肪酶的活性影响不显著。
2.3 不同基因型对小鼠各器官性状的影响
由于患高血脂症可能会导致其他并发症的产生,为此,分析了不同基因型对体重、心/体重、肝/体重脾/体重、肾/体重、肺/体重的比值的影响(表2)。从表2中可以发现,不同基因型对体重、肝重、肝重/体重、脾重、脾重/体重、肾重、肾/体重、肺重、肺/体重的影响差异不显著(P>0.05);而不同基因型却可显著影响心重(P<0.05)和心重/体重的比值(P<0.01);脂肪重和脂肪重/体重(P<0.05),其中以CC基因型的最小。这些结果也提示了在对脂肪的代谢中,肝脏是一个重要的器官,同时体脂的沉积,也会影响心脏的重量。
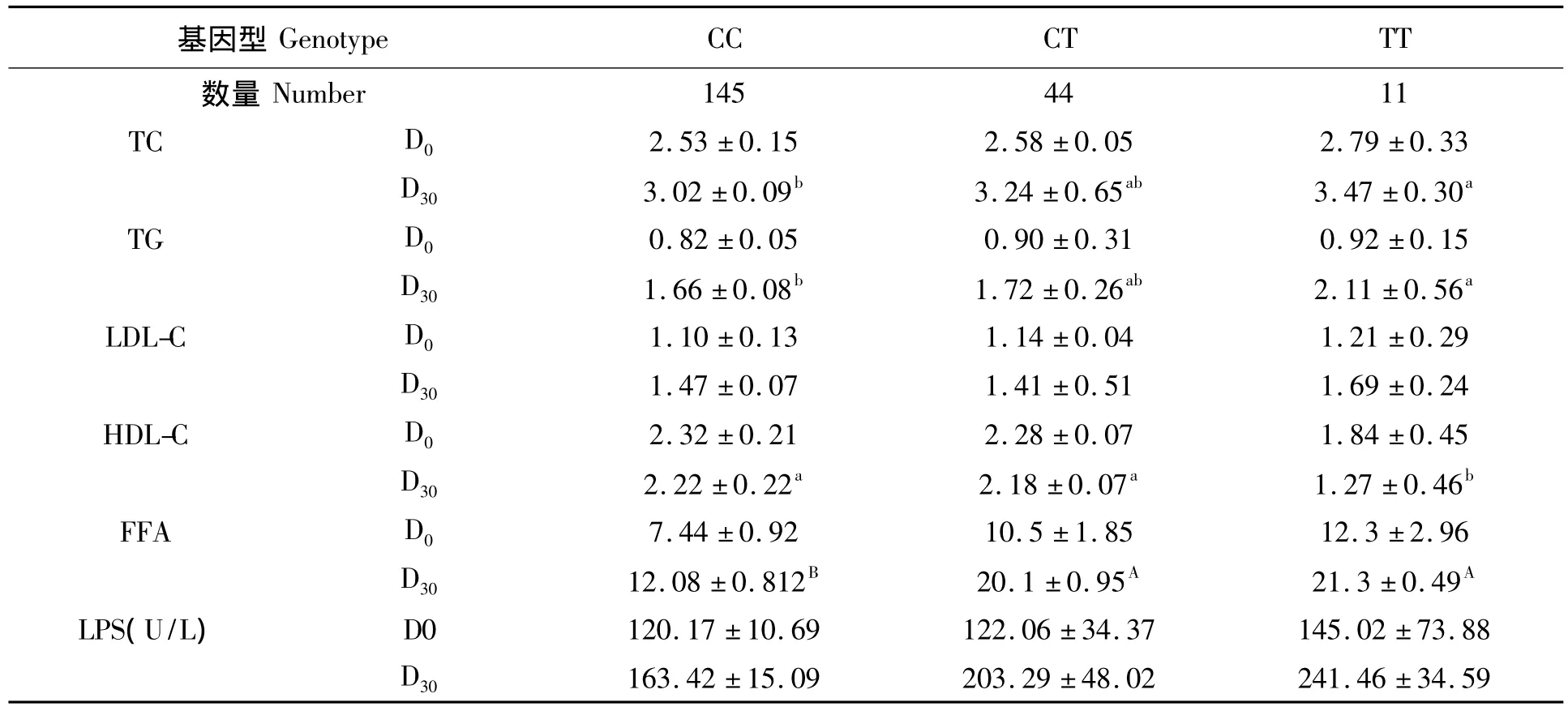
表1 小鼠FAS基因不同PCR-RFLP-Af1Ⅱ(FAS)基因型对血脂水平的影响(mmol/L)Tab.1 Effect of FAS PCR-RFLP-Af1Ⅱ genotype on the blood fat level

表2 小鼠FAS基因不同PCR-RFLP-Af1Ⅱ(FAS)基因型对各器官的影响Tab.2 Effect of FAS PCR-RFLP-Af1Ⅱ genotype on the organs
3 讨论
本研究以高脂乳剂喂养正常小鼠,拟使其患高血脂症。喂养1个月后,与对照组相比,试验组TC值显著升高。以FAS基因作为小鼠血脂水平和部分器官性状的候选基因,在27486082 bp处发现C→T的突变,检测到2种等位基因(T和C),3种基因型(TT、TC和CC),其中TC和TT为突变基因型。
脂肪酸合成酶(FAS)作为细胞脂肪代谢的主要的酶,参与了很多疾病的发生和发展。Loftus等[8]给小鼠腹腔注射FAS抑制剂,能降低小鼠食欲、减少能量摄入,显著减轻小鼠体重,说明FAS与脂肪调控之间存在重要联系。曾凡勇等[9]探讨高脂饮食诱导下肥胖易感(OP)与肥胖抗性(OR)大鼠白色脂肪组织中脂肪酸合成酶的表达差异,发现OP与OR大鼠的白色脂肪组织中存在FAS基因表达差异,其差异与大鼠发生肥胖的易感程度有关。在普洱茶的降脂减肥的作用机理方面,Chiang等[10]报道,灌喂普洱茶的大鼠肝脏内脂肪酸合成酶的表达量得到显著抑制,人肝肿瘤HepG2细胞在加入普洱茶提取物后,在蛋白和mRNA水平上,脂肪酸合成酶表达都得到抑制。孙悦等[11]在高甘油三酯高血糖血症大鼠脂糖代谢相关酶活性变化的实验研究中得出模型组动物肝中FAS活性显著升高,提示FAS活性升高可能是模型动物出现高甘油三酯高血糖血症的原因之一。倪红玉等[12]探讨了不同油脂对肉仔鸡脂类代谢及相关基因的表达,结果发现,不同油脂可以影响FAS mRNA的表达,同时对血清脂肪酶的活性产生影响。
Roy等[13]研究了FAS基因的多态性及其与牛乳脂含量的关系,发现在外显子1处的G到C的颠换(g.763G>C)可改变一个潜在的sp1转录因子结合位点;在外显子34处的A到G的转换(g.16009A>G),从而导致了一个非保守的丙氨酸突变为苏氨酸。进而研究发现这两个SNPs在具有高和低的乳脂含量育种值的荷斯坦奶牛中的基因频率分布具有显著的差异。由外显子1(等位基因G和C)和外显子34(等位基因A和G)组成的单倍型处于连锁不平衡状态。所以Roy等认为FAS基因是乳脂含量QTL的一个候选基因。Chris等[14]通过连锁分析对在牛19号染色体上QTL进行了鉴定,认为FAS是这个QTL的候选基因,且与脂肪和乳脂存在相关性。Sourdioux等[15]对火鸡商品系的研究发现,FAS的多态与瘦肉率的高低存在相关性。张磊等[16]以FAS为候选基因,采用PCR-SSCP方法对FAS的SNP不同基因型与朗德鹅的肥肝性能进行相关分析。结果表明FAS基因可以作为鹅肥肝性状的候选分子遗传标记。
基因与环境的交互作用是指在同样的环境中,不同的基因型作用是不一样的,或者某些基因型相对于另外的基因型对环境改变的敏感度更高[17]。本研究选取了脂肪酸合成酶(FAS)的Af1Ⅱ多态性位点,应用PCR-RFLP方法,旨在探讨FAS-Af1Ⅱ基因多态性与高脂血症的关系。FAS基因在27486082处有一个突变(T→C)产生,在FAS基因的Af1Ⅱ酶切位点上,昆明种小鼠大多数个体表现为CC型,个别为TT型。不同FAS基因型对小鼠的血脂性状具有不同的影响,特别是对于与脂质代谢相关的组织器官如脂肪组织重具有显著的影响(P<0.01)。
[1]闫少芳,肖颖,王军波,等.富含单不饱和脂肪酸的坚果对高脂大鼠血脂水平的影响[J].卫生研究,2003,31(2):120-122.
[2]赵法伋,郭俊生.分子营养学概述[J].营养学报,2006,28(1):1 -3.
[3]陈琴,王文君,上官新晨,等.营养基因组学的研究进展[J].遗传,2008,30(2):129 -134.
[4]Smith S.The animal fatty acid synthase:one gene,one polypeptide,seven enzymes[J].FASEB J,1994,8(15):1248 -1259.
[5]Simith S,Wikowski A,Joshi A K.Structural and functional organization of the animal fatty acid synthase[J].Progress in Lipid Research,2003,40:289 -317.
[6]Chirala S S,Wakil S J.Structure and function of animal fatty acid synthase[J].Lipids,2004,39(11):1045 -1053.
[7]陈琴,王文君,上官新晨,等.葡萄糖转运蛋白4基因多态性与诱导性高血脂症小鼠血脂性状的相关性分析[J].药学学报,2009,56(8):931 -934.
[8]Loftus T M,Jaworsky D E,Frehywot G L,et al.Reduced food intake and body weight in mice treated with fatty acid synthase inhibitors[J].Science,2000,288(5475):2379 -2381.
[9]曾凡勇,秦锐,郭锡熔.脂肪酸合成酶在高脂饮食诱导的肥胖易感和肥胖抗性大鼠白色脂肪组织中的表达差异[J].临床儿科杂志,2007,25(1):54 -57.
[10]Chiang C T,Weng M S,Lin S,et al.Pu-erh tea supplementation suppresses fatty acid synthase expression in the rat liver through down regulating Akt and JNK signalings as demonstrated in human hepatoma HepG2 cells[J].Oncology Research,2005,16(3):119 -128.
[11]孙悦,张冰,刘小青.高甘油三酯高血糖血症大鼠脂糖代谢相关酶活性变化的实验研究[J].中国现代医学杂志,2006,16(23):3542 -3545.
[12]倪红玉,鲁菲,温超,等.饲粮不同油脂来源对肉鸡脂类代谢及相关基因表达的影响[J].动物营养学报,2011,23(10):1677-1683.
[13]Roy R,Ordovas L,Zaragoza P,et al.Association of polymorphisms in the bovine FASN gene with milk-fat content[J].Animal Genetics,2006,37:215 -218.
[14]Morris C A,Cullen N G,Glass B C,et al.Fatty acid synthase effects on bovine adipose fat and milk fat[J].Mammalian Genome,2007,18:64 -74.
[15]Sourdioux M,Breveiet C,Ddelabrosse Y,et al.Association of fatty-acid synthase gene and malic enzyme gene polymorphism with fatness in turkey[J].Poultry Science,1999,78:1651 -1657.
[16]张磊,吴伟,高光,等.脂肪酸合成酶(FAS)的SNP与鹅肥肝性能关联研究[J].吉林农业大学学报,2009,31(1):77-80.
[17]Evans D M,Gillespie N A,Martin N G.Biometrical genetics[J].Biological Psychology,2002,61:33 -51.
