电脉冲介导的治疗性双质粒HBV DNA疫苗的临床安全性及免疫原性研究
2013-04-01杨海燕陈光明崔一民赵侠梅川饶桂荣莫国玉杨若才杨富强
杨海燕,陈光明,崔一民,赵侠,梅川,饶桂荣,莫国玉,杨若才,杨富强
我国是乙型肝炎病毒(HBV)感染的高发区,对此类患者目前尚缺乏有效的治疗方法[1]。DNA疫苗将编码HBV病毒外源蛋白的基因表达载体直接导入机体,以激发机体产生特异性免疫应答,从而提高机体细胞免疫功能以清除病毒感染[2-3]。Davis等[4]于1993年证实HBV DNA疫苗能诱导机体产生较强的HBV特异性细胞免疫应答,比常规HBV疫苗更具优势。目前在美国,预防型和治疗型HBV DNA疫苗已进入临床试验,初步结果显示安全性良好[5-6]。本研究以健康志愿者为研究对象,观察自行研制的电脉冲(EP)介导的治疗性双质粒HBV DNA疫苗在体内的安全性和免疫原性,为下一步临床研究提供依据。
1 资料与方法
1.1 研究对象 本试验筛选足够多的健康受试者以确保有30名受试者入选研究,分为3个剂量组,每组10名。
1.2 纳入及排除标准 纳入标准:①25~55岁,已婚已育的志愿者,男女不限;②近5年无乙型肝炎疫苗注射史;③HBsAg、HBeAg、HBeAb、HBcAb阴性;HBsAb阴性,或HBsAb阳性(数值≤30mU/ml);ALT及AST正常;④体格检查:无有临床意义的阳性体征;⑤胸透:在过去6个月中有医学证据表明胸透结果无有临床意义的异常;⑥心电图、腹部B超等检查无异常;⑦自愿参加本临床试验,已签署知情同意书,同意在研究过程中不参加任何其他试验研究;⑧实验室检测指标:血、尿常规正常;血生化全项(电解质、血糖、肝肾功能、血总胆红素、心肌酶谱、GGT、ALT等)正常;甲状腺功能正常;肿瘤生化指标(CEA、AFP等)正常;凝血酶原时间正常;自身免疫抗体[抗核抗体(ANA)和抗双链DNA抗体]正常;⑨育龄期妇女,但筛选时妊娠试验阴性,并且同意在试验全过程中采取避孕措施者。
排除标准:①任何严重的活动性躯体或精神疾病,被研究者认为可能影响试验的评价或受试者对研究方案的依从。包括但不限于任何肾脏、心脏、肺、血管、神经、消化、代谢(糖尿病、甲状腺疾病和肾上腺疾病)疾病、免疫缺陷病、活动性感染或癌症;②有过敏性体质或药物过敏史者(青霉素过敏者);③酗酒或药物滥用者,或有酗酒或药物滥用病史,研究者认为会妨碍对试验的依从性,影响其参加研究或者影响对结果的解释;④妊娠期或哺乳期妇女,未婚未育者;⑤拒绝合作或因各种原因不能定期随访者;⑥入院前4个月内参加过开发性药物的试验,或3个月内参加过已批准药物的试验,或筛选前1年内参加过3个以上药物试验研究;⑦受试者不能接受电转染疼痛。
1.3 主要试剂及仪器 常规生化和血液化验使用医院现有设备。治疗性双质粒HBV DNA疫苗由广州拜迪生物医药有限公司生产(规格1mg/瓶,溶液制剂,批号:061101/070101/080101)。电脉冲导入仪由上海交通大学药学院研制(型号TERESAIEPT)。抗HBs、HBeAg、HBsAg、HBeAb、HBcAb检测试剂盒购于美国雅培公司。HBV DNA检测试剂盒购于德国罗氏诊断有限公司。IFN-γ ELISA检测试剂盒为美国R&D产品。抗核抗体、抗双链DNA抗体均购自德国欧蒙公司。
1.4 方法 采用单中心、剂量递增的试验设计。
1.4.1 给药时间 为0、4、12、24周,共4次。试验按低、中、高剂量顺序进行,在低剂量组最后一名受试者第2次给药1周后未出现明显不良反应时,中剂量组开始给药,高剂量组给药时间以此类推。另外,每个剂量组又分3次进行,先做2例试验药物,1周后无明显异常时再做3例试验药物,再过1周后无明显异常时做5例试验药物,具体流程见图1。组内每位志愿者给药时间间隔不少于1h。每个剂量组随机分为2组,每组5例,分别使用2种不同输出电压(60V和36V)的电脉冲导入。从保护受试者角度出发,低剂量组在第3次注射后4周仍有60%受试者未产生HBs抗体者及高剂量组第2次注射后已有60%受试者抗HBs阳性时停止试验。
1.4.2 给药方式及方法 使用前将治疗性双质粒HBV DNA疫苗的2个质粒制剂按1:1配伍混合后于三角肌部位注射,并立即进行电脉冲导入。低剂量组和中剂量组每次注射试验药物时,于一侧上臂三角肌部位行肌内注射,高剂量组可在一侧上臂的三角肌部位注射4mg或在两侧上臂的三角肌各注射2mg。
1.4.3 观察指标 分别于给药后0、4、12、29周观察受试者生命体征、物理学诊断指标(心电图、胸透、B超)、实验室检查指标(血、尿常规,血液生化,凝血酶原时间,甲状腺功能,肿瘤标记物)、免疫学检测指标[干扰素γ(IFN-γ)、抗核抗体(ANA)、抗双链DNA抗体]、HBV血清标记物(HBsAg、HBcAb、HBeAg、HBeAb、HBV DNA)的变化;于给药后0、8、12、16、20、24、29周观察抗HBs的变化。
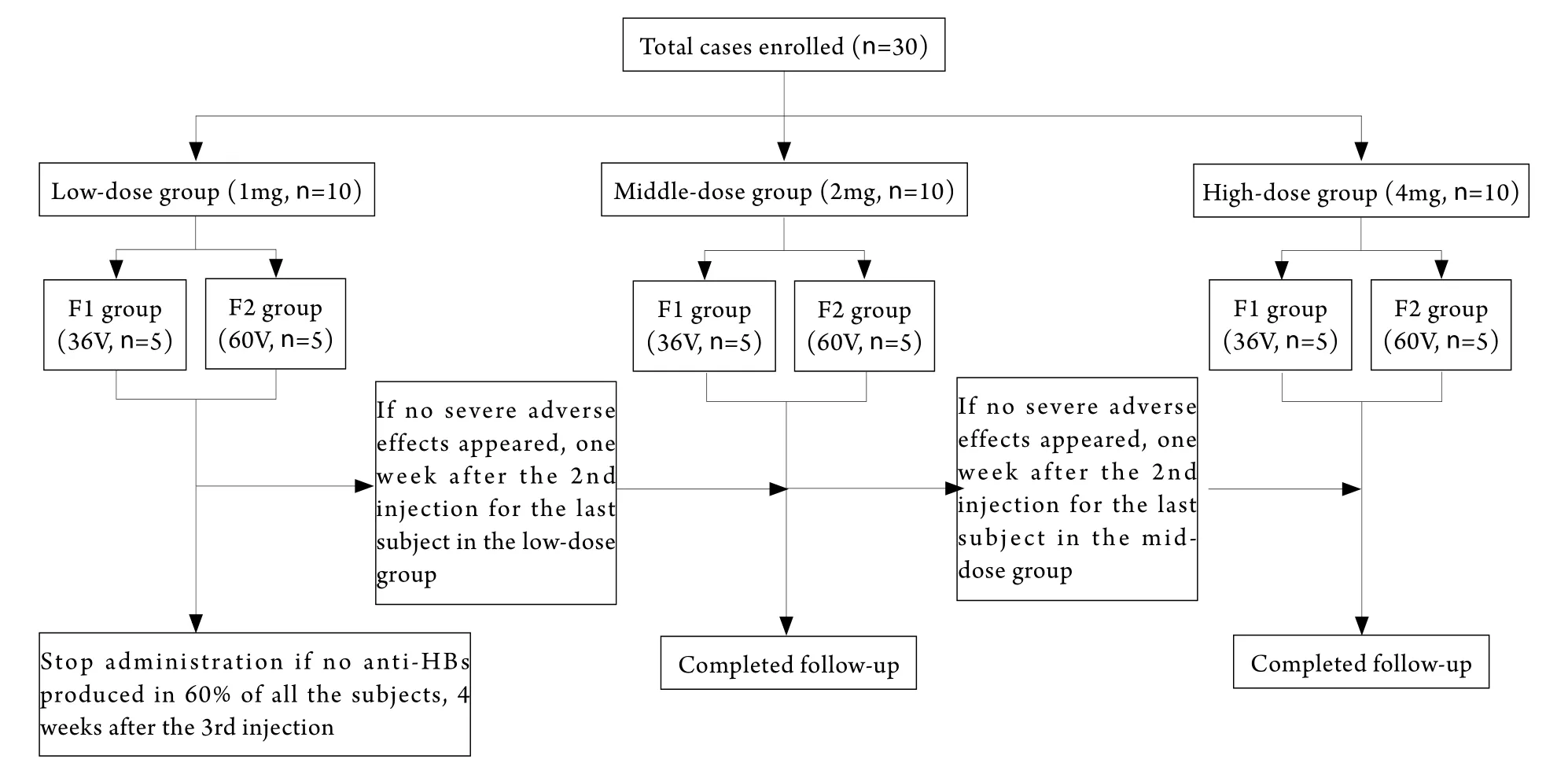
图1 健康志愿者试验分组及给药流程Fig.1 Grouping and flow-sheet of administration in healthy volunteers
2 结 果
本研究在北京大学第一医院国家药品临床研究基地进行,共纳入30例健康志愿者。
2.1 生命体征变化 健康志愿者导入治疗性疫苗前后,心电图、胸透未发现异常,B超发现在29周时高剂量60V组中1例脾脏有轻度偏大,可能与用药有关,其后自行缓解或恢复(表1)。
2.2 实验室检查指标变化 EP介导的HBV DNA疫苗给药前后受试者血、尿常规、凝血酶原时间全部正常,甲状腺功能和肿瘤标记物检测指标均在正常范围内。血液生化指标中,低剂量组29周时1例ALT轻度升高;中剂量组4周、29周时共2例BUN轻度升高;高剂量36V组4、12周时2例CK轻度升高;高剂量60V组29周时1例CK轻度升高。以上均可能与用药有关,且全部能自行缓解或恢复(表2)。
2.3 免疫学指标变化 与用药前相比,中剂量组IFN-γ下降,可能与用药有关。低剂量组第4次未给药,仅为29周复查结果,低剂量组36V和60V在29周各有2例未查IFN-γ。抗核抗体和抗双链DNA抗体全部阴性(表3)。
2.4 血清学指标变化 用药前后健康志愿者HBV血清学指标全部阴性(表4)。
2.5 免疫原性变化 用药前后健康志愿者抗HBs在高剂量组36V中较给药前有升高趋势,其中1例受试者给药后达到17.22mU/ml,与用药有关,说明治疗性HBV DNA疫苗在大剂量组中存在一定的体液免疫原性(表5)。

表1 EP介导的HBV DNA疫苗给药前后受试者物理学诊断指标观察结果(正常例数/异常例数,n=5)Fig.1 Physical diagnosis for volunteers before and after HBV DNA vaccination mediated by in vivo EP (normal cases/abnormal cases, n=5)

表2 EP介导的HBV DNA疫苗给药前后受试者实验室检查指标观察结果(正常例数/异常例数,n=5)Fig.2 Blood biochemistry and routines of the volunteers before and after HBV DNA vaccination mediated by in vivo EP (normal cases/abnormal cases, n=5)

表3 EP介导的HBV DNA疫苗给药前后受试者自身免疫学检测指标结果(n=5)Fig.3 Autoimmune response of the subjects before and after HBV DNA vaccination mediated by in vivo EP(n=5)
3 讨 论
DNA疫苗又称核酸疫苗或基因疫苗,具有传统疫苗所不具备的优势,其表达的蛋白质可作为内源性抗原被递呈,能够有效地诱导机体细胞毒性T淋巴细胞(CTL)的细胞免疫应答[7]。DNA疫苗诱导产生的CTL可识别和溶解体内感染HBV的细胞,可分泌IFN-γ,并可抑制感染细胞内的病毒复制或清除病毒而不引发细胞损伤[8]。治疗性DNA疫苗研制的目的就是提高那些在常规治疗情况下无应答、处于免疫耐受期的乙肝患者的HBV特异性细胞免疫水平,力争打破由HBV长期感染所引起的机体特异性免疫耐受状态,促使机体重新恢复和激活已处于静息状态下的特异性免疫功能,为化学抗病毒药治疗提供适应证,也为那些处于免疫转换期的患者最终清除病毒提供新的手段。
但是,DNA疫苗的物质基础是DNA,其安全性仍然值得关注。质粒DNA与基因组DNA整合的危险性是临床前研究中应该重视的问题,插入的质粒DNA可通过诱导染色体断裂或重组而造成染色体的不稳定。我们在临床前研究工作中采用了尽可能的敏感方法检测EP介导的双质粒HBV DNA疫苗的组织分布,结果未发现质粒DNA与宿主基因组DNA的整合,且质粒DNA在体内代谢较快,不会在组织中长期存留和表达[8-9]。由于双质粒HBV DNA疫苗中包含了超螺旋双链DNA,且融合表达人源性细胞因子(IL-2/IFN-γ),临床前及临床试验研究中都要特别考虑免疫系统中细胞或体液调节组分可能引起的无法预料的不良反应,如免疫抑制、慢性炎症、自身免疫或其他免疫学疾病。从本试验结果中可以看出,受试者接受疫苗治疗前后生命体征平稳,血、尿常规、血生化、甲状腺功能、肿瘤标记物等未见明显异常改变,极少数出现一过性体检指标的升高或轻度异常,但全部自行缓解或恢复;ANA、抗双链DNA抗体全部阴性,未检出佐剂质粒表达产物IFN-γ的升高,说明其自身免疫状况稳定;本临床Ⅰ期试验中HBV DNA在治疗前后一直处于正常值范围内,说明该疫苗DNA未与宿主细胞基因组DNA发生整合,提示其遗传毒理指标是正常、安全的。

表4 EP介导的HBV DNA疫苗给药前后受试者HBV血清标记物观察结果(阴性例数/阳性例数,n=5)Fig.4 HBV serology of the volunteers before and aft er HBV DNA vaccination mediated by in vivo EP (negative cases/positive cases, n=5)
表5 EP介导的HBV DNA疫苗给药前后受试者抗HBs变化观察结果(±s, n=5)Fig.5 Serum anti-HBs status of the volunteers before and after HBV DNA vaccination mediated by in vivo EP(±s, n=5)

表5 EP介导的HBV DNA疫苗给药前后受试者抗HBs变化观察结果(±s, n=5)Fig.5 Serum anti-HBs status of the volunteers before and after HBV DNA vaccination mediated by in vivo EP(±s, n=5)
The results at the 29th week are those of the repeated detection in the low-dose group, in which the 4th injection was not given for each subject;There was an elevation of anti-HBs in the high-dose group with 36V EP; "-". No detection
Groups 0 week 8th week 12th week 16th week 20th week 24th week 29th week Low-dose group 36V 0.10±0.11 0.04±0.08 0.16±0.06 0.06±0.11 - - 0.00±0.00 60V 0.07±0.08 0.03±0.05 0.23±0.21 0.11±0.25 - - 0.00±0.00 Middle-dose group 36V 0.08±0.06 0.09±0.13 0.17±0.10 0.17±0.14 0.11±0.13 0.05±0.10 0.08±0.10 60V 0.35±0.72 0.29±0.64 0.38±0.62 0.38±0.40 0.59±1.06 0.59±1.06 0.32±0.41 High-dose group 36V 0.14±0.32 0.33±0.74 0.81±1.81 1.67±2.77 2.02±4.32 2.31±4.38 3.47±7.69 60V 0.03±0.07 0.22±0.32 0.27±0.46 0.35±0.43 0.38±0.43 0.20±0.23 0.08±0.17
从本研究中也不难看出,EP介导的双质粒HBV DNA疫苗诱导健康受试者体液免疫应答的免疫原性较低,可能与DNA疫苗主要是以诱导细胞免疫为主有关;同时,我们应用的佐剂质粒将免疫应答向Th1方向转化,更有助于细胞免疫应答;我们已报道的试验结果[10]证实HBV DNA疫苗能够诱导特异性的细胞免疫功能,充分说明双质粒HBV DNA疫苗作为治疗性疫苗具有其必备的较强的特异性细胞原性。另外,受试者在接受治疗前可能已对预防性乙肝表面抗原疫苗不应答或本身为免疫耐受的体质,故不易产生较强的体液免疫应答。再者,本试验采用的是两点肌注联合EP介导,因为采用多点肌注联合EP介导可能会引起较强的体液免疫应答。
综上所述,HBV DNA疫苗在健康志愿者中是安全的,其在大剂量组中存在一定的体液免疫原性,本研究结果可为下一步以HBV慢性感染者为研究对象提供依据,以进一步考察细胞的免疫应答。
[1] Liu Y, Xu ZH, Liu LM, et al. Genotypic and phenotypic characteristics of multidrug-resistant hepatitis B virus infection in Chinese hepatitis B patients[J]. Med J Chin PLA, 2012,37(6): 539-543. [刘妍, 许智慧, 刘立明, 等. 我国患者多重耐药乙肝病毒感染的基因型和表型特点[J]. 解放军医学杂志,2012, 37(6): 539-543. ]
[2] Manchini M, Hudchonel M, Tiollais P, et al. Regulation of HBV mRNA expression in a HBsAg transgenic mouse model by IFN-γ secreting T cells after DNA based immunization[J]. J Immunol, 1998, 161(10): 5564-5570.
[3] Chen GM, Yang FQ. Development and application of therapeutic HBV DNA vaccine[J]. Med J Chin PLA, 2003, 28(6): 489-492.[陈光明, 杨富强. 治疗型HBV DNA疫苗的研究与应用[J].解放军医学杂志, 2003, 28(6): 489-492.]
[4] Davis HL, McCluskie MJ, Gerin JL, et al. DNA vaccine for hepatitis B: evidence for immunogenicity in chimpanzees and comparison with other vaccines[J]. Proc Natl Acad Sci USA,1996, 93(14): 7213-7218.
[5] Tacket CO, Roy MJ, Widera G, et al. Phase 1 safety and immune response studies of a DNA vaccine en coding hepat it is B surface antigen delivered by a gene delivery device[J]. Vaccine, 1999,17(22): 2826-2829.
[6] Thong PL, Kevin M, Coonan Richard C, et al. Safety,tolerability and humoral immune responses after intramuscular administration of a malaria DNA vaccine to healthy adult volunteers[J]. Vaccine, 2000, 18(18): 1893-1901.
[7] Mancini-Bourgine M. Induction or expansion of T-cell responses by a hepatitis B DNA vaccine adm inistered to chronic HBV carriers[J]. Hepatology, 2004, 40(4): 874-882.
[8] Mo GY, Chen GM, Huang ZY, et al. A study of distribution in the tissues and long term toxicity of therapeutic DNA vaccine in mice[J]. Med J Chin PLA, 2003, 28(6): 504-507. [莫国玉, 陈光明, 黄芝瑛, 等. 治疗型HBV DNA疫苗在小鼠组织中的分布和长期毒性研究[J]. 解放军医学杂志, 2003, 28(6): 504-507.]
[9] Yang FQ, Liu HP, Mo GY, et al. Effect of therapeutic dualplasmid HBV DNA vaccine on immune function in cancrivorous monkeys[J]. Med J Chin PLA, 2008, 33(6): 695-697. [杨富强,刘惠萍, 莫国玉, 等. 治疗型双质粒HBV DNA疫苗对食蟹猴免疫功能的影响[J]. 解放军医学杂志, 2008, 33(6): 695-697.]
[10] Yang FQ, Yu YY, Wang GQ, et al. A pilot randomized controlled trial of dual-plasmid HBV DNA vaccine mediated by in vivo electroporation in chronic epatitis B patients under lamivudine chemotherapy[J]. J Viral Hepatitis, 2012, 19(8): 581-593.
