卷烟全烟气直接暴露方法的研究进展
2013-03-21夭建华胡明阳米其利黄海涛唐萍李雪梅缪明明
夭建华, 胡明阳, 米其利, 黄海涛, 唐萍,李雪梅,缪明明
1云南烟草科学研究院,昆明市高新技术产业开发区科医路41号 650106;
2昆明理工大学生命科学与技术学院,昆明市呈贡新区景明南路727号 650500
通常在毒理学试验中,染毒方式对试验结果有重要的影响。在采用细菌回复突变试验(Ames试验)、体外细胞微核试验和中性红细胞毒性试验[1-4]进行烟用添加剂安全性评价和卷烟烟气毒理学评价中,目前国内外烟草公司及相关的标准[5-7]均是采用吸烟机抽吸卷烟、剑桥滤片捕集烟气总粒相物,再用二甲基亚砜(DMSO)将剑桥滤片上的烟气总粒相物萃取出来后,与细菌或细胞一起培养,来检测主流烟气总粒相物的遗传毒性或细胞毒性。这种经典方法的优点是烟气样品可以保存大约几个月的时间,缺点是不能真正地反映新鲜烟气的物理和化学特征,因为在这种测试中对烟气气相组分的关注很少,粒相物、气相物和挥发性物质间的相互作用也没有被考虑,另外,烟气长时间放置后,化学成分发生变化会导致检测结果的不稳定。因此,全烟气直接暴露法就应运而生。
卷烟全烟气直接暴露方法是一种借鉴气体染毒特点而建立的应用于卷烟烟气细菌和细胞染毒的新方法。1999年,德国Fraunhofer毒理学和实验医学研究所的Aufderheide等首次报道了将细胞培养在气液界面进行气体暴露的Cultex细胞培养装置和技术[8],该技术被用于气体的细胞毒性研究。后来为适应卷烟烟气的毒性研究,开发了和吸烟机连接的整套系统,即卷烟全烟气暴露系统装置。
在卷烟全烟气直接暴露法中,将卷烟经吸烟机抽吸产生的全部烟气即时与空气稀释后,直接通入到培养有鼠伤寒沙门氏菌或测试细胞的暴露容器中,烟气与位于气液界面(air/liquid interface)的细菌或细胞直接接触来达到全烟气暴露的目的,暴露后的细菌或细胞可继续进行毒理学效应的测试,例如进行细胞毒性试验、微核试验和Ames试验等。全烟气暴露浓度用稀释后的烟气中TPM浓度作为指标进行控制。这种暴露方式使卷烟烟气处于相对“原始”(native)的状态,能相对模拟人吸烟时人体细胞接触烟气的情况,因而更能及时反映出细菌或细胞暴露于全烟气成分中的真实情况。因此,全烟气暴露方法作为一种新方法和新技术,正引起国内外烟草科研人员的关注。近几年,在CORESTA和TSRC会议上关于该研究的交流论文较多[9-15]。目前,CORESTA体外毒理学小组也在积极进行全烟气直接暴露方法的研究,并组织了相关的共同试验和学术交流[16]。
卷烟全烟气直接暴露研究的核心是暴露装置和条件。由于卷烟全烟气直接暴露方法是将培养的细胞暴露到烟气中,因此,在体外暴露系统设计中必须实现以下要点[17]:(1)受试气体产生的精确控制;(2)受试气体的暴露时间和物理化学特性的精确控制;(3)细胞或细菌和受试气体尽可能紧密接触;(4)系统设计应该利于其暴露时间的扩展,一般细胞暴露于环境空气中,会由于干燥而导致钝化,因此暴露装置应该有温度和湿度维持系统来保证细胞或细菌的正常生长;(5)暴露后可以测定有代表性的终点,就像在动物试验和临床试验一样,必须有可以分析毒理学效应的标志物。
目前报道的卷烟全烟气直接暴露方法中,测试细胞或细菌与烟气的接触方式主要有两种类型,一种是气液界面接触式,即测试细胞或细菌处于相对固定状态(测试细胞处于贴壁状态,测试细菌被涂布在固体培养基上),一种是气液接触式,即测试细胞处于悬浮状态,烟气通入细胞悬浮液中达到烟气暴露的目的。商品化装置日本的Cultex[18]和德国的Vitrocell[19],这两种设备基本相同,暴露方式均是气液界面接触式。IT公司(Imperial Tobacco UK)设计的卷烟全烟气细胞暴露装置是基于气液接触式暴露方式[16]。
1 气液界面接触式烟气暴露方式
基于贴壁细胞的气液界面接触式烟气暴露方式是将卷烟烟气直接通入培养于半透膜上的测试细胞,使测试细胞与烟气处于气液界面上而达到烟气暴露的目的。目前,采用此种暴露方式的暴露装置有两类,一类是商品化的暴露装置,如日本的Cultex[18]和德国的Vitrocell[19],一类是烟草研究机构自行设计的暴露装置,如BAT烟草公司的暴露装置[20],以及美国Battelle公司[16]和郑州烟草研究院的暴露装置[21]。
1.1 Cultex和Vitrocell的气液界面接触式烟气暴露方式
1.1.1 暴露原理
由于Vitrocell[19]和Cultex全烟气暴露系统装置的工作原理和基本构造相同,Cultex的开发早于Vitrocell,且Cultex的报道较为系统,因此以Cultex为例介绍此类烟气暴露方法。Cultex的暴露原理是将测试细胞或细菌固定在基质上,再进行烟气暴露,即将细胞种植transwell小室(porous transwellTM)的底部有孔膜上,将细菌涂布在固体培养基上。暴露装置由吸烟机、烟气稀释分配系统、培养基供应系统、培养基温度维持系统以及细胞/细菌暴露装置共五个部分组成[18-19]。图1所示的是Vitrocell全烟气暴露装置的工作示意图。用于贴壁细胞的烟气暴露时,将细胞种植于一种特殊的可转移的transwell小室(porous transwellTM)的底部膜上,小室底部接触培养液,烟气从烟气稀释分配系统进入暴露腔,和transwell小室上的细胞接触后,由废气出口流出,完成烟气的细胞暴露反应。暴露一定时间后,取出transwell小室,继续进行细胞毒性指标试验[20]。因此,细胞是位于气-液界面上进行烟气暴露,烟气直接接触细胞,从而实现全烟气的暴露。

图1 商品化全烟气细胞暴露装置工作示意图(摘自文献[18-19],略作修改)
用于Ames试验的暴露装置其原理和装置构造与细胞暴露的相似,只是用培育有细菌的培养皿代替种植细胞的transwell小室,直接将培养皿置于烟气暴露腔中进行烟气暴露,暴露一定时间后,将培养皿取出继续进行Ames试验[22]。
1.1.2 应用研究
国外各研究机构关于Cultex和Vitrocell暴露装置在烟草烟气毒理学评价中的可行性研究和应用研究较为深入和全面,并取得了较好结果。Roper等研究了全烟气暴露对细胞的溶酶体活性(中性红摄入法)和代谢活性(MTS代谢活性法)的影响,测试结果显示全烟气暴露方法可行,数据可靠[9]。Eguchi等使用Cultex暴露装置研究了不同卷烟烟气对A549人肺上皮细胞的毒性作用,得出结论全烟气暴露装置是评价卷烟烟气生物学活性的有效方式[10]。Fukano等使用Cultex暴露装置得到的细胞毒性试验结果表明,烟气对哺乳动物细胞的作用大小主要由抽吸口数和烟气浓度决定[12]。Nishino等利用Cultex暴露装置研究了传统烟气捕集方法所忽略的烟气组分-非水溶性气相物,并用中性红摄入法评价了非水溶性气相物的细胞毒性[13];此外,他们还利用Cultex全烟气暴露装置进行了全烟气暴露下体外微核法的研究,结果表明全烟气暴露下诱发的细胞微核率明显高于传统捕集方法萃取得到的烟气样品所诱发的细胞微核率[14]。Aufderheide等应用全烟气暴露法研究了卷烟烟气对于鼠伤寒沙门氏菌的诱变性,结果显示,相比较于传统的烟气测试方法,全烟气暴露下细菌诱变的敏感性提高了[15]。Ritter等采用全烟气暴露法比较了不同卷烟烟气的细胞毒性情况,结果表明全烟气暴露法在评价不同类型卷烟的细胞毒性差异方面具有可行性[23]。Olivera等研究发现,全烟气暴露下人支气管上皮细胞的紧密连接结构及其通透性发生改变[24]。Roller等应用Ames试验结合全烟气暴露法,对6种卷烟烟气的致突变性数据进行了统计和分析,结果表明全烟气暴露法适用于卷烟烟气的致突变性评价[25]。
1.1.3 优缺点
此类暴露装置在烟草全烟气分析及环境气体分析中有着广泛的应用,已经商品化,装置和使用方法较为规范,并且能够同时实现贴壁培养细胞、组织以及细菌的直接暴露,检测结果具有剂量-反应关系。但是,此类暴露装置价格昂贵,普通实验室难以负担,这也在一定程度上限制了此类装置的推广和普及。
1.2 BAT公司的气液界面接触式烟气暴露方式
1.2.1 暴露原理
BAT公司(British American Tobacco)自行开发设计了用于细胞毒性测试的连接吸烟机的细胞暴露装置[16],见图2,其暴露原理同Cultex的细胞暴露原理基本相同,细胞种植于transwell小室(porous transwellTM)的半透膜上,其下以一定流速的培养液为其提供基本生活条件,细胞位于气-液界面上暴露,烟气直接接触细胞,从而实现全烟气暴露。
1.2.2 应用研究
BAT公司使用此暴露装置,将人肺上皮细胞暴露于卷烟全烟气中,研究了卷烟全烟气对人肺上皮细胞的毒性作用[26],并且通过此烟气暴露装置研究了卷烟全烟气的生成及评价方面的注意事项[27]。Massey等将哺乳动物细胞暴露于3R4F卷烟的一系列稀释烟气后用体外微核试验(双核法)来检测,发现细胞毒性与稀释剂量有相关性,而微核诱导作用明显缺乏剂量响应[11]。

图2 BAT公司全烟气细胞暴露装置示意图(图片摘自文献[16],略作修改)
1.2.3 优缺点
BAT公司自行开发的全烟气暴露装置构造简单、结构合理,和Cultex和Vitrcell一样,采用了transwell小室来实现细胞的培养,可以达到全烟气暴露实验的要求,有很好的应用前景。
1.3 Battelle公司的气液界面接触式烟气暴露方式
1.3.1 暴露原理
美国Battelle公司实验室用细胞培养瓶改装制作了简单且易操作的全烟气暴露装置[16],如图3所示,细胞贴壁培养于细胞培养瓶中,用洁净空气稀释的烟气以一定流速通入种有细胞的培养瓶中,振荡器左右振荡一定的角度使培养瓶中的培养液左右流动从而使细胞与烟气进行直接接触暴露,达到全烟气直接暴露的目的。暴露一定时间后,继续培养24h后,进行细胞毒性试验。在这种暴露方式中,烟气并不是完全直接和细胞接触,会有部分培养液残留,从而烟气会有部分在培养液中,细胞的暴露方法介于Cultex和IT公司开发的装置(见2.1)的暴露方式之间。
1.3.2 应用研究
卢斌斌等采用Battelle公司装置进行了全烟气暴露法研究,比较了3种不同焦油含量的卷烟烟气的细胞毒性[21],见图4。在该研究中,暴露时间为60 min,每个样品通过调节空气与烟气的稀释比例暴露6个浓度(15~150μg/L),每个浓度6个平行样品,6个对照样品。整个暴露过程根据监测的TPM/L值进行控制。暴露结束后,将培养瓶中的培养液换成新鲜的培养液,并置于CO2培养箱中37℃下培养24 h。对照为6个通入洁净空气并经过相同条件培养的平行样品。测试结果显示,随着烟气暴露浓度的增大,卷烟烟气引起细胞死亡数量增大。上述研究结果提示,Battelle公司暴露装置可用于卷烟烟气的细胞毒性评价。

图3 Battelle公司自行改装的全烟气暴露瓶(图片摘自文献[16],略作修改)

图4 郑州烟草研究院的全烟气暴露装置(图片摘自文献[21])
1.3.3 优缺点
由细胞培养瓶改造而成的全烟气暴露装置结构简单、易操作,在普通实验室内即可实现,可以满足实验室简单的细胞全烟气暴露的相关研究。由目前的研究内容来看,该暴露装置仅限于烟气对细胞的影响作用研究,未见更为系统和深入的文献报道。
2 气液两相接触式烟气暴露方式
关于气液两相接触式烟气暴露方式,目前仅见IT公司的报道。
2.1 暴露原理
IT公司设计和制作了直接将96孔细胞培养板进行全烟气暴露的装置[16],如图5所示,细胞贴壁生长在96孔细胞培养板的每个培养孔底部,经清洁空气稀释后的烟气通过类似烟气注射的方式通到每个培养孔中,暴露一定时间后,将96孔细胞培养板取出后继续培养,进行中性红细胞毒性试验。这种暴露方式和Cultex不一样,烟气是通过培养液中与细胞接触,从而实现全烟气的暴露。
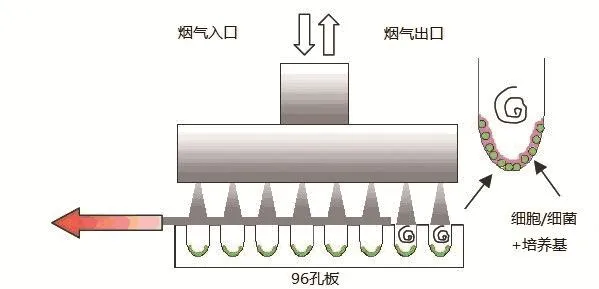
图5 IT公司全烟气细胞暴露装置示意图(图片摘自文献[16],略作修改)
2.2 应用研究
Wieczorek等应用上述装置,将培养有人肺上皮细胞的96孔细胞培养板直接暴露于全烟气中,证明了96孔细胞培养板用于全烟气暴露的可行性[28]。Achard等应用上述装置研究了不同卷烟的全烟气毒性,采用中性红摄入法比较了其细胞毒性,并用彗星试验比较了其遗传毒性,研究了滤嘴对于烟气毒性的影响,结果表明,中性红摄入法和彗星试验结合全烟气暴露装置可以有效评价不同卷烟烟气的细胞毒性和遗传毒性[29]。
2.3 优缺点
IT公司开发的全烟气暴露装置专用于96孔细胞培养板中细胞的全烟气直接暴露,操作简单,对设备要求也不是很高,而且因为直接使用96孔细胞培养板暴露,对烟气暴露试验的后期中性红摄入法处理比较方便。
3 烟气暴露量的控制及表征
在全烟气暴露装置中,烟气的暴露剂量控制非常关键[30]。在Cultex和Vitrocell暴露装置中,烟气的暴露剂量通过稀释分配系统控制。吸烟机抽吸卷烟产生的新鲜烟气以一定的抽吸容量被压入稀释系统中,经流速恒定的清洁空气稀释后以一定的速度经过暴露腔。清洁空气的流速由气体流量控制器和真空管控制,经过暴露腔的经清洁空气稀释的烟气流速由真空泵产生的负压和气体流量控制器控制。
烟气暴露剂量根据进入暴露腔中的量计算,根据公式1以烟气百分比表示。公式中的分子是最终经过暴露腔的烟气流速;分母是烟气和清洁空气的流速,即经过稀释系统的总烟气的流速。
公式1(摘自文献[22]):

美国Battelle公司的全烟气暴露装置烟气暴露剂量是通过不同流速洁净空气对主流烟气进行稀释从而使细胞暴露于不同浓度的烟气实现的。烟气暴露浓度以稀释后的烟气中总粒相物(TPM)浓度为指标进行控制[21]。在ISO标准条件下抽吸卷烟,产生的主流烟气用洁净空气稀释,稀释后的烟气直接导入盛有细胞的培养瓶中。烟气暴露浓度以稀释后的烟气中总粒相物(TPM)浓度为指标进行控制。
4 全烟气暴露试验的重要影响因素分析
由于Cultex暴露装置被广泛应用于挥发性物质毒理研究和环境空气的研究,对其的研究较为系统深入,Aufderheide等对Cultex暴露系统进行了长达十年的研究,发表了许多研究论文,内容涵盖全烟气暴露试验的重要影响因素研究、应用Cultex暴露装置进行混合气体和烟气的毒理学研究等。
4.1 空气流速
Aufderheide等使用Cultex暴露装置,研究了空气流速对细胞存活率的影响[8]。将人肺成纤维细胞暴露于含有20.5%的氧气和氮气组成的空气中5-120 min,流速分别为 667、33、16.7、12.7和 8.3 mL/min,反应条件为25℃,90%相对湿度,没有二氧化碳。结果显示,随着测试气体流速的降低,细胞存活率急剧升高。由此可见,气体流速会对细胞的存活率产生一定的影响。因此,进行烟气暴露试验时应充分考虑烟气的通入速率。
4.2 试验温度
Knebel等研究发现在复杂气体暴露试验中,全烟气暴露系统中的反应腔温度由25℃提高到37℃时,由于清洁空气会产生较大的蒸发,引起了细胞存活率的降低[31]。因此,进行烟气暴露试验时应充分考虑温度对暴露体系和检测结果的影响。
4.3 Ames试验中顶部培养层的厚度
Aufderheide等发现在细菌回复突变试验研究中,细菌存活率和顶部培养层体积呈正相关性,即随着顶层培养基体积的增大,细菌存活率随着升高。通过分析还发现直接涂布法和琼脂覆层法对阳性结果有较大影响,并且可以得到结论:用琼脂覆层法比直接涂布法获得阳性反应结果较少,两者区别明显[32]。
4.4 吸烟机和暴露装置间的距离
Aufderheide等认为由于烟气成分复杂,在其产生后有可能发生各种组分间的化学反应,为避免烟气老化,最好能在烟气产生的10秒内到达暴露腔内[8]。
4.5 Ames试验测试菌株的质粒
Aufderheide等研究发现,质粒PKM101对测试菌株的回复突变有着重要作用。在检测全烟气的致突变性时,质粒pKM101是必需的,在移码突变中的作用比在错义突变中的更大[32]。
4.6 代谢活化系统S9
Aufderheide等在细菌回复突变试验研究中发现,同一平行试验中,是否加入30%的S9,对阳性结果有着显著影响,其阳性结果中细菌回复突变数的差距可达数十倍[32]。
从以上的分析可以看出,全烟气暴露试验中存在着较多的影响因素,因此在进行全烟气暴露试验设计时,应充分考虑上述影响因素对检测体系和结果的影响。
5 讨论与展望
在全烟气暴露方法中,烟气暴露量的控制和监测是一个研究难点,各国科学家正在努力攻关[8,22,27,34]。目前所采用的方法主要是分别对烟气的粒相成分和气相成分以及其他烟气中的单一物质(例如甲醛等)进行测定,但不能实现全烟气暴露量的在线实时监测。德国CULTEX实验室研究人员对Cultex暴露装置的烟气沉降以及烟气浓度监测进行了大量研究,例如为测定粒相物在细菌平皿中的沉降情况,采用将剑桥滤片捕集的粒相物经甲醇萃取后测定萃取液的Ex/Em(355nm/485nm)值,结果表明,粒相物在细菌平皿中的沉降效率取决于暴露小室内的气体流速;使用散射光装置和一氧化碳和/或二氧化碳(CO和/或CO2)分析仪分别在线监测了在Cultex暴露装置中卷烟侧流烟气的粒相物和CO和/或CO2(用来表征气相物)的浓度,结果表明,实验过程中不同稀释倍数的侧流烟气的浓度具有重复性和稳定性[17,22,35,36]。在CORESTA体外毒理学小组2011年4月和10月两次会议上,各家实验室对全烟气暴露中使用散射光装置或CO分析仪以及其他烟气中的单一物质监测烟气浓度进行了讨论。随着各实验室研究的深入,研究人员可以紧密跟踪并了解这个新领域新方向的研究进展情况。
总之,尽管全烟气暴露方法还存在很多需要改进和优化的地方,但作为一种比传统方法更为客观和直接的卷烟烟气暴露方式,相信该方法会在不久的将来,被越来越多的烟草公司、研究机构和检测机构所关注,使该方法能更好地为低危害卷烟毒理学评价和烟用添加剂安全性评价服务。
[1] Baker R B, Massey E D, Smith G. An overview of the effects of tobacco ingredients on smoke chemistry and toxicity [J].Food and chemical Toxicology, 2004, 42S: 53-83.
[2] Roemer E, Tewes F J,Meisgen T J, et al. Evaluation of the potential effects of ingredients added to cigarettes. Part 3: In vitro genotoxicity and cytotoxicity [J]. Food and chemical toxicology, 2002, 40(1): 105-111.
[3] Andreoli C, Gigante D, Nunziata A. A review of in vitro methods to assess the biological activity of tobacco smoke with the aim of reducing the toxicity of smoke [J]. Toxicology in vitro, 2003, 17(5): 587-594.
[4] Rickert w S, Trivedi A H, Momin R A, et al. Effect of smoking conditions and methods of collection on the mutagenicity and cytotoxicity of cigarette mainstream smoke. Toxicological sciences, 2007, 96(2): 285-293,
[5] Canada Health official Method T-501. Bacterial reverse mutation assay for mainstream tobacco smoke [S]. Second Edition 2004-11-01.
[6] Canada Health off i cial Method T-502. Neutral red uptake assay for mainstream tobacco smoke [S]. Second Edition 2004-11-01.
[7] Canada Health off i cial Method T-503. In vitro micronucleus assay for mainstream tobacco smoke [S]. Second Edition 2004-11-01.
[8] Aufderheide M, Mohr U. Cultex--a new system and technique for the cultivation and exposure of cells at the air/liquid interface [J]. Exp Toxicol Pathol.,1999,51(6):489-90.
[9] Roper W, Wieczorek R. In vitro cytotoxicity of cigarette mainstream smoke. Evaluation of different cell exposure methods, including ‘native’ smoke aerosol exposure [C].2002 Coresta Congress, 2002.
[10] Eguchi K, Fukano Y, Suzuki M, et al. In vitro cytotoxicity of cigarette mainstream smoke with a whole smoke exposure system [C]. 2003 CORESTA Congress, 2003.
[11] Massey E D, Williamson J, Phillips J. 一种哺乳动物细胞在气液界面上体外感受总烟气的方法 [C]// 第56届烟草科学研究会议论文集, 2003.
[12] Fukano Y, Suzuki m, Ogura m. 研制一种用于哺乳动物细胞暴露于卷烟烟气中的体外暴露装置 [C]//第56届烟草科学研究会议论文集, 2003.
[13] Nishino T, Nara h, Fukano Y. Detection of cytotoxicity in the water-insoluble fraction of cigarette smoke gas vapor phase using a whole smoke exposure system [C]. 2007 Coresta Congress, 2007.
[14] Nishino T, Okuwa k, Fukano Y. In vitro micronucleus assay for cigarette smoke using a whole smoke exposure system [C].2008 Coresta Congress, 2008.
[15] Aufderheide M, Mohr U. The use of the modified Cultex®system for the direct exposure of bacteria to mainstream cigarette smoke [C]. 2004 Coresta Congress, 2004.
[16] Coresta in vitro toxicology task force. In vitro exposure of cells to smoke at the air liquid interface [EB/OL]. http:///www.CORESTA.org.
[17] Aufderheide M. An efficient approach to study the toxicological effects of complex mixtures [J]. Experimental and Toxicologic Pathology, 2008, 60(2-3):163-180.
[18] Cultex® Laboratories. http://www.cultex.com/ . 浏览时间:2011-4-9.
[19] Vitrocell Systems GmbH. http://www.vitrocell.com/ . 浏览时间:2011-4-9.
[20] Gaca M, Phillips J, Thorne d, et al. A new system for measuring the toxicity of mainstream cigarette smoke [C].2005 Coresta Congress, 2005.
[21] 卢斌斌, LynneWisse R M. 3 种不同焦油卷烟烟气的细胞毒性比较 [J]. 烟草科技, 2007, 12: 38-41.
[22] Aufderheide M, Gressmann H. A modif i ed Ames assay reveals the mutagenicity of native cigarette mainstream smoke and its gas vapour phase [J]. Experimental and Toxicologic Pathology,2007, 58(6): 383-392.
[23] Ritter D J, Knebel JW, Aufderheide M. Comparative assessment of toxicities of mainstream smoke from commercial cigarettes [J]. Inhalation Toxicology, 2004, 16(10): 691-700.
[24] Olivera DS, Boggs SE, Beenhouwer C, et al. Cellular mechanisms of mainstream cigarette smoke-induced lung epithelial tight junction permeability changes in vitro [J].Inhalation Toxicology, 2007, 19(1): 13-22.
[25] Roller M, Aufderheide M. Statistical analysis of in vitro data for risk assessment - exemplified for a case of Ames test data [J].Experimental and Toxicologic Pathology, 2008, 60(2-3): 213-24.
[26] Richter A, Maunders H, Massey E D, et al. A toxicogenomic study of primary human lung epithelial cells exposed to whole cigarette smoke [C]. 2005 Coresta Congress, 2005.
[27] Adamson J, Azzopardi D, Dickens C J, et al. Generation and assessment of whole cigarette smoke to in vitro systems -British American Tobacco’s experience [C]. 2010 Coresta Congress, 2010.
[28] Wieczorek R, Roper W, Burghart H. Validation of a new smoking machine for the exposure of 96 well cell culture plates to‘native’ cigarette mainstream smoke aerosol. Course of action and some in vitro toxicological data [C]. 2005 Coresta Congress, 2005.
[29] Achard S, Blin N, Sevestre O, et al. Assessment of cigarette whole smoke biological activity [C]. 2006 Coresta Congress, 2006.
[30] Okuwa K, Tanaka M, Fukano Y, Nara H, et al. In vitro micronucleus assay for cigarette smoke using a whole smoke exposure system: A comparison of smoking regimens [J].Experimental and Toxicologic Pathology, 2010, 62(4): 433-440.
[31] Knebel JW, Ritter D, Aufderheide M. Exposure of human lung cells to native diesel motor exhaust— development of an optimized in vitro test strategy [J]. Toxicology in Vitro, 2002,16(2): 185-192.
[32] Aufderheide M, Gressmann H. Mutagenicity of native cigarette mainstream smoke and its gas/vapour phase by use of different tester strains and cigarettes in a modif i ed Ames assay[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2008, 656(1-2): 82-87.
[33] Luo Y, Peter M, V, Xiaogang L, et al. Native polycystin 2 functions as a plasma membrane Ca2+-permeable cation channel in renal epithelia [J]. Molecular and Cellular Biology,2003, 23(7): 2600-2607.
[34] Adamson J, Kaur N, Lacasse M, et al. Characterisation of a cigarette smoking machine designed for air-liquid interface exposures: an inter- laboratory study [C]. 2011 Coresta joint meeting of the smoke science and product technology study groups, 2011.
[35] Aufderheide M, Ritter D, Knebel JW, et al. A method for in vitro analysis of the biological activity of complex mixtures such as sidestream cigarette smoke [J]. Experimental and Toxicologic Pathology, 2001, 53: 141-152.
[36] Aufderheide M, Knebel JW, Ritter D. An improved in vitro model for testing the pulmonary toxicity of complex mixtures such as cigarette smoke [J]. Experimental and Toxicologic Pathology, 2003, 55: 51-57.
